24 gesichtete, geschützte Fragmente: Plagiat
| [1.] Aak/Fragment 039 11 - Diskussion Bearbeitet: 17. August 2014, 22:34 WiseWoman Erstellt: 15. August 2014, 06:49 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 39, Zeilen: 11-19 |
Quelle: Abraha 2005 Seite(n): 51, Zeilen: 11-19 |
|---|---|
| Mittels digitaler Photoplethysmographie wurden die Fingervolumenpulswellen kontinuierlich bestimmt und durch den Vascular Index (RI) quantifiziert. Die Endothelfunktion wurde durch die Veränderung des Vascular Index im Rahmen der flussabhängigen Vasodilatation nach kurzzeitiger suprasystolischer Stauung am Oberarm gemessen. Mittels Applanationstonometrie der Arteria radialis wurde die Steifigkeit der großen und kleineren arteriellen Gefäße bestimmt und durch die Indices S1 und S2 quantifiziert.
Während der Hämodialysebehandlung kam es zu einem signifikanten Anstieg des RI [...] |
Mittels digitaler Photoplethysmographie wurden die Fingervolumenpulswellen kontinuierlich bestimmt und durch den Vascular Index (RI) quantifiziert. Die Endothelfunktion wurde durch die Veränderung des RI im Rahmen der flussabhängigen Vasodilatation nach kurzzeitiger suprasystolischer Stauung am Oberarm gemessen. Mittels Applanationstonometrie der Arteria radialis wurde die Steifigkeit der großen und mittleren Arterien bestimmt und durch die Indices S1 und S2 quantifiziert. Weiterhin wurden der Augmentation Index und die Pulswellengeschwindigkeit bestimmt.
Während der Hämodialysebehandlung kam es zu einem signifikanten Anstieg des RI [...] |
Ein Verweis auf die Quelle fehlt. Nicht nur wegen der Plagiatsproblematik wäre es angemessen gewesen, die Quelle zu erwähnen, da die Ergebnisse dieser verwandten Studie zu Vergleichszwecken hätten herangezogen werden können. |
|
| [2.] Aak/Fragment 002 13 - Diskussion Bearbeitet: 17. August 2014, 22:33 Schumann Erstellt: 14. August 2014, 20:13 (Hindemith) | Aak, Bender 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 2, Zeilen: 13-27 |
Quelle: Bender 2005 Seite(n): 15, Zeilen: 2ff |
|---|---|
| Viele Faktoren spielen eine große Rolle bei der Auswahl des Nierenersatzverfahrens, z.B. die medizinischen Aspekte, wie vorhandene Nierenrestfunktion, ausreichende Ultrafiltration und Giftelimination durch das gewählte Verfahren, die Möglichkeit eines Gefäßzuganges, kardiovaskuläre und hämodynamische Situation des Patienten, Erfahrungen der Dialyseeinrichtung mit dem jeweiligen Verfahren, sowie nichtmedizinische Aspekte, z.B. Flexibilität und persönlicher Wunsch des Patienten und / oder des medizinischen Betreuers, soziale Probleme und Kosten des Verfahrens für die Entscheidungsfindung werden herangezogen. Das letztendlich entscheidende medizinische Auswahlkriterium ist aber das zu erwartende Patientenüberleben. Vielen Studien haben die Prognose von Hämodialyse (HD) und Peritonealdialyse (PD) Patienten untersucht (Van Biesen et al., 2004), wobei die endgültige Antwort auf die Frage nach dem Verfahren, welches das längstmögliche Patientenüberleben ermöglicht, aufgrund einer Vielzahl von Problemen in der Studienmethodik und Patientenauswahl schwierig zu beantworten bleibt. | Die Auswahl des Nierenersatzverfahrens hängt von vielen Faktoren ab: Es werden dabei medizinische Aspekte, wie vorhandene Nierenrestfunktion, ausreichende Ultrafiltration und „Gift“-Elimination durch das gewählte Verfahren, Möglichkeit eines Gefäßzuganges, Erfahrungen der Dialyseeinrichtung mit dem jeweiligen Verfahren, kardiovaskuläre und hämodynamische Situation, sowie nichtmedizinische Aspekte, wie Flexibilität und persönlicher Wunsch des Patienten (und/oder des medizinischen Betreuers), soziale Probleme und Kosten des Verfahrens für die Entscheidungsfindung herangezogen. Das letztendlich entscheidende medizinische Auswahlkriterium ist aber das zu erwartende Patientenüberleben. Viele Studien haben die Prognose von HD- versus PD-Patienten untersucht (Zusammenfassung siehe Van Biesen et al. [5]), wobei die endgültige Antwort auf die Frage nach dem Verfahren, welches das längstmögliche Patientenüberleben ermöglicht, aufgrund einer Vielzahl von Problemen in der Studienmethodik und Patientenauswahl schwierig zu beantworten bleibt.
[5] Van Biesen, W.; Vanholder, R. C.; Veys, N; Dhondt, A und Lameire, N. (2000): An Evaluation of an Integrative Care Approach for End-Stage Renal Disease Patients, J Am Soc Nephrol 11, Seite 116-125. |
Ein Verweis auf die Quelle fehlt. Die Publikation "Van Biesen et al., 2004" findet sich nicht im Literaturverzeichnis der untersuchten Arbeit. |
|
| [3.] Aak/Fragment 038 17 - Diskussion Bearbeitet: 17. August 2014, 22:32 WiseWoman Erstellt: 15. August 2014, 07:00 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 38, Zeilen: 17-25 |
Quelle: Abraha 2005 Seite(n): 48, Zeilen: 18-25 |
|---|---|
| Fraglich ist auch, ob dabei die chronische Dialysetherapie per se einen ungünstigen Einfluss auf die zentrale Gefäßfunktion ausübt und es dadurch zur Schädigung kommt. Um dies weiter abzuklären, empfiehlt es sich, die Untersuchungen an selbigen Patienten über einen größeren Zeitraum zu wiederhohlen. Eine Verbesserung der zentralen Gefäßfunktion würde dann einen Langzeiteffekt der Hämodialysetherapie vermuten lassen, eine Verschlechterung die Vermutung bestärken, dass die Hämodialysetherapie und die Erythropoietin-Gabe per se einen schädigenden Einfluss auf die zentrale Gefäßfunktion vorzuweisen hat. | Fraglich ist auch ob dabei die chronische Dialysetherapie per se einen ungünstigen Einfluss auf die zentrale Gefäßfunktion ausübt und es dadurch zur Schädigung kommt. Um dies weiter abzuklären empfiehlt es sich die Untersuchungen an selbigen Patienten über einen größeren Zeitraum zu wiederhohlen. Eine Verbesserung der zentralen Gefäßfunktion würde dann einen Langzeiteffekt der Hämodialysetherapie vermuten lassen, eine Verschlechterung die Vermutung bestärken, dass die Hämodialysetherapie per se einen schädigenden Einfluss auf die zentrale Gefäßfunktion vorzuweisen hat. |
Ein Verweis auf die Quelle fehlt. |
|
| [4.] Aak/Fragment 038 32 - Diskussion Bearbeitet: 17. August 2014, 22:32 WiseWoman Erstellt: 15. August 2014, 06:56 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 38, Zeilen: 32-42 |
Quelle: Abraha 2005 Seite(n): 48-49, Zeilen: 48: 26ff; 49: 1-7 |
|---|---|
| In beiden Gruppen ergab sich eine Abhängigkeit dieses Anstieges mit Veränderungen von arteriellem Pulsdruck, systolischem Blutdruck sowie vom body mass index. Bezieht man die Veränderungen des Vascular Index unter Hämodialyse mit ein, lässt sich die verstärkte Pulsreflexion vor allem mit einer Zunahme des Tonus der kleinen peripheren Gefäße erklären. Die Arterielle Steifigkeit kleiner Gefäße (S2) zeigte sich signifikant verschieden zu der gemessenen am Start als auch am Ende der Dialyse bei allen Hämodialysepatienten unabhängig von der Dialysedauer und Erythropoietin- Gabe. Dies macht eine vorbestehende Funktionseinschränkung der kleinen peripheren Gefäße bei den Patienten aufgrund der chronischen Niereninsuffizienz unwahrscheinlich. | In beiden Gruppen ergab sich eine Abhängigkeit dieses Anstieges mit Veränderungen von arteriellem Pulsdruck, systolischem Blutdruck sowie vom Body mass index. Bezieht man die Veränderungen des
[Seite 49] Vascular Index unter Hämodialyse mit ein, lässt sich die verstärkte Pulsreflexion vor allem mit einer Zunahme des Tonus der kleinen peripheren Gefäße erklären. Die Arterial Stiffness kleiner Gefäße (S2) bei gesunden Kontrollpersonen zeigte sich nicht signifikant verschieden zu der gemessen am Start der Dialyse bei allen Patienten unabhängig von der Dialysedauer. Dies macht eine vorbestehende Funktionseinschränkung der kleinen peripheren Gefäße bei den Patienten aufgrund der chronischen Niereninsuffizienz unwahrscheinlich. |
Ein Verweis auf die Quelle fehlt. |
|
| [5.] Aak/Fragment 038 01 - Diskussion Bearbeitet: 17. August 2014, 22:28 WiseWoman Erstellt: 15. August 2014, 07:12 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 38, Zeilen: 1-6 |
Quelle: Abraha 2005 Seite(n): 48, Zeilen: 7-11 |
|---|---|
| Für alle untersuchten Dialysepatienten ergab sich keine signifikante Änderung der arteriellen Steifigkeiten großer Gefäße (S1). Eine Beeinflussung der Funktion der großen zentralen Gefäße unter Dialysetherapie, erscheint daher unwahrscheinlich. Die Veränderungen der arteriellen Steifigkeiten (S1) zeigten sich bei Hämodialysepatienten ohne Erythropoietin-Gabe abhängig von den Veränderungen des Pulsdruckes. | Für alle untersuchten Dialysepatienten ergab sich keine signifikante Änderung der Arterial Stiffness großer Gefäße (S1). Eine Beeinflussung der Funktion der großen zentralen Gefäße, unter Dialysetherapie erscheint daher unwahrscheinlich. Die Veränderungen der Arterial Stiffness (S1) zeigten sich bei Dialysepatienten abhängig von den Veränderungen des Pulsdruckes, systolischen Blutdruck und Body mass index. |
Ein Verweis auf die Quelle fehlt. |
|
| [6.] Aak/Fragment 037 01 - Diskussion Bearbeitet: 17. August 2014, 22:27 WiseWoman Erstellt: 15. August 2014, 07:20 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 37, Zeilen: 1ff (komplett) |
Quelle: Abraha 2005 Seite(n): 46, 47, 48, Zeilen: 46: 28ff; 47: 1ff; 48: 1-6 |
|---|---|
| Dabei unterschied sich der initiale Anstieg zu Beginn der reaktiven Hyperämie, repräsentiert durch den RImax Wert zum Start und Ende der Dialyse. Patienten mit Erythropoietin-Gabe zeigten am Ende der Dialyse eine Veränderung des Vascular Index während reaktiver Hyperämie von 55,9±2,3% auf 62,4±2,2%. Im Vergleich zu den Hämodialysepatienten ohne Erythropoietin-Gabe ergab sich allerdings eine geringere Abnahme des Vascular Index während der reaktiven Hyperämie. Der initiale Anstieg zu Beginn der reaktiven Hyperämie erwies sich zum Start der Dialyse im Vergleich mit Hämodialysepatienten ohne Erythropoietin- Gabe als gemindert (RImax= 56,5±2,5%) und wies zum Ende der Dialyse einen Unterschied (RImax=59,1±2,6%) auf. Die Ergebnisse lassen vermuten, dass es bei den Patienten zu einer Verbesserung der Endothelfunktion unter Hämodialyse gekommen ist, die allerdings gegenüber Gesunden immer noch vermindert bleibt. Dies ist insofern beeindruckend, da sich in der Literatur eine Vielzahl an Studien findet in denen sich keine Verbesserung der endothelialen Funktion unter Hämodialyse zeigte (Miyazaki et al., 2000; Tarng et al., 2000). So untersuchten Kosch et al. (2001) doppler-sonographisch die Veränderungen während reaktiver Hyperämie bei Hämodialysepatienten und fanden im Vergleich der end-diastolischen Durchmesser der Arteria brachialis vor und während reaktiver Hyperämie keinen signifikanten Unterschied. Anders als bei der doppler-sonographischen Bestimmung des end-diastolischen Durchmessers der Arteria brachialis ist die genaue Lokalisation der Vasodilatation mittels digitaler Photoplethysmographie nicht möglich.
5.2. Arterielle Steifigkeit Veränderungen, wie sie bei verschiedenen Erkrankungen einschließlich arterieller Hypertonie oder chronischer Niereninsuffizienz auftreten, sind durch entsprechende Veränderungen der arteriellen Steifigkeiten darstellbar. Die arterielle Steifigkeit konnte durch Pulswellenanalyse nicht-invasiv, einfach risikolos bestimmt werden. Dabei wurden der Index der Elastizität der großen Gefäße (C1) und der Index der Elastizität der kleinen Gefäße (C2) als Maß für die Gefäß-Compliance mit einem HDI/Pulswave research cardiovascular profiling instrument (model CR-2000) entsprechend den Empfehlungen des Herstellers (Hypertension Diagnostics) ermittelt. Die arterielle Steifigkeit der großen Gefäße (S1) und die arterielle Steifigkeit der kleinen Gefäße (S2) berechnete sich dann nach der Formel: S1 = 10/C1 und S2 = 100/C2. Ateriosklerotische Gefäßveränderungen und verminderte Gefäßelastizität sind typische Befunde bei Patienten mit chronischer Niereninsuffizienz. Die Gefäßelastizität hat einen direkten Einfluss auf den Pulsdruck (pulse Presssure), d.h. die Differenz von systolischem und diastolischem Blutdruck (Marchais et al., 1993). Entsprechend konnten Klassen et al. (2002) in einer retrospektiven Kohorten-Studie nach Auswertung der Daten von 37069 Patienten belegen, dass der Pulsdruck einen eigenständigen Risikofaktor für die Mortalität bei Patienten mit dialysepflichtiger Niereninsuffizienz darstellt. Die arterielle Steifigkeit stellt einen charakteristischen Marker für die Intaktheit der Gefäßwand in vivo dar. Strukturelle Veränderungen, wie sie bei verschiedenen Erkrankungen einschließlich arterieller Hypertonie oder chronischer Niereninsuffizienz auftreten, sind durch entsprechende Veränderungen der arteriellen Steifigkeiten darstellbar. |
Dabei unterschied sich der initiale Anstieg zu Beginn der reaktiven Hyperämie, repräsentiert durch den Rmax Wert zum Start und Ende der Dialyse, nicht wesentlich von dem gesunder Kontrollen (n=28). Patienten mit einer Dialysedauer von > 3 Monaten zeigten am Ende der Dialyse einen signifikanten Abfall des Vascular Index während reaktiver Hyperämie von 35,7±0,9% auf 33,8±0,9%. Im Vergleich zu den gesunden Kontrollen ergab sich allerdings eine geringere Abnahme des Vascular Index
[Seite 47] während der reaktiven Hyperämie. Der initiale Anstieg zu Beginn der reaktiven Hyperämie erwies sich zum Start der Dialyse im Vergleich mit gesunden Kontrollen als gemindert (RImax = 54,7±2%) und wies zum Ende der Dialyse keinen Unterschied mehr zu den Werten gesunder Kontrollen auf. Die Ergebnisse lassen vermuten, dass es bei den Patienten zu einer Verbesserung der Endothelfunktion unter Hämodialyse gekommen ist, die allerdings gegenüber Gesunden immer noch vermindert bleibt. Dies ist insofern beeindruckend, da sich in der Literatur eine Vielzahl an Studien findet in denen sich keine Verbesserung der endothelialen Funktion unter Hämodialyse zeigte (Miyazaki et al., 2000; Tarng et al., 2000). So untersuchten Kosch et al. (2001) doppler-sonographisch die Veränderungen während reaktiver Hyperämie bei Hämodialysepatienten und fanden im Vergleich der end-diastolischen Durchmesser der Arteria brachialis vor und während reaktiver Hyperämie keinen signifikanten Unterschied. Anders als bei der doppler-sonographischen Bestimmung des end-diastolischen Durchmessers der Arteria brachialis ist eine genaue Lokalisation der Vasodilatation mittels digitaler Photoplethysmographie nicht möglich. 4.2 Arterial Stiffness Veränderungen, wie sie bei verschiedenen Erkrankungen einschließlich arterieller Hypertonie oder chronischer Niereninsuffizienz auftreten, sind durch entsprechende Veränderungen der Arterial Stiffness darstellbar. Die Arterial Stiffness konnten durch Pulswellenanalyse nicht-invasiv, einfach, risikolos und reproduzierbar bestimmt werden. Dabei wurden der Index der Elastizität der großen Gefäße (C1) und der Index der Elastizität der kleinen Gefäße (C2) als Maß für die Gefäß-Compliance mit einem HDI/Pulswave research cardiovascular profiling instrument (model CR-2000) entsprechend den Empfehlungen des Herstellers (Hypertension Diagnostics) ermittelt. Die Arterial Stiffness der großen Gefäße (S1) und die Arterial Stiffness der kleinen Gefäße (S2) berechnete sich dann nach der Formel: S1 = 10/C1 und S2 = 100/C2. Arteriosklerotische Gefäßveränderungen und verminderte Gefäßelastizität sind typische Befunde bei Patienten mit chronischer Niereninsuffizienz. Die Gefäßelastizität hat einen direkten Einfluss auf den Pulsdruck (pulse pressure), d.h. die Differenz von systolischem und diastolischem Blutdruck (Marchais et al., 1993). Entsprechend konnten Klassen et al. (2002) in einer retrospektiven Kohorten-Studie nach Auswertung der Daten von 37069 [Seite 48] Patienten belegen, dass der Pulsdruck einen eigenständigen Risikofaktor für die Mortalität bei Patienten mit dialysepflichtiger Niereninsuffizienz darstellt. Die Arterial Stiffness stellt einen charakteristischen Marker für die Intaktheit der Gefäßwand in vivo dar. Strukturelle Veränderungen, wie sie bei verschiedenen Erkrankungen einschließlich arterieller Hypertonie oder chronischer Niereninsuffizienz auftreten, sind durch entsprechende Veränderungen der Arterial Stiffness darstellbar. |
Ein Verweis auf die Quelle fehlt. |
|
| [7.] Aak/Fragment 025 02 - Diskussion Bearbeitet: 17. August 2014, 22:24 Schumann Erstellt: 15. August 2014, 10:18 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 25, Zeilen: 2-10 |
Quelle: Abraha 2005 Seite(n): 28, Zeilen: 1-3, 8ff |
|---|---|
| 4.2.1. Der Vascular Index (RI) während der Hämodialyse
Mittels nicht-invasiver photoplethysmographischer Messungen wurde ein kontinuierliches Monitoring der Pulswelle bei den Patienten während der Hämodialyse durchgeführt. Die Pulswellen wurden durch den Vascular Index charakterisiert: Der Vascular Index dient zur Charakterisierung des diastolischen Anteils der Pulswelle. Die Indices wurden immer als Mittelwert aus allen Pulswellen, die innerhalb einer Episode von 150 Sekunden aufgezeichnet wurden, angegeben. Eine Ausnahme bilden Vascular Indices RImax und RI15sec, die Mittelwerte aller Pulswellen innerhalb einer Messperiode von 15 Sekunden darstellen. |
3.2.2 Der Vascular Index (RI) während der Hämodialyse
Mittels nicht-invasiver photoplethysmographischer Messungen wurde ein kontinuierliches Monitoring der Pulswelle bei den Patienten während der Hämodialyse durchgeführt. [....] Die Pulswellen wurden durch den Vascular Index charakterisiert: Der Vascular Index dient zur Charakterisierung des diastolischen Anteils der Pulswelle. Die Indices wurden immer als Mittelwert aus allen Pulswellen, die innerhalb einer Episode von 150 Sekunden aufgezeichnet wurden, angegeben. Eine Ausnahme bilden Vascular Indices RImax und RI15sec, die Mittelwerte aller Pulswellen innerhalb einer Messperiode von 15 Sekunden darstellen. |
Ein Verweis auf die Quelle fehlt. |
|
| [8.] Aak/Fragment 014 01 - Diskussion Bearbeitet: 17. August 2014, 22:22 Schumann Erstellt: 15. August 2014, 11:00 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 14, Zeilen: 1-27 |
Quelle: Abraha 2005 Seite(n): 16, 17, 19, Zeilen: 16: 22ff; 17: 1-7; 19: 1-6 |
|---|---|
| Diese Werte werden aus den Mittelwerten der Pulswellen während einer Messperiode von 30 Sekunden berechnet.
Das Schlagvolumen (SV) wird aufgrund von Alter (in Jahren), Herzfrequenz (HR, pro Minute), Körperoberfläche (KÖF in m2) und Herzauswurfzeit (cardiac ejection time, CET in ms, bestimmt aus der Radialispulswelle) nach folgender Formel berechnet: SV=-6,6+0,25x(CET – 3,5)-0,62x(HR)+40,4x(KÖF)-0,51x(Alter). Die Körperoberfläche (KÖF in m2) berechnet sich nach der Formel: 0,007184 x Körpergröße0,725 x Körpergewicht0,425. Der Schlagvolumen-Index berechnet sich aus Schlagvolumen (SV) dividiert durch die Körperoberfläche (KÖF). Das Herzschlagvolumen berechnet sich nach der Formel: (CO)=(SV)x(HR). Die arterielle Steifigkeit der großen Gefäße (S1) und die arterielle Steifigkeit der kleinen Gefäße (S2) berechnen sich nach der Formel: S1 = 10/C1 und S2 = 100/C2. Der totale periphere Widerstand (systemic vascular resistence, SVR) errechnet sich aus dem mittleren arteriellen Blutdruck geteilt durch (CO). Der Index der Elastizität der großen Gefäße (C1), Index der Elastizität der kleinen Gefäße (C2) und induktiver Widerstand (inductance, L) wird durch nichtlineare Kurvenanpassung aus dem Kurvenverlauf des diastolischen Flusses errechnet. 3.5. Statistik Die statistische Auswertung erfolgt mittels Graphpad Prism 3.0 (Graphpad Software, San Diego, CA) oder SPSS für Windows (Version 11.5:, SPSS, Chicago, IL). Kontinuierliche Daten sind als Mittelwert±SEM aufgeführt. Das Verhältnis zwischen den Hämodynamikparametern Vascular Index, arterielle Steifigkeiten ( S1, S2), wurde unter Verwendung der Spearman Korrelation bewertet. |
Diese Werte werden aus den Mittelwerten der Pulswellen während einer Messperiode von 30 Sekunden berechnet.
Das Schlagvolumen (SV) wird aufgrund von Alter (in Jahren), Herzfrequenz (HR, pro Minute), Körperoberfläche (KÖF in m2) und Herzauswurfzeit (cardiac ejection time, CET in ms, bestimmt aus der Radialispulswelle) nach folgender Formel berechnet: SV=-6,6+0,25x(CET – 3,5)-0,62x(HR)+40,4x(KÖF)-0,51x(Alter). Die Körperoberfläche (KÖF in m2) berechnet sich nach der Formel: 0,007184 x Körpergröße0,725 x Körpergewicht0,425. Der Schlagvolumen-Index berechnet sich aus Schlagvolumen (SV) dividiert durch die Körperoberfläche (KÖF). Das Herzschlagvolumen berechnet sich nach der Formel: (CO)=(SV)x(HR). [Seite 17] Die Arterial Stiffness der großen Gefäße (S1) und die Arterial Stiffness der kleinen Gefäße (S2) berechnen sich nach der Formel: S1 = 10/C1 und S2 = 100/C2. Der totale periphere Widerstand (systemic vascular resistence, SVR) errechnet sich aus dem mittleren arteriellen Blutdruck geteilt durch (CO). Der Index der Elastizität der großen Gefäße (C1), Index der Elastizität der kleinen Gefäße (C2) und induktiver Widerstand (inductance, L) werden durch nichtlineare Kurvenanpassung aus dem Kurvenverlauf des diastolischen Flusses errechnet. [Seite 19] 2.6 Statistik Die statistische Auswertung erfolgte mittels GraphPad Prism 3.0 (GraphPad Software, San Diego, CA) oder SPSS für Windows (version 11.5; SPSS, Chicago, IL). Kontinuierliche Daten sind als Mittelwert±SEM aufgeführt. Das Verhältnis zwischen den Hämodynamikparametern Vascular Index, Arterial Stiffness (S1, S2), Augmentation Index (AIx) wurde unter Verwendung der Spearman oder Pearson Korrelation bewertet. |
Ein Verweis auf die Quelle fehlt. |
|
| [9.] Aak/Fragment 036 01 - Diskussion Bearbeitet: 17. August 2014, 22:20 WiseWoman Erstellt: 15. August 2014, 07:27 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 36, Zeilen: 1ff (komplett) |
Quelle: Abraha 2005 Seite(n): 45, 46, Zeilen: 45: 1-11. 25ff; 46: 1-29 |
|---|---|
| 5. Diskussion
5.1.Vascular Index Die digitale Photoplethysmographie als Methode der kontinuierlichen Analyse der Pulswelle während einer Hämodialysebehandlung stellt einen wesentlichen Fortschritt beim Monitoring der Hämodynamik bei Patienten mit dialysepflichtiger Niereninsuffizienz dar. Mit dem neu entwickelten Auswerte-Algorithmus war es erstmalig möglich, den diastolischen Anteil der Volumenpulswelle mit dem neu definierten Vascular Index genau zu erfassen. Wie in der Literatur beschrieben, entsteht der diastolische Anteil der digitalen Volumenpulswelle vorwiegend durch die Reflexion der Pulswelle in der Peripherie, wahrscheinlich vorwiegend an kleinen Arterien insbesondere der unteren Körperabschnitte (Millasseau et al., 2003). Es ist bekannt, dass es unter der Hämodialysebehandlung zu Veränderungen der Hämodynamik kommt. Während einer routinemäßigen Hämodialyse kann es gelegentlich zu Blutdruckanstiegen, aber häufiger zu Blutdruckabfällen kommen. Als Ursache für diese Veränderungen werden die Volumenveränderungen, die Eliminierung von osmotisch wirksamen Substanzen und die Elektrolyt- und Ph-Verschiebungen angesehen (Donauer, 2004; Noris et al., 1998). Cavalcanti et al. (2004) postulierten, dass das Auftreten von Blutdruckabfällen durch eine Veränderung der Adaptation der peripheren Widerstandsgefäße unter dem Volumenentzug während der Dialyse bedingt sein könnte. Die Untersuchung zeigte jetzt, dass es tatsächlich im Verlauf der Hämodialyse sowohl bei Patienten ohne Erythropoietin-Gabe als auch bei Erythropoietin-Gabe zu einer Vasokonstriktion mit Erhöhung der Pulsreflexion in der Peripherie kam. Im Mittel kam es zu einem signifikanten Anstieg des Vascular Index von 37,7±1,7% (ohne Erythropoietin-Gabe) und 35,5±1,6% (mit Erythropoietin-Gabe) am Start der Dialyse auf 40,3±2,0% (ohne Erythropoietin-Gabe) und 38,1±1,7% (Mit Erythropoietin-Gabe) am Ende der Dialyse. Klinisch bedeutsame Blutdruckabfälle traten während der Untersuchungen nicht auf. Durch das neue Verfahren zur Überwachung der Pulswelle während der Hämodialyse mittels nicht-invasiver digitaler Photoplethysmographie können hämodynamische Veränderungen bei den Patienten während einer Hämodialyse ohne Beeinträchtigung des Patienten oder der Dialysebehandlung genau dokumentiert werden, so dass individuelle Veränderungen der Hämodynamik bei jedem Patienten erkannt werden können. Der Schädigung der Endothelfunktion durch Hypertonie, Dyslipidämie, Homocystein, glykosilierte Plasmaproteine, oxidativen Stress und Mikroinflammation, bei Patienten mit chronischer Niereninsuffizienz wird eine entscheidende Triggerfunktion in der Entwicklung kardiovaskulärer Erkrankungen zugeschrieben. Die Endothelfunktion wurde durch 5 minütige Kompression am ipsilateralen Oberarm mit einer Blutdruckmanschette über den systolischen Blutdruckwert und anschließende Lösung der Kompression untersucht. Dabei kommt es bei Gesunden zu einer endothelvermittelten Vasodilatation ausgelöst durch Scherkräfte am Endothel (Cooke et al., 1991; Joannides et al., 1995; Miura et al., 2001; Olesen et al., 1988; Pohl et al., 1985). Diese Phase ist charakterisiert durch einen initialen Anstieg des Vascular Index und einen anschließenden Abfall auf Werte unter die Ausgangwerte vor der Kompression. Patienten ohne Erythropoietin-Gabe zeigten weder zum Start noch zum Ende der Dialyse Zeichen einer Vasodilatation nach [Kompression.] |
4 Diskussion
4.1 Vascular Index Die digitale Photoplethysmographie als Methode der kontinuierlichen Analyse der Pulswelle während einer Hämodialysebehandlung stellt einen wesentlichen Fortschritt beim Monitoring der Hämodynamik bei Patienten mit dialysepflichtiger Niereninsuffizienz dar. Mit dem neu entwickelten Auswerte-Algorithmus war es erstmalig möglich, den diastolischen Anteil der Volumenpulswelle mit dem neu definierten Vascular Index genau zu erfassen. Wie in der Literatur beschrieben, entsteht der diastolische Anteil der digitalen Volumenpulswelle vorwiegend durch die Reflexion der Pulswelle in der Peripherie, wahrscheinlich vorwiegend an kleinen Arterien insbesondere der unteren Körperabschnitte (Millasseau et al., 2003). [...] [...] Es ist bekannt, dass es unter der Hämodialysebehandlung zu Veränderungen der Hämodynamik kommt. Während einer routinemäßigen Hämodialyse kann es gelegentlich zu Blutdruckanstiegen, aber häufiger zu Blutdruckabfällen kommen. Als Ursache für diese Veränderungen werden die Volumenveränderungen, die Eliminierung von osmotisch wirksamen Substanzen und die Elektrolyt- und pH-Verschiebungen angesehen (Donauer, [Seite 46] 2004; Noris et al., 1998). Cavalcanti et al. (2004) postulierten, dass das Auftreten von Blutdruckabfällen durch eine Veränderung der Adaptation der peripheren Widerstandsgefäße unter dem Volumenentzug während der Dialyse bedingt sein könnte. Die Untersuchung zeigte jetzt, dass es tatsächlich im Verlauf der Hämodialyse sowohl bei Patienten mit einer Dialysedauer > 3 Monaten als auch bei Patienten mit einer Dialysedauer < 3 Monaten zu einer Vasokonstriktion mit Erhöhung der Pulsreflexion in der Peripherie kam. Im Mittel kam zu einem signifikanten Anstieg des Vascular Index von 32,4±0,3% (Erstdialyse) und 32,9±0,2% (Dauerdialyse) am Start der Dialyse auf 35,7±0,5% (Erstdialyse) und 35,6±0,3% (Dauerdialyse) am Ende der Dialyse. Klinisch bedeutsame Blutdruckabfälle traten während der Untersuchungen nicht auf. Durch das neue Verfahren zur Überwachung der Pulswelle während der Hämodialyse mittels nichtinvasiver digitaler Photoplethysmographie können hämodynamische Veränderungen bei den Patienten während einer Hämodialyse ohne Beeinträchtigung des Patienten oder der Dialysebehandlung genau dokumentiert werden, so dass individuelle Veränderungen der Hämodynamik bei jedem Patienten erkannt werden können. Der Schädigung der Endothelfunktion durch Hypertonie, Dyslipidämie, Homocystein glykosilierte Plasmaproteine, oxidativen Stress und Mikroinflammation, bei Patienten mit chronischer Niereninsuffizienz wird eine entscheidende Triggerfunktion in der Entwicklung kardiovaskulärer Erkrankungen zugeschrieben. Die Endothelfunktion wurde durch 5 minütige Kompression am ipsilateralen Oberarm mit einer Blutdruckmanschette über den systolischen Blutdruckwert und anschließende Lösung der Kompression untersucht. Dabei kommt es bei Gesunden zu einer endothelvermittelten Vasodilatation ausgelöst durch Scherkräfte am Endothel (Cooke et al., 1991; Joannides et al., 1995; Miura et al., 2001; Olesen et al., 1988; Pohl et al., 1985). Diese Phase ist charakterisiert durch einen initialen Anstieg des Vascular Index und einen anschließenden Abfall auf Werte unter die Ausgangwerte vor Kompression. Patienten mit einer Dialysedauer < 3 Monaten Dauer zeigten weder zum Start noch zum Ende der Dialyse Zeichen einer Vasodilatation nach Kompression. |
Ein Verweis auf die Quelle fehlt. |
|
| [10.] Aak/Fragment 013 01 - Diskussion Bearbeitet: 17. August 2014, 22:19 Schumann Erstellt: 15. August 2014, 11:22 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 13, Zeilen: 1-23 |
Quelle: Abraha 2005 Seite(n): 16, Zeilen: 1-21 |
|---|---|
| 3.4. HDI/Pulsewave Research Cardiovascular Profiling Instrument
Die Messung der Gefäß-Compliance erfolgt mit einem HDI/Pulswave research cardiovascular profiling instrument (model CR-2000) entsprechend den Empfehlungen des Herstellers (Hypertension Diagnostics). Die Pulswellenmessungen erfolgen mittels eines Applanationstonometers, das von außen auf die Arteria radialis aufgesetzt wird. Das Applanationstonometer besteht aus einem Edelstahlzylinder von 1,27 cm Durchmesser der unten durch ein 0,15 mm dickes Edelstahlplättchen verschlossen ist. Über eine Verbindung mit einem piezoelektrischen Element erfolgt eine Verstärkung des Pulswellensignals. Eine Haltevorrichtung, die am Handgelenk des Patienten befestigt wird, ermöglicht die Justierung des Tonometers und gewährleistet die Stabilität während der Pulswellenanalyse. Durch einen angewinkelten „wrist stabilizer“ wird der Unterarm während der Messung zusätzlich stabilisiert. Bei Patienten mit AV-Shunt am Unterarm erfolgt die Messung am kontralateralen Arm. Die Pulswellen werden durch die unmittelbar vorausgehende oszillometrische Blutdruckmessung am Oberarm geeicht. Die Form der arteriellen Pulswelle wird durch antegrade und retrograde (reflektierte) Druckwellen bestimmt, die durch entsprechende Algorithmen bestimmt werden können. Durch einen Algorithmus unter Berücksichtigung eines 4-Element-Windkessel- Modells können aus der gemessenen Radialis-Pulswelle der totale periphere Widerstand (systemic vascular resistence, SVR), der Index der Elastizität der großen Gefäße (C1 in ml/mmhgx10) und der Index der Elastizität der kleinen Gefäße (C2 in ml/mmhgx100) bestimmt werden (Arnett et al., 2001, Finkelstein&Cohn, 1992, Mcveigh et al. 1999, Rietzschel et al. 2001). |
2.4 HDI/Pulsewave Research CardioVascular Profiling Instrument
Die Messung der Gefäß-Compliance erfolgt mit einem HDI/Pulswave research cardiovascular profiling instrument (model CR-2000) entsprechend den Empfehlungen des Herstellers (Hypertension Diagnostics). Die Pulswellenmessungen erfolgen mittels eines Applanationstonometers, das von außen auf die Arteria radialis aufgesetzt wird. Das Applanationstonometer besteht aus einem Edelstahlzylinder von 1,27 cm Durchmesser der unten durch ein 0,15 mm dickes Edelstahlplättchen verschlossen ist. Über eine Verbindung mit einem piezoelektrischen Element erfolgt eine Verstärkung des Pulswellensignals. Eine Haltevorrichtung, die am Handgelenk des Patienten befestigt wird ermöglicht die Justierung des Tonometers und gewährleistet die Stabilität während der Pulswellenanalyse. Durch einen angewinkelten „wrist stabilizer“ wird der Unterarm während der Messung zusätzlich stabilisiert. Bei Patienten mit AV-Shunt am Unterarm erfolgt die Messung am kontralateralen Arm. Die Pulswellen werden durch die unmittelbar vorausgehende oszillometrische Blutdruckmessung am Oberarm geeicht. Die Form der arteriellen Pulswelle wird durch antegrade und retrograde (reflektierte) Druckwellen bestimmt, die durch entsprechende Algorithmen bestimmt werden können. Durch einen Algorithmus unter Berücksichtigung eines 4-Element-Windkessel-Modells können aus der gemessenen Radialis-Pulswelle der totale periphere Widerstand (systemic vascular resistence, SVR), der Index der Elastizität der großen Gefäße (C1 in ml/mmHgx10) und der Index der Elastizität der kleinen Gefäße (C2 in ml/mmHgx100) bestimmt werden (Arnett et al., 2001; Finkelstein&Cohn, 1992; McVeigh et al., 1999; Rietzschel et al., 2001). |
Ein Verweis auf die Quelle fehlt. |
|
| [11.] Aak/Fragment 012 01 - Diskussion Bearbeitet: 17. August 2014, 22:18 Schumann Erstellt: 15. August 2014, 11:25 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 12, Zeilen: 1ff (komplett) |
Quelle: Abraha 2005 Seite(n): 14, 15, Zeilen: 14: letzte Zeilen; 15: 1-11 |
|---|---|
| Beim Gesunden fällt der RI Wert nach initialen Anstieg unter den Wert des Vascular Index (RI), gemessen in der Episode vor Stau, ab. Die Differenz zwischen dem Vascular Index (RI) nach Stau und dem Vascular Index (RI) vor Stau gilt als Maß für die Dilatation.
Als Vascular Index gilt das Mittel aller in der Episode (150 Sekunden) vor bzw. nach Stau gemessenen Pulswellen. Die Vascular Indices der ersten Episode (150 Sekunden) nach Stau werden zusätzlich als Mittel aller in einer Messperiode von 15 Sekunden ermittelten Pulswellen angegeben und im Weiteren als RI15sec bezeichnet. Der prozentual am höchsten liegenden RI15sec Wert, gemessen in der Episode nach Stau, wird dabei gesondert als RImax Wert betrachtet und beschreibt in seiner Ausprägung den maximalen Wert während der reaktiven Hyperämie. Die Abbildung 6 zeigt exemplarisch den Verlauf des Vascular Index (RI) für jeden einzelnen Pulsschlag über den Zeitraum einer Episode (150 Sekunden) bei einem Dialysepatienten während der Phase der reaktiven Hyperämie. |
Beim Gesunden fällt der RI15sec Wert nach initialen Anstieg unter den Wert des Vascular Index (RI) gemessen in der Episode vor Stau, ab. Die Differenz
[Seite 15] zwischen dem Vascular Index (RI) nach Stau und dem Vascular Index (RI) vor Stau gilt als Maß für die Dilatation. Als Vascular Index gilt das Mittel aller in der Episode (150 Sekunden) vor bzw. nach Stau gemessenen Pulswellen. Die Vascular Indices der ersten Episode (150 Sekunden) nach Stau werden zusätzlich als Mittel aller in einer Messperiode von 15 Sekunden ermittelten Pulswellen angegeben und im Weiteren als RI15sec bezeichnet. Der prozentual am höchsten liegende RI15sec Wert, gemessen in der Episode nach Stau, wird dabei gesondert als RImax Wert betrachtet und beschreibt in seiner Ausprägung den initialen Anstieg nach Stau. Die untere Abbildung 5 zeigt exemplarisch den Abfall des Vascular Index (RI) für jeden einzelnen Pulsschlag über den Zeitraum einer Episode (150 Sekunden) bei einem Dialysepatienten, gemessen am Start (offene Kreise) und Ende (geschlossene Kreise) der Dialyse. |
Ein Verweis auf die Quelle fehlt. |
|
| [12.] Aak/Fragment 011 01 - Diskussion Bearbeitet: 17. August 2014, 22:16 Schumann Erstellt: 15. August 2014, 11:46 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 11, Zeilen: 1ff (komplett) |
Quelle: Abraha 2005 Seite(n): 12, 13, 14, Zeilen: 12: letzte Zeilen; 13: 1ff; 14: 1-20 |
|---|---|
| Die Photoplethysmographiedaten wurden mit 32 pro Sekunde gewonnen, aufgezeichnet, auf einen PC übertragen und die Rohdaten wurden mit einem speziellen, neuentwickelten Auswerteprogramm analysiert. Die Messdaten wurden in Episoden von 150 Sekunden zusammengefasst. Zur Berechnung des Vascular Index und zur Charakterisierung des diastolischen Anteils der Pulskurve wurde für jede Pulswelle die erste Ableitung berechnet (graphpad Prism 3.0, graphpad Software, San Diego, CA) und das lokale Minimum dieser Funktion wurde automatisch berechnet. Das lokale Minimum der ersten Ableitung entspricht dem Wendepunkt der Pulswelle. Die Mittelwerte der Daten des dritten bis siebten Punktes, die dem Wendepunkt der Pulswelle folgen, wurden analysiert. Der Mittelwert in Prozent der maximalen Amplitude der Pulswelle wurde dann als Vascular Index bezeichnet. Die Abbildung 5 zeigt eine beispielhafte Auswertung der Pulswelle. Die oben genannten Punkte liegen in einem Intervall zwischen 93 Millisekunden bis 218 Millisekunden nach dem Wendepunkt der Pulswelle und beschreiben sehr exakt die charakteristische "Schulterregion" im diastolischen Verlauf der Pulswelle, welche
überwiegend durch die Reflexion der Pulswelle in der Peripherie bedingt ist. Durch den neuen Auswerte-Algorithmus kann der Vascular Index als Charakteristikum des diastolischen Anteils der Pulswelle kontinuierlich während der Hämodialyse gemessen werden. Der Vascular Index wurde dabei immer als Mittelwert aus allen Pulswellen, die innerhalb einer Episode von 150 Sekunden aufgezeichnet wurden, also typischerweise mehr als 150 Pulswellen, angegeben. Eine Ausnahme bilden die Vascular Indices die in der unmittelbar nach Stau folgenden Episode zum Anschluss und Ende der Dialyse gemessen wurden und im weiteren Text als RImax und RI15sec Werte bezeichnet wird. Sie bezeichnen den Mittelwert aus allen Pulswellen, die innerhalb von 15 Sekunden aufgezeichnet wurden. - Abbildung 5. Analyse des diastolischen Anteils der Pulswelle, die mittels digitaler Photoplethysmographie gewonnen wurde. Die Pulswelle (Flow, obere Abbildung) wurde durch digitale Photoplethysmographie mit einem Pulsoximeter gemessen mit einem Sensor, der auf die Fingerkuppe aufgeklebt wurde. Die Plethysmographiedaten wurden mit 32 pro Sekunde gewonnen. Für jede Pulswelle wurde die erste Ableitung berechnet (f', untere Abbildung) und das lokale Minimum dieser Funktion wurde automatisch analysiert. Das lokale Minimum der ersten Ableitung entspricht dem Wendepunkt der Pulswelle. Die Mittelwerte der Daten des dritten bis siebten Punktes, die dem Wendepunkt der Pulswelle folgen, wurden bestimmt und als Vascular Index bezeichnet. In diesem Beispiel ist der Vascular Index= 53. Eine kurzfristige Verminderung des arteriellen Einstroms für 5 Minuten wird durch eine Blutdruckmanschette erreicht, die über dem systolischen Blutdruck aufgepumpt wird. Nach Lösen des Staus kommt es während der reaktiven Hyperämie zu einer „flow mediated dilation“ (Corretti et al., 2002). Man geht heute davon aus, dass EDRF (Endothelium derived relaxing factor) ein wichtiger Mediator zur Vermittlung dieser Reaktion ist. Dabei reagieren Calcium aktivierte Kaliumkanäle des Endothels auf Scherkräfte (Cooke et al., 1991; Miura et al., 2001; Olesen et al., 1988), und in Folge vermehrten Kaliumausstromes kommt es zur Hyperpolarisation der Zellen und zum Einstrom von Calcium. Calcium ist ein Aktivator der endothelialen NO Synthase und führt so zur NO vermittelten Dilatation, der „flow mediated dilation“ (Joannides et al. , 1995; Pohl et al., 1985). Während der reaktiven Hyperämie kommt es zu einem Abfall des RI Wertes. |
Die Photoplethysmographiedaten wurden mit 32 pro Sekunde gewonnen, aufgezeichnet, auf einen PC übertragen und die Rohdaten wurden mit einem speziellen, neuentwickelten
[Seite 13] Auswerteprogramm analysiert. Die Messdaten wurden in Episoden von 150 Sekunden zusammengefasst. Zur Berechnung des Vascular Index zur Charakterisierung des diastolischen Anteils der Pulskurve wurde für jede Pulswelle die erste Ableitung berechnet (GraphPad Prism 3.0, GraphPad Software, San Diego, CA) und das lokale Minimum dieser Funktion wurde automatisch berechnet. Das lokale Minimum der ersten Ableitung entspricht dem Wendepunkt der Pulswelle. Die Mittelwerte der Daten des dritten bis siebten Punktes, die dem Wendepunkt der Pulswelle folgen, wurden analysiert. Der Mittelwert in Prozent der maximalen Amplitude der Pulswelle wurde dann als Vascular Index bezeichnet. Die Abbildung 4 zeigt eine beispielhafte Auswertung der Pulswelle. Die oben genannten Punkte liegen in einem Intervall zwischen 93 Millisekunden bis 218 Millisekunden nach dem Wendepunkt der Pulswelle und beschreiben sehr exakt die charakteristische "Schulterregion" im diastolischen Verlauf der Pulswelle, welche überwiegend durch die Reflexion der Pulswelle in der Peripherie bedingt ist. Durch den neuen Auswerte-Algorithmus kann der Vascular Index als Charakteristikum des diastolischen Anteils der Pulswelle kontinuierlich während der Hämodialyse gemessen werden. Der Vascular Index wurde dabei immer als Mittelwert aus allen Pulswellen, die innerhalb einer Episode von 150 Sekunden aufgezeichnet wurden, also typischerweise mehr als 150 Pulswellen, angegeben. Eine Ausnahme bilden die Vascular Indices die in der unmittelbar nach Stau folgenden Episode zum Start und Ende der Dialyse gemessen wurden und im weiteren Text als RImax und RI15sec Werte bezeichnet werden. Sie bezeichnen den Mittelwert aus allen Pulswellen, die innerhalb von 15 Sekunden aufgezeichnet wurden. [Seite 14] Abbildung 4. Analyse des diastolischen Anteils der Pulswelle, die mittels digitaler Photoplethysmographie gewonnen wurde. Die Pulswelle (Flow, obere Abbildung) wurde durch digitale Photoplethysmographie mit einem Pulsoximeter gemessen mit einem Sensor, der auf die Fingerkuppe aufgeklebt wurde. Die Plethysmographiedaten wurden mit 32 pro Sekunde gewonnen. Für jede Pulswelle wurde die erste Ableitung berechnet (f', untere Abbildung) und das lokale Minimum dieser Funktion wurde automatisch analysiert. Das lokale Minimum der ersten Ableitung entspricht dem Wendepunkt der Pulswelle. Die Mittelwerte der Daten des dritten bis siebten Punktes, die dem Wendepunkt der Pulswelle folgen, wurden bestimmt und als Vascular Index bezeichnet. In diesem Beispiel ist der Vascular Index= 53. Durch 5 minütige(n) Kompression/Stau am ipsilateralen Oberarm mit einer Blutdruckmanschette über dem systolischen Blutdruckwert kommt es im Anschluss zur sogenannten „flow mediated dilation“ (Corretti et al., 2002). Man geht heute davon aus, dass EDRF (endothelium derived relaxing factor) ein wichtiger Mediator zur Vermittlung dieser Reaktion ist. Dabei reagieren Calcium aktivierte Kaliumkanäle des Endothels auf Scherkräfte (Cooke et al., 1991; Miura et al., 2001; Olesen et al., 1988), und in Folge vermehrten Kaliumausstromes kommt es zur Hyperpolarisation der Zellen und zum Einstrom von Calcium. Calcium ist ein Aktivator der endothelialen NO Synthase und führt so zur NO vermittelten Dilatation, der „flow mediated dilation“ (Joannides et al., 1995; Pohl et al., 1985). |
Ein Verweis auf die Quelle fehlt. Die Abbildung 5 fehlt in der Dissertation, man findet nur einen Bindestrich: "-". |
|
| [13.] Aak/Fragment 010 01 - Diskussion Bearbeitet: 17. August 2014, 22:13 Schumann Erstellt: 15. August 2014, 13:52 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 10, Zeilen: 1ff (komplett) |
Quelle: Abraha 2005 Seite(n): 11, 12, Zeilen: 11: 5ff; 12: 1-4 |
|---|---|
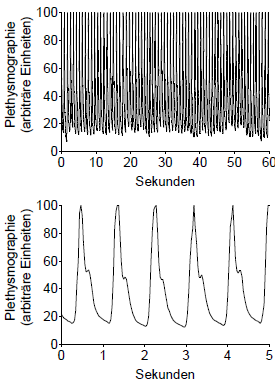
| Mit der digitalen Photoplethysmographie wird der digitalen [sic] Volumenpuls gemessen. Mittels digitaler Photoplethysmographie mit einem Pulsoximeter kann die Pulswelle bei jedem Herzschlag kontinuierlich aufgezeichnet werden, ohne dass der Patient oder die Behandlung beeinträchtigt werden (Abbildung 4.). Wie in der Literatur beschrieben (Millasseau et al. , 2003) besteht die digitale Volumenpulswelle aus zwei Anteilen. Der initiale, systolische Anteil der digitalen Volumenpulswelle wird durch die voranschreitende Pulswelle bestimmt. Der spätere, diastolische Anteil der digitalen Volumenpulswelle kommt durch die Reflexion der Pulswelle in der Peripherie, wahrscheinlich vorwiegend an kleinen Arterien insbesondere der unteren Körperabschnitte, zustande.
Abbildung 3. Digitale Photoplethysmographie zur Analyse der Pulswelle. Abbildung 4. Typisches Beispiel für kontinuierliches Monitoring der Pulswelle durch digitale Photoplethysmographie. Dargestellt sind die Pulswellen, die über einen Zeitraum von 60 Sekunden (obere Abbildung) bzw. 5 Sekunden (untere Abbildung) aufgezeichnet wurden. |
Mit der digitalen Photoplethysmographie wird der digitale Volumenpuls gemessen. Mittels digitaler Photoplethysmographie mit einem Pulsoximeter kann die Pulswelle bei jedem Herzschlag kontinuierlich aufgezeichnet werden, ohne dass der Patient oder die Behandlung beeinträchtigt werden (Abbildung 2). Wie in der Literatur beschrieben (Millasseau et al., 2003) besteht die digitale Volumenpulswelle aus zwei Anteilen (Abbildung 3). Der initiale, systolische Anteil der digitalen Volumenpulswelle wird durch die voranschreitende Pulswelle bestimmt. Der spätere, diastolische Anteil der digitalen Volumenpulswelle kommt durch die Reflexion der Pulswelle in der Peripherie, wahrscheinlich vorwiegend an kleinen Arterien insbesondere der unteren Körperabschnitte, zustande.
Abbildung 1. Digitale Photoplethysmographie zur Analyse der Pulswelle. Abbildung 2. Typisches Beispiel für kontinuierliches Monitoring der Pulswelle durch digitale Photoplethysmographie. Dargestellt sind die Pulswellen, die über einen Zeitraum von 60 Sekunden (obere Abbildung) bzw. 10 Sekunden (untere Abbildung) aufgezeichnet wurden. |
Ein Verweis auf die Quelle fehlt. |
|
| [14.] Aak/Fragment 009 04 - Diskussion Bearbeitet: 17. August 2014, 22:09 Schumann Erstellt: 15. August 2014, 15:26 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 9, Zeilen: 4-29, 36-40 |
Quelle: Abraha 2005 Seite(n): 6, 10, 11, Zeilen: 6. 2-9; 10: 9ff; 11: 1-5 |
|---|---|
| Die Anamnese des Patienten wurde erhoben, insbesondere zu früheren kardio-, peripher- und cerebrovaskulären Erkrankungen einschließlich koronarer Herzerkrankung (KHK), Insult, peripher arterieller Verschlusskrankheit (pavk), zu arterieller Hypertonie, Diabetes mellitus, nach Tumorleiden, Art der Nierenerkrankung, Gesamtdauer der Dialysetherapie (in Monaten) und Dauer der Einzeldialyse (in Stunden) sowie zur Medikation insbesondere Vitamine, Phosphatbinder, Acetylcystein, Erythropoietin, Eisen, Angiotensin-Converting Enzym-Hemmer, ß-Blocker, Calcium-Antagonisten, Nitrate, HMG-CoA-Reduktase- Hemmer, Thrombozytenaggregationshemmer, Diuretika, Immunsuppressiva.
Laborchemisch wurden am Start der Dialyse das Blutbild, die Elektrolyte (Natrium, Kalium, Calcium, Phosphat), die Retentionsparameter (Harnstoff, Kreatinin, Harnsäure), Gesamteiweiß und Albumin, die Leberenzyme (GOT, GPT, GGT, alkalische Phosphatase und Gesamt-Bilirubin) die Bluttfettwerte (Gesamt-, HDL-, LDL-Cholesterin und Triglyceride) sowie die kardiovaskulären Risikofaktoren (Parathormon, Lipoprotein (a) und Homocystein ) bestimmt. Die Gefäßmessungen am Start und am Ende der Hämodialyse erfolgten mittels digitaler Photoplethysmographie, HDI/Puls Wave Cardiovascular Profiling Instrument. 3.2. Charakterisierung der Patienten Die Untersuchung wurde bei Patienten mit dialysepflichtiger chronischer Niereninsuffizienz durchgeführt. Einschlusskriterien waren: Alter > 18 Jahre, beiderlei Geschlecht, zustimmungsfähig, schriftliche und mündliche Zustimmung (informed consent). Für eine Untersuchung während der Hämodialysebehandlung lag ein zustimmendes Votum der zuständigen Ethik-Kommission der Charité Universitätsmedizin Berlin, Campus Benjamin Franklin, vor. Die Untersuchung erfolgte nach entsprechender Aufklärung und schriftlicher Einwilligungserklärung des Patienten. [...] Die digitale Photoplethysmographie wurde mit einem Pulsoximeter (Vitaguard VG3000; getemed, Teltow) durchgeführt mit einem Sensor (LNOP-Adult spo2 Sensor; Masimo Corp. CA), der auf die Fingerkuppe des Mittelfingers oder des nächsten freien Fingers der kontralateralen Arm des Shuntes aufgeklebt wird. Ab[bildung 3. zeigt die Messapparatur in situ.] |
2.1 Charakterisierung der Patienten
Die Untersuchung wurde bei Patienten mit dialysepflichtiger chronischer Niereninsuffizienz durchgeführt. Einschlusskriterien waren: Alter > 18 Jahre, beiderlei Geschlecht, zustimmungsfähig, schriftliche und mündliche Zustimmung (informed consent). Für eine Untersuchung während der Hämodialysebehandlung lag ein zustimmendes Votum der zuständigen Ethik-Kommission der Charité Universitätsmedizin Berlin, Campus Benjamin Franklin, vor. Die Untersuchung erfolgte nach entsprechender Aufklärung und schriftlicher Einwilligungserklärung des Patienten. [Seite 10] Inhalt waren Fragen zum Alkohol- und Zigarettenkonsum, zu früheren kardio-, peripher- und cerebrovaskulären Erkrankungen einschließlich koronarer Herzerkrankung (KHK), Insult, peripher arterieller Verschlusskrankheit (pAVK), zu arterieller Hypertonie, Diabetes mellitus, nach Tumorleiden, Art der Nierenerkrankung, Gesamtdauer der Dialysetherapie (in Monaten) und Dauer der Einzeldialyse (in Stunden) sowie zur Medikation insbesondere Vitamine, Phophatbinder, ACC, EPO, Eisen, ACE-Hemmer, ß-Blocker, Calcium-Antagonisten, Nitrate, HMGcoA-Reductase-Hemmer, Thrombozytenaggregationshemmer, Diuretika, Immunsuppressiva. Am Start der Dialyse wurden das Blutbild, die Elektrolyte (Na, K, Ca, Phosphat), die Retentionsparameter (Harnstoff, Kreatinin, Harnsäure), Gesamteiweiß und Albumin, die Leberenzyme (GOT, GPT, GGT, alk. Phosphatase und Gesamt-Bilirubin), die Blutfettwerte (Gesamt-, HDL-, LDL-Cholesterin und Triglyceride) sowie die kardiovaskulären Risikofaktoren (Parathormon, Lipoprotein A und Homocystein) laborchemisch bestimmt. Am Ende der Dialyse wurden oben genannte Elektrolyte, Retentionsparameter, Gesamteiweiß und Albumin sowie das Blutbild laborchemisch bestimmt. Die Gefäßmessungen am Start und am Ende der Hämodialyse erfolgten mittels digitaler Photoplethysmographie, HDI/Puls WaveTM Cardiovascular Profiling Instrument und SphygmoCor/PWV Blood Pressure Analysis System BPAS-1/A. [Seite 11] 2.3 Digitale Photoplethysmographie Die digitale Photoplethysmographie wurde mit einem Pulsoximeter (Vitaguard VG3000; getemed, Teltow) durchgeführt mit einem Sensor (LNOP-Adult SpO2 sensor; Masimo Corp. CA), der auf die Fingerkuppe des Mittelfingers aufgeklebt wird. Abbildung 1 zeigt die Messapparatur in situ. |
Ein Verweis auf die Quelle fehlt. |
|
| [15.] Aak/Fragment 007 01 - Diskussion Bearbeitet: 17. August 2014, 22:07 Schumann Erstellt: 16. August 2014, 13:11 (Hindemith) | Aak, Fragment, Gesichtet, Park 2001, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 7, Zeilen: 1-17 |
Quelle: Park 2001 Seite(n): 47, Zeilen: 2-6, 12-24 |
|---|---|
| [Eine mit der Niereninsuffizienz einhergehende Anämie kann] eine Dilatation des linken Ventrikels mit kompensatorischer linksventrikulärer Hypertrophie induzieren (Foley et al., 1998). Weiterhin stellt die Anämie einen Risikofaktor für die Entwicklung einer de novo Herzinsuffizienz dar und ist mit einem erhöhten Mortalitätsrisiko verbunden (Parfrey, 2000).
Die ausreichende Korrektur der renalen Anämie mit einer Erythropoietin-Medikation bei Patienten mit terminaler Niereninsuffizienz wird kontrovers diskutiert. Studien mit partieller Korrektur der renalen Anämie mittels einer Erythropoietin-Therapie zeigten zwar eine Verbesserung, jedoch keine Normalisierung der linksventrikulären Strukturveränderungen (Sunder-Plassmann, Horl, 2001; Parfrey 2000; Locatelli et al., 2000). Eine kanadische Studie verglich den Effekt einer Erythropoietin-Medikation auf die linksventrikuläre Struktur bei Hämodialysepatienten mit konzentrischer, linksventrikulärer Hypertrophie oder linksventrikulärer Dilatation. Eine vollständige Korrektur der Anämie führte auch hier zu keiner Regression der kardiomuskulären Veränderungen. Die Arbeit gab jedoch Hinweise dafür, dass die Normalisierung des Hämoglobin-Wertes eine linksventrikuläre Dilatation bei Hämodialysepatienten mit normaler Ventrikelgröße verhindern kann (Foley et al., 2000). |
Eine mit einer Niereninsuffizienz einhergehende Anämie kann eine Dilatation des linken Ventrikels mit kompensatorischer linksventrikulärer Hypertrophie induzieren (Foley et al., 1998), stellt einen Risikofaktor für die Entwicklung einer de novo Herzinsuffizienz dar und ist mit einem erhöhten Mortalitätsrisiko verbunden (Parfrey, 2000).
[...] Die Korrektur der renalen Anämie mit einer Erythropoietin-Medikation bei Patienten mit terminaler Niereninsuffizienz wird kontrovers diskutiert. Studien mit partieller Korrektur der renalen Anämie mittels einer Erythropoietin-Therapie zeigten zwar eine Verbesserung, jedoch keine Normalisierung der linksventrikulären Strukturveränderungen (Sunder-Plassmann, Horl, 2001; Parfrey 2000; Locatelli et al.,2000). Eine kanadische Studie verglich den Effekt einer kompletten gegenüber einer partiellen Korrektur der renalen Anämie mit einer Erythropoietin-Medikation auf die linksventrikuläre Struktur bei Hämodialysepatienten mit konzentrischer, linksventrikulärer Hypertrophie oder linksventrikulärer Dilatation. Eine vollständige Korrektur der Anämie führte auch hier zu keiner Regression der kardiomuskulären Veränderungen. Die Arbeit gab jedoch Hinweise dafür, dass die Normalisierung des Hämoglobin-Wertes eine linksventrikuläre Dilatation bei Hämodialysepatienten mit normaler Ventrikelgröße verhindern kann (Foley et al., 2000). |
Ein Verweis auf die Quelle fehlt. |
|
| [16.] Aak/Fragment 006 44 - Diskussion Bearbeitet: 17. August 2014, 22:05 Schumann Erstellt: 16. August 2014, 13:06 (Hindemith) | Aak, Fragment, Gesichtet, KomplettPlagiat, Park 2001, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 6, Zeilen: 44-48 |
Quelle: Park 2001 Seite(n): 47, Zeilen: 7-11 |
|---|---|
| Madore und Mitarbeiter zeigten 1997 in ihrer Studie an 21.899 Hämodialysepatienten, dass das Mortalitätsrisiko- bei Patienten mit Hämoglobinkonzentrationen von weniger als 8g/dl im Vergleich zu Patienten mit Hämoglobin-Werten von 10– 11 g/dl etwa doppelt so hoch war. Werte über 11g/dl führten zu weiterer Senkung des Mortalitätsrisikos. | Madore und Mitarbeiter zeigten 1997 in ihrer Studie an 21899 Hämodialysepatienten, dass das Mortalitätsrisiko bei Patienten mit Hämoglobinkonzentrationen von weniger als 8 g/dL im Vergleich zu Patienten mit Hämoglobin-Werten von 10-11 g/dL etwa doppelt so hoch war. Werte über 11g/dL führten zu keiner weiteren Senkung des Mortalitätsrisikos. |
Ein Verweis auf die Quelle fehlt. Die Originalquelle ist auf Englisch verfasst und enthält den Wortlaut also nicht. Man beachte, dass sie im Literaturverzeichnis der untersuchten Arbeit nicht gelistet ist. Man beachte die Auslassung von "keiner" bei der Übernahme, was den Sinn der betreffenden Aussage ins Gegenteil verkehrt. Fortsetzung auf der nächsten Seite. |
|
| [17.] Aak/Fragment 006 13 - Diskussion Bearbeitet: 17. August 2014, 22:04 Schumann Erstellt: 14. August 2014, 20:27 (Hindemith) | Aak, Fragment, Gebauer 2004, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 6, Zeilen: 13-43 |
Quelle: Gebauer 2004 Seite(n): 8, 9, 10, Zeilen: 8: 8ff - 9: 1 ff; 10: 1-8 |
|---|---|
| Es ist bekannt, dass die inadäquate Erythropoietinproduktion die Hauptursache der Anämie bei der chronischen Niereninsuffizienz darstellt. Erythropoietin ist ein sialinisiertes Glykoprotein aus zunächst 193 Aminosäuren, von denen 27 Aminosäuren als „leader sequence“ sowie das terminale Arginin posttranslational abgespalten werden. Damit entsteht ein Polypeptid aus 165 Aminosäuren, dessen Tertiärstruktur durch zwei Disulfidbrücken stabilisiert wird. Das Molekül enthält vier Kohlenhydratketten, die 40% des Molekulargewichts von 30.400 Dalton ausmachen. Für die Stabilität und damit die biologische Aktivität sind die endständigen Sialinsäuren der Kohlenhydratketten entscheidend, die das Molekül vor der hepatischen Metabolisierung bewahren.
Die Plasmakonzentration Gesunder liegt zwischen 8 und 18 mu/ml und kann ausgelöst durch Hypoxämie exponentiell auf das Tausendfache steigen. Produktionsort des Erythropoietins sind peritubuläre interstitielle Zellen im Nierenkortex. Zu geringeren Anteilen auch die Hepatozyten und Makrophagen der Leber, die vor allem in der Embryonalentwicklung die Produktion von Erythropoietin übernehmen. Das Hormon Erythropoietin stellt einen hämatopoetischen Wachstumsfaktor dar und stimuliert im Knochenmark die Bildung von Erythrozyten in Abhängigkeit vom Sauerstoffbedarf des Organismus. Dabei ist die Produktionsrate des Hormons invers proportional zur Sauerstoffkapazität des Blutes. Die Produktion wird durch einen Feedback-Mechanismus reguliert, bei dem durch gesteigerte Erythropoese und dadurch vermehrte Erythrozytenkonzentration eine Reduktion der Hypoxie entsteht. Erythropoietin aktiviert die erythropoetischen Vorläuferzellen im Knochenmark durch einen extrazellulären, membrangebundenen Rezeptor und setzt durch Homodimerisation der beiden Rezeptorketten eine intrazelluläre Signalkaskade in Gang. Erythropoietin reguliert primär durch Apoptosehemmung die Anzahl und Differenzierung von erythropoetischen Vorläuferzellen. Die Sauerstoffempfindlichkeit der Niere und die Stimulation der Erythrozytenproduktion durch Erythropoietin stellen somit einen effizienten Mechanismus zur Aufrechterhaltung der optimalen Sauerstoffversorgung des Gewebes dar. |
Hiermit konnte eindeutig bestätigt werden, dass die inadäquate Erythropoietinproduktion die Hauptursache der Anämie bei der chronischen Niereninsuffizienz darstellt.
1.2 Erythropoietin Erythropoietin ist ein sialinisiertes Glykoproteid-Hormon aus zunächst 193 Aminosäuren, von denen 27 Aminosäuren als „leader sequence“ sowie das terminale Arginin posttranslational abgespalten werden (58). Damit entsteht ein Polypeptid aus 165 Aminosäuren , dessen Tertiärstruktur durch zwei Disulfidbrücken stabilisiert wird. Das Molekül enthält vier Kohlenhydratketten, die 40 % des Molekulargewichts von 30,400 Dalton ausmachen. Für die Stabilität und damit die biologische Aktivität sind die endständigen Sialinsäuren der Kohlenhydratketten entscheidend, die das Molekül vor der hepatischen Metabolisierung bewahren. Die Plasmakonzentration Gesunder liegt zwischen 8 und 18 mU/ml und kann ausgelöst durch Hypoxämie exponentiell auf das Tausendfache steigen (21). Produktionsort des Erythropoietin sind peritubuläre interstitielle Zellen im Nierenkortex (44,45), zu geringeren Anteilen auch die Hepatozyten und Makrophagen (20) der [Seite 9] Leber, die vor allem in der Embryonalentwicklung die Produktion von Erythropoietin übernehmen (30). [...] [...] Das Hormon stellt einen hämatopoetischen Wachstumsfaktor dar und stimuliert im Knochenmark die Bildung von Erythrozyten in Abhängigkeit vom Sauerstoffbedarf des Organismus. Die Expression von Erythropoietin wird durch Anämie oder Hypoxie reguliert. Dabei ist die Produktionsrate des Hormons invers proportional zur Sauerstoffkapazität des Blutes (61). Die Produktion wird durch einen Feedback- Mechanismus reguliert, bei dem durch gesteigerte Erythropoiese und dadurch vermehrte Erythrozytenkonzentration eine Reduktion der Hypoxie resultiert. [Seite 10] Erythropoietin aktiviert die erythropoietischen Vorläuferzellen (C-FU, G-FU) im Knochenmark durch einen extrazellulären, membrangebundenen Rezeptor und setzt durch Homodimerisation der beiden Rezeptorketten eine intrazelluläre Signalkaskade in Gang (42). Erythropoietin reguliert primär durch Apoptosehemmung die Anzahl und Differenzierung von erythropoietischen Vorläuferzellen (53). Die Sauerstoffempfindlichkeit der Niere und die Stimulation der Erythrozytenproduktion durch Erythropoietin stellen somit einen effizienten Mechanismus zur Aufrechterhaltung der optimalen Sauerstoffversorgung des Gewebes dar (19). 19. Erslev AJ (1971) Feedback circuits in the control of stem cell differentiation. Am J Pathol 65:629-639. 20. Erslev AJ, Besarab A (1997) Erythropoietin in the pathogenesis and treatment of the anemia of chronic renal failure. Kidney Int 51:622-630. 21. Erslev AJ, Caro J, Miller O, Silver R (1980) Plasma erythropoietin in health and disease. Ann Clin Lab Sci 10:250-257. 30. Fried W (1972) The liver as a source of extrarenal erythropoietin production. Blood 40:671-677. 42. Klingmuller U, Lorenz U, Cantley LC, Neel BG, Lodish HF (1995) Specific recruitment of SH-PTP1 to the erythropoietin receptor causes inactivation of JAK2 and termination of proliferative signals. Cell 80:729-738. 44. Koury ST, Bondurant MC, Koury MJ (1988) Localization of erythropoietin synthesizing cells in murine kidneys by in situ hybridization. Blood 71:524-527. 45. Lacombe C, Da Silva JL, Bruneval P, Fournier JG, Wendling F, Casadevall N, Camilleri JP, Bariety J, Varet B, Tambourin P (1988) Peritubular cells are the site of erythropoietin synthesis in the murine hypoxic kidney. J Clin Invest 81:620- 623. 53. Mulcahy L (2001) The erythropoietin receptor. Semin Oncol 28:19-23. 58. Recny MA, Scoble HA, Kim Y (1987) Structural characterization of natural human urinary and recombinant DNA-derived erythropoietin. Identification of desarginine 166 erythropoietin. J Biol Chem 262:17156-17163. 61. Schurek HJ, Jost U, Bertram H, Baumgärtl. (1989) Preglomerular cortical oxygen diffusion shunt: A prerequisite for effective erythropoietin regulation? In: Baldamus CA, Scigalla P, Wieczorek L, Koch KM (Hrsg) Erythropoietin: From Molecular Structure to Clinical Application. Karger, Basel 76 S 57-66 |
Ein Verweis auf die Quelle fehlt. In der Quellen werden die getroffenen Aussagen mit einem aufwendigen Fußnotenapparat belegt, in der untersuchten Arbeit nicht. |
|
| [18.] Aak/Fragment 006 01 - Diskussion Bearbeitet: 17. August 2014, 22:04 Schumann Erstellt: 14. August 2014, 06:25 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 6, Zeilen: 1-11 |
Quelle: Abraha 2005 Seite(n): 4, 5, Zeilen: 4: letzte Zeilen - 5: 1ff |
|---|---|
| [Die bisher durchgeführten Monitoring-Verfahren, wie die personal]intensive intermittierende Blutdruckmessung des Patienten durch das Dialysepersonal oder die kostenintensive Steuerung der maschinellen Ultrafiltration über das Blutvolumen, können in der täglichen Routine ein kontinuierliches hämodynamisches Monitoring des Patienten bislang nicht gewährleisten. Mit einem Pulsoximeter kann eine kontinuierliche digitale Photoplethysmographie durchgeführt werden, die es erlaubt, den Volumenpuls am Finger kontinuierlich aufzuzeichnen (Millasseau et al., 2003; Takazawa et al., 1998). Mit der digitalen Photoplethysmographie könnte somit eine kontinuierliche Überwachung der Hämodynamik bei den Hämodialysepatienten erfolgen. Allerdings gab es bislang keinen leicht anwendbaren Auswerte-Algorithmus, um aus dem Volumenpuls am Finger Aussagen über die Hämodynamik bei den Patienten machen zu können. | Die bisher durchgeführten Monitoring-Verfahren, wie die personalintensive intermittierende Blutdruckmessung des
[Seite 5] Patienten durch das Dialysepersonal oder die kostenintensive Steuerung der maschinellen Ultrafiltration über das Blutvolumen, können in der täglichen Routine ein kontinuierliches hämodynamisches Monitoring des Patienten bislang nicht gewährleisten. Mit einem Pulsoximeter kann eine kontinuierliche digitale Photoplethysmographie durchgeführt werden, die es erlaubt, den Volumenpuls am Finger kontinuierlich aufzuzeichnen (Millasseau et al., 2003; Takazawa et al., 1998). Mit der digitalen Photoplethysmographie könnte somit eine kontinuierliche Überwachung der Hämodynamik bei den Hämodialysepatienten erfolgen. Allerdings gab es bislang keinen leicht anwendbaren Auswerte-Algorithmus, um aus dem Volumenpuls am Finger Aussagen über die Hämodynamik bei den Patienten machen zu können. |
Ein Verweis auf die Quelle fehlt. |
|
| [19.] Aak/Fragment 005 01 - Diskussion Bearbeitet: 17. August 2014, 22:02 Schumann Erstellt: 14. August 2014, 20:16 (Hindemith) | Aak, Bender 2005, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 5, Zeilen: 1-16 |
Quelle: Bender 2005 Seite(n): 16, Zeilen: 2ff |
|---|---|
| Bei der konventionellen Hämodialyse erfolgt die Elimination von urämischen Metaboliten aus dem Blut des Patienten mittels eines Dialysators innerhalb von 3-5 Stunden an 3-4 Tagen/Woche. Hierzu muss ein ausreichend großes Blutvolumen pro Zeiteinheit gereinigt werden, wozu ein entsprechender Gefäßzugang erforderlich ist.
Meist werden arteriovenöse Gefäßzugänge, die sogenannten Shunts (Abbildung 2), bevorzugt am Unter- oder Oberarm, mit oder ohne Gefäßprothese angelegt. Bei der Hämodialyse findet der Stofftransport mittels Diffusion gemäß einem Konzentrationsgradienten über eine semipermeable Membran statt, die sich zwischen Blut und Dialysatlösung befindet. Um den Gradienten zwischen Blut und Dialysat möglichst groß zu halten, werden Blut und Dialysat nach dem Gegenstromprinzip geleitet. Das Dialysat wird nach einem Durchfluss verworfen. Die Porengröße der Dialysemembran definiert dabei die Durchlässigkeit für verschieden große Moleküle. Dabei werden Stoffe nicht nur eliminiert, sondern auch über das Dialysat zugeführt (z.B. Bikarbonat, Calcium und Glukose). |
Bei der konventionellen Hämodialyse erfolgt die Elimination von urämischen Metaboliten aus dem Blut des Patienten mittels eines Dialysators innerhalb von 3-5 Stunden an 3-4 Tagen/Woche. Hierzu muß ein ausreichend großes Blutvolumen pro Zeiteinheit gereinigt werden, wozu ein entsprechender Gefäßzugang erforderlich ist. Meist werden arteriovenöse Gefäßzugänge, die sogenannten Shunts, bevorzugt am Unter- oder Oberarm, mit oder ohne Gefäßprothese angelegt. Bei der Hämodialyse findet der Stofftransport mittels Diffusion gemäß eines Konzentrationsgradienten über eine semipermeable Membran statt, die sich zwischen Blut und Dialysatlösung befindet. Um den Gradienten zwischen Blut und Dialysat möglichst groß zu halten, werden Blut und Dialysat nach dem Gegenstromprinzip geleitet. Das Dialysat wird nach einem Durchfluß verworfen. Die Porengröße der Dialysemembran definiert dabei die Durchlässigkeit für verschieden große Moleküle. Dabei werden Stoffe nicht nur eliminiert, sondern auch über das Dialysat zugeführt (z.B. Bikarbonat, Calcium und Glukose). |
Ein Verweis auf die Quelle fehlt. |
|
| [20.] Aak/Fragment 005 17 - Diskussion Bearbeitet: 17. August 2014, 21:53 Schumann Erstellt: 14. August 2014, 06:22 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 5, Zeilen: 17-18, 22-27 |
Quelle: Abraha 2005 Seite(n): 4, Zeilen: 26-31 |
|---|---|
| Eine Hämodialysebehandlung ist seit Jahren ein sehr effektives Routineverfahren zur Behandlung der terminalen Niereninsuffizienz. [...] Trotz eines hohen Technikstandards stellen aber die Überwachung des Kreislaufes während der Hämodialyse, die Vermeidung von Blutdruckabfällen während der Hämodialysebehandlung und die Bestimmung des korrekten "Trockengewichts", d.h. das optimale Gewicht eines Dialyse-Patienten, wesentliche Probleme bei der Betreuung dieser Patienten dar. | Eine Hämodialysebehandlung ist seit Jahren ein sehr effektives Routineverfahren zur Behandlung der terminalen Niereninsuffizienz. Trotz eines hohen Technikstandards stellen aber die Überwachung des Kreislaufes während der Hämodialyse, die Vermeidung von Blutdruckabfällen während der Hämodialysebehandlung und die Bestimmung des korrekten "Trockengewichts", d.h. das optimale Gewicht eines Dialyse-Patienten, wesentliche Probleme bei der Betreuung dieser Patienten dar. |
Ein Verweis auf die Quelle fehlt. |
|
| [21.] Aak/Fragment 004 01 - Diskussion Bearbeitet: 17. August 2014, 21:52 Schumann Erstellt: 14. August 2014, 06:18 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 4, Zeilen: 1-26 |
Quelle: Abraha 2005 Seite(n): 3, 4, Zeilen: 3: letzte Zeile - 4: 1ff |
|---|---|
| [Da sowohl Patienten mit mäßiger als auch mit schwerer Nierenschädigung gehäuft Ent]zündungen vorweisen, lässt sich vermuten, dass die endotheliale Dysfunktion eine Zwischenstufe im Verhältnis von Entzündung und kardiovaskulärer Schädigung bei niereninsuffizienten Patienten darstellt. Dafür spricht auch, dass eine Reihe antiinflammatorisch wirksamer Therapieregime zu einer Verbesserung der Endothelfunktion in Studien an nierengesunden Patienten führten (Bhagat & Vallance, 1997; Raza et al., 2000). Miyazaki et al. (2000) konnte bei Hämodialysepatienten zeigen, dass schon eine einzelne Dialyse unter Verwendung einer „non coated“ Dialysemembran zu einer Schädigung der endothelvermittelten Vasodilatation führt während es bei Verwendung einer „Vitamin E coated“ Dialysemembran zu keiner Schädigung der Endothelfunktion kam.
Eine Erhöhung des oxidativen Stresses ist bei Patienten mit terminaler Niereninsuffizienz mehrfach beschrieben worden (Becker et al., 1997; Himmelfarb & Hakim, 2003; Kalousova et al. , 2003; Tepel, 2003; Tepel et al., 2000; Vaziri et al., 2002). Durch gesteigerten oxidativen Stress ausgelöste Veränderungen von Transkription und Wachstum sind bekannt für die Entwicklung von arteriosklerotischen Gefäßveränderungen (Blake & Ridker, 2001; Chakraborti & Chakraborti, 1998; Griendling et al. , 2000; Kamata & Hirata, 1999; Lassegue et al., 2001; Outinen et al., 1999; Parthasarathy et al., 1999; Wolin, 2000). In der letzten Zeit hat sich gezeigt, dass besonders die Steigerung des oxidativen Stresses bei chronischer Niereninsuffizienz Bedeutung für die erhöhte Morbidität und Mortalität hat, und dass eine antioxidative Therapie bei diesen Patienten günstig ist (Tepel, 2003). Die Gabe von antioxidativ wirksamem [sic] Vitamin E verminderte das Auftreten von kardiovaskulären Ereignissen bei Patienten mit dialysepflichtiger Niereninsuffizienz (Boaz et al. , 2000). Auch eine antioxidative Therapie mit Acetylcystein vermindert das Auftreten von kardiovaskulären Ereignissen bei Patienten mit dialysepflichtiger Niereninsuffizienz (Tepel et al. , 2003). |
Da sowohl Patienten mit mäßiger
[Seite 4] als auch mit schwerer Nierenschädigung gehäuft Entzündungen vorweisen, lässt sich vermuten, dass die endotheliale Dysfunktion eine Zwischenstufe im Verhältnis von Entzündung und kardiovaskulärer Schädigung bei niereninsuffizienten Patienten darstellt. Dafür spricht auch, dass eine Reihe antiinflammatorisch wirksamer Therapieregime zu einer Verbesserung der Endothelfunktion in Studien an nierengesunden Patienten führten (Bhagat & Vallance, 1997; Raza et al., 2000). Miyazaki et al. (2000) konnte bei Hämodialysepatienten zeigen, dass schon eine einzelne Dialyse unter Verwendung einer „non coated“ Dialysemembran zu einer Schädigung der endothelvermittelten Vasodilatation führt während es bei Verwendung einer „Vitamin E coated“ Dialysemembran zu keiner Schädigung der Endothelfunktion kam. Eine Erhöhung des oxidativen Stresses ist bei Patienten mit terminaler Niereninsuffizienz mehrfach beschrieben worden (Becker et al., 1997; Himmelfarb & Hakim, 2003; Kalousova et al., 2003; Tepel, 2003; Tepel et al., 2000; Vaziri et al., 2002). Durch gesteigerten oxidativen Stress ausgelöste Veränderungen von Transkription und Wachstum sind bekannt für die Entwicklung von arteriosklerotischen Gefäßveränderungen (Blake & Ridker, 2001; Chakraborti & Chakraborti, 1998; Griendling et al., 2000; Kamata & Hirata, 1999; Lassegue et al., 2001; Outinen et al., 1999; Parthasarathy et al., 1999; Wolin, 2000). In der letzten Zeit hat sich gezeigt, dass besonders die Steigerung des oxidativen Stresses bei chronischer Niereninsuffizienz Bedeutung für die erhöhte Morbidität und Mortalität hat, und dass eine antioxidative Therapie bei diesen Patienten günstig ist (Tepel, 2003). Die Gabe von antioxidativ wirksamen Vitamin E verminderte das Auftreten von kardiovaskulären Ereignissen bei Patienten mit dialysepflichtiger Niereninsuffizienz (Boaz et al., 2000). Auch eine antioxidative Therapie mit Acetylcystein vermindert das Auftreten von kardiovaskulären Ereignissen bei Patienten mit dialysepflichtiger Niereninsuffizienz (Tepel et al., 2003). |
Ein Verweis auf die Quelle fehlt. |
|
| [22.] Aak/Fragment 003 03 - Diskussion Bearbeitet: 17. August 2014, 21:50 Schumann Erstellt: 14. August 2014, 06:14 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 3, Zeilen: 3-49 |
Quelle: Abraha 2005 Seite(n): 2, 3, 4, Zeilen: 2: 3ff; 3: 23ff - 4: 1-3 |
|---|---|
| Bei Patienten mit chronischer Niereninsuffizienz sind typische Befunde arteiosklerotische Gefäßveränderungen und verminderte Gefäßelastizität. Die Gefäßelastizität hat einen direkten Einfluss auf den Pulsdruck (pulse Presssure), d.h. die Differenz von systolischem und diastolischem Blutdruck (Marchais et al., 1993). Entsprechend konnten Klassen et al. (2002) in einer retrospektiven Kohorten-Studie nach Auswertung der Daten von 37.069 Patienten belegen, dass der Pulsdruck einen eigenständigen Risikofaktor für die Mortalität bei Patienten mit dialysepflichtiger Niereninsuffizienz darstellt. Die vorliegenden Befunde deuten insgesamt darauf hin, dass vaskuläres Remodeling, Gefäßhypertrophie, verminderte Gefäß- Compliance und Gefäßkalzifikationen bei Patienten mit chronischer Niereninsuffizienz eine wesentliche Rolle spielen.
Die Gefäß-Compliance stellt einen charakteristischen Marker für die Intaktheit der Gefäßwand in vivo dar. Strukturelle Veränderungen, wie sie bei verschiedenen Erkrankungen einschließlich arterieller Hypertonie oder chronischer Niereninsuffizienz auftreten, sind durch entsprechende Veränderungen der Gefäß-Compliance darstellbar. Die Veränderungen der Gefäß-Compliance können durch Pulswellenanalyse nicht-invasiv, einfach, risikolos und reproduzierbar bestimmt werden. Dabei wird der Index der Elastizität der großen Gefäße (C1) und der Index der Elastizität der kleinen Gefäße (C2) als Maß für die Gefäß-Compliance ermittelt. In der Literatur finden sich bislang kaum Daten zur Gefäß-Compliance bei Patienten. Überwiegend wurden bislang Untersuchungen an gesunden Probanden durchgeführt. Der C2-Wert zeigt eine negative Korrelation mit dem Lebensalter, d.h. Der C2-Wert nimmt mit steigendem Lebensalter ab (Mcveigh et al., 1999). Der C2- Wert zeigt eine positive Korrelation mit der Körpergröße, d.h. kleinere Personen haben niedrigere C2-Werte (Rietzschel et al., 2001). Bei 179 jungen gesunden Probanden unter 23 Jahren lagen die C2-Werte im Mittel bei 8,3±2,0 ml/mmhg (Mittelwert±SD; Arnett et al., 2001). Bei jungen Männern im mittleren Alter von 24 Jahren waren die C2-Werte signifikant höher im Vergleich zu gleichaltrigen Frauen (Winer et al., 2001). Im Vergleich mit 47 normotensiven Probanden lagen die C2 Werte signifikant niedriger bei 19 Patienten mit isolierter systolischer Hypertonie und bei 29 Patienten mit essentieller Hypertonie (Beltran et al., 2001). In einer Untersuchung bei nur 10 Patienten mit terminaler Niereninsuffizienz zeigten sich ebenfalls erniedrigte C2-Werte. Über eine Korrelation mit klinischen Parametern oder das Langzeit-Outcome war nicht berichtet worden (Cohen & Townsend, 2002). Bei Patienten mit mittlerer sowie schwerer Funktionseinschränkung der Nieren und konsekutiver Dialysetherapie kommt es häufig zur Schädigung der endothelvermittelten Vasodilatation (Annuk et al., 2001; Miyazaki et al., 2000; van Guldener et al., 1998). Die Gründe hierfür sind auch heute noch nicht vollständig aufgeklärt, doch wird spekuliert, dass eine Erhöhung des oxidaktiven Stresses, Hyperhomocysteinämie, Dyslipidämie, Hyperglykämie und Hypertonie eine entscheidende Rolle als Cofaktoren spielen. Auch die Kreatininclearance und damit die eingeschränkte Nierenfunktion per se wurde mit der Endothelfunktion in Verbindung gebracht (Annuk et al., 2001). Untersuchungen an nierengesunden Probanden zeigten einen Zusammenhang zwischen dem Auftreten von Entzündungen und der Schädigung der Endothelfunktion (Stenvinkel, 2001). Da sowohl Patienten mit mäßiger als auch mit schwerer Nierenschädigung gehäuft Ent[zündungen vorweisen, lässt sich vermuten, dass die endotheliale Dysfunktion eine Zwischenstufe im Verhältnis von Entzündung und kardiovaskulärer Schädigung bei niereninsuffizienten Patienten darstellt.] |
[Seite 2]
Arteriosklerotische Gefäßveränderungen und verminderte Gefäßelastizität sind typische Befunde bei Patienten mit chronischer Niereninsuffizienz. Die Gefäßelastizität hat einen direkten Einfluss auf den Pulsdruck (pulse pressure), d.h. die Differenz von systolischem und diastolischem Blutdruck (Marchais et al., 1993). Entsprechend konnten Klassen et al. (2002) in einer retrospektiven Kohorten-Studie nach Auswertung der Daten von 37069 Patienten belegen, dass der Pulsdruck einen eigenständigen Risikofaktor für die Mortalität bei Patienten mit dialysepflichtiger Niereninsuffizienz darstellt. Die vorliegenden Befunde deuten insgesamt darauf hin, dass vaskuläres Remodeling, Gefäßhypertrophie, verminderte Gefäß-Compliance und Gefäßkalzifikationen bei Patienten mit chronischer Niereninsuffizienz eine wesentliche Rolle spielen. Die Gefäß-Compliance stellt einen charakteristischen Marker für die Intaktheit der Gefäßwand in vivo dar. Strukturelle Veränderungen, wie sie bei verschiedenen Erkrankungen einschließlich arterieller Hypertonie oder chronischer Niereninsuffizienz auftreten, sind durch entsprechende Veränderungen der Gefäß-Compliance darstellbar. Die Veränderungen der Gefäß- Compliance können durch Pulswellenanalyse nicht-invasiv, einfach, risikolos und reproduzierbar bestimmt werden. Dabei werden der Index der Elastizität der großen Gefäße (C1) und der Index der Elastizität der kleinen Gefäße (C2) als Maß für die Gefäß- Compliance ermittelt. In der Literatur finden sich bislang kaum Daten zur Gefäß- Compliance bei Patienten. Überwiegend wurden bislang Untersuchungen an gesunden Probanden durchgeführt. Der C2-Wert zeigt eine negative Korrelation mit dem Lebensalter, d.h. der C2-Wert nimmt mit steigendem Lebensalter ab (McVeigh et al., 1999). Der C2-Wert zeigt eine positive Korrelation mit der Körpergröße, d.h. kleinere Personen haben niedrigere C2-Werte (Rietzschel et al., 2001). Bei 179 jungen gesunden Probanden unter 23 Jahren lagen die C2-Werte im Mittel bei 8,3±2,0 mL/mmHg (Mittelwert ± SD; Arnett et al., 2001). Bei jungen Männern im mittleren Alter von 24 Jahren waren die C2-Werte signifikant höher im Vergleich zu gleichaltrigen Frauen (Winer et al., 2001). Im Vergleich mit 47 normotensiven Probanden lagen die C2 Werte signifikant niedriger bei 19 Patienten mit isolierter systolischer Hypertonie und bei 29 Patienten mit essentieller Hypertonie (Beltran et al., 2001). In einer Untersuchung bei nur 10 Patienten mit terminaler Niereninsuffizienz zeigten sich ebenfalls erniedrigte C2-Werte, über eine Korrelation mit klinischen Parametern oder das Langzeit-Outcome war nicht berichtet worden (Cohen & Townsend, 2002). [Seite 3] Bei Patienten mit mittlerer sowie schwerer Funktionseinschränkung der Nieren und konsekutiver Dialysetherapie kommt es häufig zur Schädigung der endothelvermittelten Vasodilatation (Annuk et al., 2001; Miyazaki et al., 2000; van Guldener et al., 1998). Die Gründe hierfür sind auch heute noch nicht vollends aufgeklärt, doch wird spekuliert, dass eine Erhöhung des oxidativen Stresses, Hyperhomocysteinämie, Dyslipidämie, Hyperglykämie, Hypertonie und eine Erhöhung der Retentionswerte für L-Arginin Inhibitor eine entscheidende Rolle als Cofaktoren spielen. Auch die Kreatininclearance und damit die eingeschränkte Nierenfunktion per se wurde mit der Endothelfunktion in Verbindung gebracht (Annuk et al., 2001). Untersuchungen an nierengesunden Probanden zeigten einen Zusammenhang zwischen dem Auftreten von Entzündungen und der Schädigung der Endothelfunktion (Stenvinkel, 2001). Da sowohl Patienten mit mäßiger [Seite 4] als auch mit schwerer Nierenschädigung gehäuft Entzündungen vorweisen, lässt sich vermuten, dass die endotheliale Dysfunktion eine Zwischenstufe im Verhältnis von Entzündung und kardiovaskulärer Schädigung bei niereninsuffizienten Patienten darstellt. |
Ein Verweis auf die Quelle fehlt. |
|
| [23.] Aak/Fragment 002 28 - Diskussion Bearbeitet: 17. August 2014, 21:48 Schumann Erstellt: 14. August 2014, 06:05 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 2, Zeilen: 28-47 |
Quelle: Abraha 2005 Seite(n): 1, 2, Zeilen: 1: 10ff - 2: 1-2 |
|---|---|
| Patienten mit chronischer Niereninsuffizienz haben eine erheblich gesteigerte kardiovaskuläre Morbidität und Mortalität (Amann et al., 2004; Anavekar et al., 2004; Mallick & Gokal, 1999; Pastan & Bailey, 1998; Sarnak et al., 2003; Saw et al., 2004). Die jährliche Todesrate von Patienten mit terminaler Niereninsuffizienz liegt bei fast 25%. Patienten mit terminaler Niereninsuffizienz haben gehäuft kardiovaskuläre Ereignisse (Locatelli et al., 2004; Parfrey, 2000; Sarnak et al., 2003). Weiterhin konnte gezeigt werden, dass die Langzeitprognose nach Myokardinfarkt bei Patienten mit chronischer Niereninsuffizienz schlecht ist (Anavekar et al., 2004; Herzog et al., 1998). Wichtige Kofaktoren für die gesteigerte Mortalität bei Dialysepatienten sind eine Urämie-bedingte Malnutrition und die unzureichende Entfernung von Urämietoxinen (Iseki et al., 1993; Iseki et al., 1997; Owen et al., 1993). Weitere Gründe für die vermehrten kardiovaskulären Ereignisse bei Patienten mit dialysepflichtiger Niereninsuffizienz sind häufig vorliegende traditionelle Risikofaktoren wie Diabetes mellitus, arterielle Hypertonie (Bianchi G. et al 2000), Dyslipidämie oder Rauchen. Außerdem existieren noch zahlreiche spezifische niereninsuffizienzbedingte Risikofaktoren, wie Mikroinflammation (charakteristischer Marker z.B. C-reaktives Protein, Yeun et al 2000), gesteigerte reaktive Sauerstoffradikale (z.B. Superoxid-Radikale, Tepel 2003), chronische Anämie oder Eisenmangel, Urämietoxine (z.B. Homocystein, Bachmann et al 1995, asymmetrisches Dimethylarginin, Zoccali C. et al 2001), entzündliche Gefäßver[änderungen (Bhagat K et al 2001), Gefäßverkalkungen (Goodman et al 2000) oder Salz- und Wasserüberschuss (Goldwasser P et al 1993).] | Patienten mit chronischer Niereninsuffizienz haben eine erheblich gesteigerte kardiovaskuläre Morbidität und Mortalität (Amann et al., 2004; Anavekar et al., 2004; Mallick & Gokal, 1999; Pastan & Bailey, 1998; Sarnak et al., 2003; Saw et al., 2004). Die jährliche Todesrate von Patienten mit terminaler Niereninsuffizienz liegt bei fast 25%. Patienten mit terminaler Niereninsuffizienz haben gehäuft kardiovaskuläre Ereignisse (Locatelli et al., 2000; Parfrey, 2000; Sarnak et al., 2003). Weiterhin konnte gezeigt werden, dass die Langzeitprognose nach Myokardinfarkt bei Patienten mit chronischer Niereninsuffizienz schlecht ist (Anavekar et al., 2004; Herzog et al., 1998). Wichtige Cofaktoren für die gesteigerte Mortalität bei Dialysepatienten sind eine urämiebedingte Malnutrition und die unzureichende Entfernung von Urämietoxinen (Iseki et al., 1993; Iseki et al., 1997; Owen et al., 1993). Weitere Gründe für die vermehrten kardiovaskulären Ereignisse bei Patienten mit dialysepflichtiger Niereninsuffizienz sind häufig vorliegende traditionelle Risikofaktoren wie Diabetes mellitus, arterielle Hypertonie, Dyslipidämie oder Rauchen. Außerdem existieren noch zahlreiche spezifische niereninsuffizienzbedingte Risikofaktoren, wie Mikroinflammation (charakteristischer Marker z.B. C-reaktives Protein), gesteigerte reaktive Sauerstoffradikale (z.B. Superoxid-Radikale), chronische Anämie oder Eisenmangel, Urämietoxine (z.B. Homocystein, asymmetrisches Dimethylarginin), entzündliche Gefäßveränderungen, Gefäßverkalkungen oder Salz- und Wasserüberschuss (Bachmann et al., 1995; Baigent et al., 2000; Bianchi, 2000; Block et al., 1998; Charra et al., 1996; Goldwasser et al., 1993; Goodman et al., 2000; Kalantar- Zadeh et al., 2004a; Kalantar-Zadeh et al., 2004b; Locatelli et al., 2004; Parfrey, 2000;
[Seite 2] Stenvinkel & Barany, 2002; Tepel, 2003; Tepel et al., 2000; Yeun & Kaysen, 2000; Zoccali et al., 2001). |
Ein Verweis auf die Quelle fehlt. |
|
| [24.] Aak/Fragment 002 03 - Diskussion Bearbeitet: 17. August 2014, 21:47 Schumann Erstellt: 14. August 2014, 05:58 (Hindemith) | Aak, Abraha 2005, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 2, Zeilen: 3-8 |
Quelle: Abraha 2005 Seite(n): 1, Zeilen: 3-7 |
|---|---|
| In Deutschland beträgt die Prävalenz der chronischen Nierenersatztherapie 949 Patienten pro 1 Million Einwohner (Bericht über Dialysebehandlung und Nierentransplantation in Deutschland, Quasiniere, Dezember 2004), davon 710 Patienten pro 1 Million Einwohner mit Dialysetherapie (Hämodialyse plus Peritonealdialyse) und 239 Patienten pro 1 Million Einwohner nach Nierentransplantation. | Die Prävalenz der chronischen Nierenersatztherapie in Deutschland beträgt 949 Patienten pro 1 Million Einwohner (Bericht über Dialysebehandlung und Nierentransplantation in Deutschland, QuaSiNiere, Dezember 2004), davon 710 Patienten pro 1 Million Einwohner mit Dialysetherapie (Hämodialyse plus Peritonealdialyse) und 239 Patienten pro 1 Million Einwohner nach Nierentransplantation. |
Ein Verweis auf die Quelle fehlt. Die angegebene Quelle enthält den Wortlaut nicht. |
|