von Dr. Alexej Dronov
Statistik und Sichtungsnachweis dieser Seite findet sich am Artikelende
| [1.] Ad/Fragment 069 01 - Diskussion Zuletzt bearbeitet: 2014-07-08 12:11:45 Hindemith | Ad, Bente 2003, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 69, Zeilen: 1 ff. (komplett) |
Quelle: Bente 2003 Seite(n): 55, 56, 57, Zeilen: 55: 6ff; 56: 1ff; 57: 1ff |
|---|---|
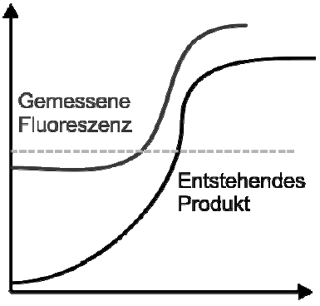
Abbildung 8: Relation der gemessenen Fluoreszenz zum entstehenden Produkt in einer real-time PCR. Während schon in den ersten Zyklen PCR-Produkte entstehen, reicht die dabei entstehende Fluoreszenz nicht aus, um ein messbares Signal zu erzeugen. Im Bereich der Basislinie kommt es immer zu leichten Schwankungen in der gemessenen Fluoreszenz. Diese beruhen auf Schwankungen der Fluoreszenz in der Probe (Abb.7). Es muss nun ein Punkt definiert werden, ab dem eine gemessene Fluoreszenz einer Probe klar von der Hintergrundfluoreszenz zu unterscheiden und als positiv zu werten ist. Hierfür wird ein Schwellenwert gesetzt (Threshold; Abbildung 7). Er stellt eine Trennlinie zur Unterscheidung zwischen signifikanter Zunahme der Fluoreszenz und der Hintergrundfluoreszenz dar. Er wird definiert als die Standardabweichung der Hintergrundfluoreszenz -gemessen zwischen Zyklus drei und 15- multipliziert mit dem Faktor 10. Der Schnittpunkt zwischen der Fluoreszenz und dem Schwellenwert projiziert auf die Abszisse wird als Zyklen-Schwellenwert (Cycle-threshold (CT)) bezeichnet und stellt den niedrigsten messbaren positiven Wert einer QRT-PCR dar. Der CT-Wert gibt also eine Zyklenanzahl an. Er steht in direkter Beziehung zur Ausgangsmenge der eingesetzten DNA. Ist der CT-Wert niedrig, ist die eingesetzte Menge DNA groß. Ist der CT-Wert hoch, so ist die Ausgangsmenge an DNA klein. Der CT-Wert ist daher Grundlage für die Quantifizierung einer Reaktion. Quantifizierung Die Quantitative PCR kann für verschiedene Anwendungen genutzt werden, wie z.B. das Monitoring der Genexpression oder die Bestimmung der Viruslast im Rahmen von [Pathogenesestudien (BUSTIN 2000; FREEMAN et al. 1999; HALFORD 1999; HEID et al. 1996).] |

Abbildung 2-18: Relation der gemessenen Fluoreszenz zum entstehenden Produkt in einer real-time PCR. Während schon in den ersten Zyklen PCR-Produkte entstehen, reicht die dabei entstehende Fluoreszenz nicht aus, um ein messbares Signal zu erzeugen. Im Bereich der Basislinie kommt es immer zu leichten Schwankungen in der gemessenen Fluoreszenz. Diese beruht auf Schwankungen der Fluoreszenz in der Probe (Abb. 2.16). Es muss nun ein Punkt definiert werden, ab dem eine gemessene Fluoreszenz einer Probe klar von der Hintergrundfluoreszenz zu unterscheiden und als positiv zu werten ist. Hierfür wird ein Schwellenwert gesetzt (Threshold; Abb. 2.16). Er stellt eine Trennlinie zur Unterscheidung zwischen signifikanter Zunahme der Fluoreszenz und der [Seite 56:] Hintergrundfluoreszenz dar. Er wird definiert als die Standardabweichung der Hintergrundfluoreszenz -gemessen zwischen Zyklus drei und 15- multipliziert mit dem Faktor 10. Der Schnittpunkt zwischen der Fluoreszenz und dem Schwellenwert projiziert auf die Abzisse wird als Cycle-threshold (CT) bezeichnet und stellt den niedrigsten messbaren positiven Wert einer QRT-PCR dar. Der CT-Wert gibt also eine Zyklenanzahl an. Er steht in direkter Beziehung zur Ausgangsmenge der eingesetzten DNA. Ist der CT-Wert niedrig, ist die eingesetzte Menge DNA groß. Ist der CT-Wert hoch, so ist die Ausgangsmenge an DNA klein. Der CT-Wert ist daher Grundlage für die Quantifizierung einer Reaktion (vgl. 2.3.8). [...] 2.3.8 Quantifizierung Die Quantitative PCR kann für verschiedene Anwendungen genutzt werden, wie z.B. das Monitoring der Genexpression oder die Bestimmung der Viruslast im Rahmen von [Seite 57:] Pathogenesestudien (BUSTIN 2000, FREEMAN et al. 1999, HALFORD 1999, HEID et al. 1996). |
Kein Hinweis auf die Quelle. |
|
Letzte Bearbeitung dieser Seite: durch Benutzer:Hindemith, Zeitstempel: 20140708121213