Cpk/Fragmente/Gesichtet_s
16 gesichtete, geschützte Fragmente: Plagiat
| [1.] Cpk/Fragment 024 07 - Diskussion Bearbeitet: 30. April 2016, 22:29 WiseWoman Erstellt: 8. February 2015, 22:11 (Hindemith) | Cpk, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung, Wikipedia Smith-Lemli-Opitz-Syndrom 2009 |
|
|
| Untersuchte Arbeit: Seite: 24, Zeilen: 7-12 |
Quelle: Wikipedia Smith-Lemli-Opitz-Syndrom 2009 Seite(n): 1 (Internetquelle), Zeilen: - |
|---|---|
| 2.5.3 Smith-Lemli-Opitz-Syndrom
Das Smith-Lemli-Opitz-Syndrom (SLOS), auch unter dem Synonym RSH-Syndrom (Opitz) bekannt, ist ein angeborenes autosomal-rezessiv vererbbares Fehlbildungs-Syndrom auf der Grundlage einer Genmutation. Typisch ist eine Stoffwechselstörung der Cholesterin- Biosynthese, bei dem eine verminderte Aktivität der 7-Hydroxysteroid-7-Sterol-Reduktase (DHCR7) besteht, wodurch es zu einem Mangel an Cholesterin kommt. |
Smith-Lemli-Opitz-Syndrom
Das Smith-Lemli-Opitz-Syndrom, auch unter dem Synonym RSH-Syndrom (Opitz) bekannt, ist ein angeborenes autosomal-rezessiv vererbbares Fehlbildungs-Syndrom auf der Grundlage einer Genmutation. Typisch ist eine Stoffwechselstörung der Cholesterin-Biosynthese, bei dem eine verminderte Aktivität der 7-Dehydrocholesterol-Reduktase (DHCR7) besteht, wodurch es zu einem Mangel an Cholesterin kommt. |
Ein Verweis auf die Quelle fehlt. |
|
| [2.] Cpk/Fragment 020 03 - Diskussion Bearbeitet: 30. April 2016, 22:28 WiseWoman Erstellt: 8. February 2015, 20:37 (Hindemith) | Cpk, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung, Wikipedia Down-Syndrom 2009 |
|
|
| Untersuchte Arbeit: Seite: 20, Zeilen: 1-6 |
Quelle: Wikipedia Down-Syndrom 2009 Seite(n): 1 (Internetquelle), Zeilen: - |
|---|---|
| Keiner dieser Marker genügt, um das Down-Syndrom zu diagnostizieren, auch dann nicht, wenn mehrere dieser Besonderheiten gleichzeitig auftreten. Die Wahrscheinlichkeit für ein Vorliegen des Down-Syndroms beim Feten erhöht sich zwar, aber eine eindeutige Diagnose ist nach heutigem Forschungsstand ausschließlich durch eine Untersuchung der Chromosomen selbst möglich, die üblicherweise durch Amniozentese oder Chorionzottenbiopsie, seltener durch Nabelschnurpunktion (Cordozentese) gewonnen werden (Sohn et al., 2001). | Keines dieser Hinweiszeichen genügt, um das Down-Syndrom zu diagnostizieren, auch dann nicht, wenn mehrere dieser Besonderheiten gleichzeitig auftreten. Die Wahrscheinlichkeit für ein Vorliegen des Down-Syndrom beim Baby erhöht sich dadurch zwar, aber eine eindeutige Diagnose ist nach heutigem Forschungsstand ausschließlich durch eine Untersuchung der Chromosomen selbst möglich, die üblicherweise durch Amniozentese oder Chorionzottenbiopsie, seltener durch Nabelschnurpunktion (Cordozentese) gewonnen werden. |
Die Wikipedia ist nicht als Quelle angegeben. Sohn et al. (2001) enthält die Textpassage offenbar so nicht. Die Formulierung wird professioneller als in der WP: Aus "Hinweiszeichen" werden "Marker", aus "Babys" werden "Feten". |
|
| [3.] Cpk/Fragment 019 19 - Diskussion Bearbeitet: 30. April 2016, 22:27 WiseWoman Erstellt: 8. February 2015, 20:19 (Hindemith) | Cpk, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung, Wikipedia Down-Syndrom 2009 |
|
|
| Untersuchte Arbeit: Seite: 19, Zeilen: 19-24 |
Quelle: Wikipedia Down-Syndrom 2009 Seite(n): 1 (Internetquelle), Zeilen: - |
|---|---|
| Im Zuge der sich stetig weiter entwickelnden Möglichkeiten in der Pränataldiagnostik sind mit der Zeit einige Besonderheiten dokumentiert worden, die vergleichsweise häufig bei Babys mit Down-Syndrom festgestellt werden. Zu den Auffälligkeiten, die insbesondere in Kombination miteinander auf das Vorliegen einer Trisomie 21 beim ungeborenen Kind hindeuten können, und die mitunter mittels Ultraschall- oder Blutuntersuchungen zu erkennen sind, zählen zum Beispiel: kardiale Vitien und der nicht immunulogische Hydrops fetalis, Wachstumsretardierung, Mikrozephalie, Hydrothorax, Omphalozele, vergleichsweise kurze Femuren oder Humeri, Sandalenlücke, weite Iliakalwinkel und Klinodaktylie. | Im Zuge der sich stetig weiter entwickelnden Möglichkeiten vorgeburtlicher Untersuchungen (Pränataldiagnostik) sind mit der Zeit einige Besonderheiten dokumentiert worden, die vergleichsweise häufig bei Babys mit Down-Syndrom festgestellt werden. Zu den Hinweiszeichen, die insbesondere in Kombination miteinander auf das Vorliegen einer Trisomie 21 beim ungeborenen Kind hindeuten können, und die mitunter mittels Ultraschall- oder Blutuntersuchungen zu erkennen sind, zählen zum Beispiel:
[...] |
Die Auffälligkeiten sind in der Wikipedia mit anderen Worten beschrieben. Die Wikipedia wird nicht genannt. |
|
| [4.] Cpk/Fragment 008 01 - Diskussion Bearbeitet: 30. April 2016, 22:25 WiseWoman Erstellt: 8. February 2015, 21:56 (Hindemith) | BauernOpfer, Cpk, Fragment, Gesichtet, SMWFragment, Sadler 2003, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 8, Zeilen: 1 ff. (komplett) |
Quelle: Sadler 2003 Seite(n): 205, Zeilen: 17 ff. |
|---|---|
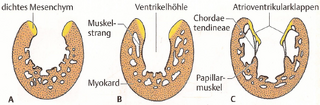
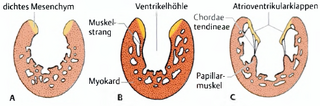
Abb. 2: Embryonale Entwicklung der atrioventrikulären Klappenstruktur (aus Sadler und Langman, 2003). 2.1.4 Pathogenese des atrioventrikulären Septumdefektes Die Endokardkissen im Atrioventrikularkanal unterteilen den Kanal nicht nur in ein rechtes und ein linkes Ostium, sondern nehmen auch an der Bildung des membranösen Anteils des Septum interventrikulare und am Verschluss des Ostium primum teil. Im Ultraschall stellt sich die Region als Kreuzstruktur dar, bei der das Septum im Vorhof und im Ventrikel den Längsbalken und die Endokardkissen im Atrioventrikularkanal den Querbalken bilden. Die regelrechte Darstellung der Kreuzstuktur [sic] im Ultraschallbild des Herzens ist ein wichtiges diagnostisches Zeichen. Wenn die Endokardkissen nicht regelrecht miteinander verschmelzen, führt dies zu einem persistierenden Atrioventrikularkanal, der mit einem Defekt in den Herzsepten kombiniert ist. |
Entwicklung der Atrioventrikularklappen
[...] Die Endokardkissen im Atrioventrikularkanal unterteilen den Kanal nicht nur in ein rechtes und in ein linkes Ostium, sondern nehmen auch an der Bildung des membranösen Anteils des Septum interventrikulare und am Verschluß des Ostium primum teil. Im Ultraschall stellt sich die Region als Kreuzstruktur dar, bei der das Septum im Vorhof und im Ventrikel den Längsbalken und die Endokardkissen im Atrioventrikularkanal den Querbalken bilden. Die regelrechte Darstellung der Kreuzstruktur im Ultraschallbild des Herzens ist ein wichtiges diagnostisches Zeichen (Abb. 12.23 C, S. 214). Wenn die Endokardkissen nicht regelrecht miteinander verschmelzen, führt dies zu einem persistierenden Atrioventrikularkanal, der mit einem Defekt in den Herzsepten kombiniert ist (Abb. 12.17 A). |
Die Quelle ist für die Abbildung genannt. Für den Text gibt es einen Verweis am Ende des Unterkapitels auf der nächsten Seite. Dieser Verweis macht aber nicht deutlich, dass die gesamte Seite weitgehend wörtlich aus der Quelle stammt. |
|
| [5.] Cpk/Fragment 018 01 - Diskussion Bearbeitet: 30. April 2016, 22:23 WiseWoman Erstellt: 8. February 2015, 20:10 (Hindemith) | Cpk, Fragment, Georgiadis 2008, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 18, Zeilen: 1 ff. (komplett) |
Quelle: Georgiadis 2008 Seite(n): 17, Zeilen: 11 ff. |
|---|---|
| [Typische Befunde sind hier bilateral pyramidenförmige (rechts-konfigurierte) Herzohren, komplexe Herzfehler (vorwiegend] Kombinationen von atrioventrikulärem Septumdefekt, Pulmonalatresie, ventrikulo-arterieller Diskordanz und Lungenvenenfehlmündung), bilateral dreigelappte (also rechts-konfigurierte) Lungen, eine bilateral rechts-konfigurierte Bronchialanatomie (der Hauptbronchus überkreuzt die Lungenarterie auf beiden Seiten), eine Asplenie und eine Juxtaposition von Aorta und Vena cava inferior auf der selben Seite der Wirbelsäule.
Malrotationen des Magen-Darm-Traktes und der Leber sind mit beiden klinischen Varianten assoziiert. (Lin et al., 2000b; Peoples et al., 1983; Rose et al., 1975; Winer-Muram und Tonkin, 1989). Auch der rechte Aortenbogen ist signifikant mit Heterotaxiesyndromen assoziiert. In einer fetalen Autopsie- Studie fanden Ho et al. (1991) rechte Aortenbögen bei 5 von 20 Herzen mit Linksisomerismus (nur eines davon mit Dextrokardie) und bei 5 von 10 Herzen mit Rechtsisomerismus (2 davon mit Dextrokardie). Ähnliche Zahlen wurden für die postnatale Periode veröffentlicht (Peoples et al., 1983; Rose et al., 1975). Bei Feten mit Links-Isomerismus ist die Mortalität in der Pränatalperiode am höchsten. Dies ist durch die häufige Assoziation mit einem kompletten Herzblock und dessen ungünstiger intrauteriner Prognose bedingt. In der Postnatalperiode hängt die Lebensqualität stark von den assoziierten Herzfehlern und deren Korrigierbarkeit ab. Im Gegensatz dazu ist die Mortalität bei Feten mit Rechts-Isomerismen in der Postnatalperiode am höchsten. Dies ist hauptsächlich auf die Schwere und die ungünstigen Kombinationen der assoziierten Herzfehler zurückzuführen. |
Typische Befunde sind hier bilateral pyramidenförmige (rechts-konfigurierte) Herzohren, komplexe Herzfehler (vorwiegend Kombinationen von atrioventrikulärem Septumdefekt, Pulmonalatresie, ventrikulo-arterieller Diskordanz und Lungenvenenfehlmündung), bilateral dreigelappte (also rechts-konfigurierte) Lungen, eine bilateral rechts-konfigurierte Bronchialanatomie (der Hauptbronchus überkreuzt die Lungenarterie auf beiden Seiten), eine Asplenie und eine Juxtaposition von Aorta und Vena cava inferior auf der selben Seite der Wirbelsäule.
Malrotationen des Magen-Darm-Traktes und der Leber sind mit beiden klinischen Varianten assoziiert (Lin et al., 2000; Peoples et al., 1983; Rose et al., 1975; Winer-Muram und Tonkin, 1989). Auch der rechte Aortenbogen ist signifikant mit Heterotaxie-Syndromen assoziiert. In einer fetalen Autopsie- Studie fanden Ho et al. (Ho et al., 1991) rechte Aortenbögen bei 5 von 20 Herzen mit Links-Isomerismus (nur eines davon mit Dextrokardie) und bei 5 von 10 Herzen mit Rechts-Isomerismus (2 davon mit Dextrokardie). Ähnliche Zahlen wurden für die postnatale Periode veröffentlicht (Peoples et al., 1983; Rose et al., 1975). Bei Feten mit Links-Isomerismus ist die Mortalität in der Pränatalperiode am höchsten. Dies ist durch die häufige Assoziation mit einem kompletten Herzblock und dessen ungünstiger intrauteriner Prognose bedingt. In der Postnatalperiode hängt die Lebensqualität stark von den assoziierten Herzfehlern und deren Korrigierbarkeit ab. Im Gegensatz dazu ist die Mortalität bei Feten mit Rechts-Isomerismen in der Postnatalperiode am höchsten. Dies ist hauptsächlich auf die Schwere und die ungünstigen Kombinationen der assoziierten Herzfehler zurückzuführen. |
Die Quelle ist nicht genannt. |
|
| [6.] Cpk/Fragment 007 01 - Diskussion Bearbeitet: 30. April 2016, 22:22 WiseWoman Erstellt: 8. February 2015, 21:42 (Hindemith) | BauernOpfer, Cpk, Fragment, Gesichtet, SMWFragment, Sadler 2003, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 7, Zeilen: 1 ff. (komplett) |
Quelle: Sadler 2003 Seite(n): 202, 203, Zeilen: 202: letzte Zeilen; 203: 1 ff. |
|---|---|
| [Oberes und unteres Kissen wölben sich] inzwischen weiter in das Lumen vor, verschmelzen miteinander und führen gegen Ende der 5. Woche zu einer vollständigen Unterteilung des Kanals in ein rechtes und ein linkes Ostium (Sadler und Langman, 2003)
Abb. 1: Embryonale Entwicklung der Endokardkissen im Atrioventrikularkanal (aus Sadler und Langman, 2003). 2.1.3 Bildung der Atrioventrikularklappen Nachdem durch die Verschmelzung der Endokardkissen der Atrioventrikularkanal in ein rechtes und linkes Ostium unterteilt worden ist, kommt es zu lokalisierten Mesenchymproliferationen um jedes Ostium herum (Abb. 2a). Anschließend werden diese Mesenchympolster auf der Ventrikelseite ausgehöhlt, so dass die neu gebildeten Klappen nur noch durch Muskelstränge mit der Ventrikelwand verbunden sind (Abb. 2b). Schließlich degeneriert das Muskelgewebe in den Strängen auf der Ventrikelseite der Klappen und wird durch dichtes Bindegewebe ersetzt. Die Klappen bestehen dann aus von Endokard überzogenem Bindegewebe und sind durch die Chordae tendineae über die aus verdickten Tabekeln [sic] bestehenden Papillarmuskeln in der Ventrikelwand befestigt (Abb. 2c). Auf diese Weise bilden sich im linken Ostium atrioventiculare [sic] zwei Klappensegel (Bikuspidal- oder Mitralklappe) und auf der rechten Seiten [sic] drei Klappensegel (Trikuspitalklappe [sic] ) aus (Sadler, 2003). |
Oberes und unteres Kissen wölben sich inzwischen weiter in das Lumen vor, verschmelzen miteinander und führen gegen Ende der 5. Woche zu einer vollständigen Unterteilung des Kanals in ein rechtes und ein linkes Ostium.
[Seite 203] [...] Abb. 12.13 A In der Reihenfolge von links nach rechts mit 23, 26, 31 und 35 Tagen. [...] Atrioventrikularklappen: Nachdem durch die Verschmelzung der Endokardkissen der Atrioventrikularkanal in ein rechtes und linkes Ostium unterteilt worden ist, kommt es zu lokalisierten Mesenchymproliferationen um jedes Ostium herum (Abb. 12.15 A). Anschließend werden diese Mesenchympolster auf der Ventrikelseite ausgehöhlt, so daß die neugebildeten Klappen nur noch durch Muskelstränge mit der Ventrikelwand verbunden sind (Abb. 12.15 B). Schließlich degeneriert das Muskelgewebe in den Strängen auf der Ventrikelseite der Klappen und wird durch dichtes Bindegewebe ersetzt. Die Klappen bestehen dann aus von Endokard überzogenem Bindegewebe und sind durch die Chordae tendineae über die aus verdickten Trabekeln bestehenden Papillarmuskeln in der Ventrikelwand befestigt (Abb. 12.15 C). Auf diese Weise bilden sich im linken Ostium atrioventriculare zwei Klappensegel (Bikuspidal- oder Mitralklappe) und auf der rechten Seite drei Klappensegel (Trikuspidalklappe) aus. |
Die Quelle ist zwar dreimal genannt, aber es wird trotzdem nicht deutlich, dass die gesamte Seite weitgehend wörtlich aus der Quelle stammt. |
|
| [7.] Cpk/Fragment 017 01 - Diskussion Bearbeitet: 30. April 2016, 22:19 WiseWoman Erstellt: 8. February 2015, 20:07 (Hindemith) | Cpk, Fragment, Georgiadis 2008, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 16, Zeilen: 1 ff. (komplett) |
Quelle: Georgiadis 2008 Seite(n): 16, 17, Zeilen: 16: Abbildung; 17: 1 ff. |
|---|---|

Abb. 10: Typische Befunde bei den beiden klinischen Varianten der Heterotaxie-Syndrome (LA, linker Vorhof; LHB, linker Hauptbronchus; LL, linke Lunge; RA, rechter Vorhof; RHB, rechter Hauptbronchus; RL, rechte Lunge) (Berg et al., 2006b). Bei Individuen mit Links-Isomerismus finden sich oft paarig angelegte linksseitige Organe, während rechtsseitige Organe fehlen können. Typische Befunde sind insbesondere bilateral fingerförmige (links-konfigurierte) Herzohren, Herzfehler (vorwiegend atrioventrikuläre Septumdefekte und Obstruktionen des rechtsventrikulären Ausflusstraktes), Fehlanlagen des Sinusknotens und des Reizleitungssystems mit konsekutivem Herzblock, bilateral zweigelappte (also links-konfigurierte) Lungen, eine bilateral links-konfigurierte Bronchialanatomie (der Hauptbronchus unterkreuzt die Lungenarterie auf beiden Seiten), eine Polysplenie und eine Fehlanlage des hepatischen Anteils der Vena cava inferior mit Rückfluss des Blutes zum Herzen über eine verbreiterte Vena azygos zur oberen Hohlvene. Im Gegensatz dazu finden sich bei Rechts-Isomerismen oft paarig angelegte rechtsseitige Organe, während linksseitige fehlen können. Typische Befunde sind hier bilateral pyramidenförmige (rechts-konfigurierte) Herzohren, komplexe Herzfehler (vorwiegend [Kombinationen von atrioventrikulärem Septumdefekt, Pulmonalatresie, ventrikulo-arterieller Diskordanz und Lungenvenenfehlmündung), bilateral dreigelappte (also rechts-konfigurierte) Lungen, eine bilateral rechts-konfigurierte Bronchialanatomie (der Hauptbronchus überkreuzt die Lungenarterie auf beiden Seiten), eine Asplenie und eine Juxtaposition von Aorta und Vena cava inferior auf der selben Seite der Wirbelsäule.] |

Abbildung 6: Typische Befunde bei den beiden klinischen Varianten der Heterotaxie-Syndrome (LA, linker Vorhof; LHB, linker Hauptbronchus; LL, linke Lunge; RA, rechter Vorhof; RHB, rechter Hauptbronchus; RL, rechte Lunge) Bei Individuen mit Links-Isomerismus finden sich oft paarig angelegte linksseitige Organe, während rechtsseitige Organe fehlen können. Typische Befunde sind insbesondere bilateral fingerförmige (links-konfigurierte) Herzohren, Herzfehler (vorwiegend atrioventrikuläre Septumdefekte und Obstruktionen des rechtsventrikulären Ausflusstraktes), Fehlanlagen des Sinusknotens und des Reizleitungssystems mit konsekutivem Herzblock, bilateral zweigelappte (also links-konfigurierte) Lungen, eine bilateral links-konfigurierte Bronchialanatomie (der Hauptbronchus unterkreuzt die Lungenarterie auf beiden Seiten), eine Polysplenie und eine Fehlanlage des hepatischen Anteils der Vena cava inferior mit Rückfluss des Blutes zum Herzen über eine verbreiterte Vena azygos zur oberen Hohlvene. Im Gegensatz dazu finden sich bei Rechts-Isomerismen oft paarig angelegte rechtsseitige Organe, während linksseitige fehlen können. Typische Befunde sind hier bilateral pyramidenförmige (rechts-konfigurierte) Herzohren, komplexe Herzfehler (vorwiegend Kombinationen von atrioventrikulärem Septumdefekt, Pulmonalatresie, ventrikulo-arterieller Diskordanz und Lungenvenenfehlmündung), bilateral dreigelappte (also rechts-konfigurierte) Lungen, eine bilateral rechts-konfigurierte Bronchialanatomie (der Hauptbronchus überkreuzt die Lungenarterie auf beiden Seiten), eine Asplenie und eine Juxtaposition von Aorta und Vena cava inferior auf der selben Seite der Wirbelsäule. |
Die Quelle ist nicht genannt. Die Abbildung kann man -- anders formatiert und angeordnet -- auch in der angegebenen Quelle finden. |
|
| [8.] Cpk/Fragment 016 01 - Diskussion Bearbeitet: 30. April 2016, 22:18 WiseWoman Erstellt: 8. February 2015, 20:02 (Hindemith) | Cpk, Fragment, Georgiadis 2008, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 16, Zeilen: 1 ff. (komplett) |
Quelle: Georgiadis 2008 Seite(n): 15, 16, Zeilen: 15: 12 ff.; 16: 1 ff. |
|---|---|
| 2.3 Heterotaxiesyndrome
Hinter dem bilateral symmetrischen Äußeren aller Primaten verbirgt sich eine ausgeprägte Asymmetrie im Körperinneren. Herz, Gefäßsystem, Lunge, Hirn sowie die unpaarigen Bauchorgane weisen eine charakteristische Asymmetrie zwischen rechter und linker Körperhälfte auf, die bei allen Primaten zur selben Organanordnung entlang der Links-Rechts-Achse führt (Fujinaga, 1997). Dieser Normalzustand wird als Situs solitus bezeichnet. Obwohl der Organaufbau des Embryos initial symmetrisch ist, beginnt bereits am 23. Lebenstag die Ausprägung der charakteristischen Körperasymmetrie mit der Rechtsdrehung des Herzschlauches. Mit der Windung des gesamten Embryos entlang der Längsachse gegen den Uhrzeigersinn beginnt dann auch die asymmetrische Verteilung der übrigen Organe (Kathiriya und Srivastava, 2000). In den letzten Jahren wurde eine Vielzahl von Genen identifiziert, die als Gen-Kaskade für die spezifische Organasymmetrie verantwortlich sind (Capdevila et al., 2000). Eine Störung dieser Kaskade führt zu einer veränderten Verteilung der Organe entlang der Links-Rechts-Achse, welche als Heterotaxie bezeichnet wird. Die Morphogenese des Herzens ist durch die komplexe Abfolge von rechts- bzw. linksgerichteten Verwindungen des Herzschlauches in besonderem Maße anfällig für Störungen entlang der Körperlängsachse. Daher sind Heterotaxie-Syndrome insbesondere mit Herzfehlern vergesellschaftet (Kathiriya und Srivastava, 2000). Heterotaxie-Syndrome haben eine geschätzte Inzidenz von 1 auf 10.000 Geburten (Lin et al., 2000b). Ihr Anteil in Kollektiven mit angeborenen Herzfehlern beträgt 2,2 – 4,2%, wobei hier die Mortalität innerhalb des ersten Lebensjahres 50% beträgt (Talner, 1998). Im klinischen Alltag bezeichnet der Begriff Heterotaxie einen Organsitus, der weder dem Situs solitus noch dem Situs inversus completus zugeordnet werden kann (Lin et al., 2000b). Der Begriff Situs ambiguus wird hierbei synonym gebraucht. Phänotypisch existieren zwei Hauptvarianten der Heterotaxie-Syndrome: Links-Isomerismus und Rechts-Isomerismus. Der Begriff Isomerismus bezeichnet hierbei die symmetrische Anlage normalerweise asymmetrischer Organe oder Organsysteme. Das assoziierte Fehlbildungsspektrum der Heterotaxie-Syndrome umfasst eine Vielzahl von kardiovaskulären und viszeralen Anomalien, die mit unterschiedlicher Häufigkeit bei Rechts-Isomerismus und Links-Isomerismus auftreten (Abb.10). |
2.4. Heterotaxie-Syndrome
Hinter dem bilateral symmetrischen Äußeren aller Primaten verbirgt sich eine ausgeprägte Asymmetrie im Körperinneren. Herz, Gefäßsystem, Lunge, Hirn sowie die unpaarigen Bauchorgane weisen eine charakteristische Asymmetrie zwischen rechter und linker Körperhälfte auf, die bei allen Primaten zur selben Organanordnung entlang der Links-Rechts-Achse führt (Fujinaga, 1997). Dieser Normalzustand wird als Situs solitus bezeichnet. Obwohl der Organaufbau des Embryos initial symmetrisch ist, beginnt bereits am 23. Lebenstag die Ausprägung der charakteristischen Körperasymmetrie mit der Rechtsdrehung des Herzschlauches. Mit der Windung des gesamten Embryos entlang der Längsachse gegen den Uhrzeigersinn beginnt dann auch die asymmetrische Verteilung der übrigen Organe (Kathiriya und Srivastava, 2000). In den letzten Jahren wurde eine Vielzahl von Genen identifiziert, die als Gen-Kaskade für die spezifische Organasymmetrie verantwortlich sind (Capdevila et al., 2000). Eine Störung dieser Kaskade führt zu einer veränderten Verteilung der Organe entlang der Links- Rechts-Achse, welche als Heterotaxie bezeichnet wird. Die Morphogenese des Herzens ist durch die komplexe Abfolge von rechts- bzw. linksgerichteten Verwindungen des Herzschlauches in besonderem Maße anfällig für Störungen entlang der Körperlängsachse. Daher sind Heterotaxie-Syndrome insbesondere mit Herzfehlern vergesellschaftet (Kathiriya und Srivastava, 2000). [Seite 16] Heterotaxie-Syndrome haben eine geschätzte Inzidenz von 1 auf 10.000 Geburten (Lin et al., 2000). Ihr Anteil in Kollektiven mit angeborenen Herzfehlern beträgt 2,2 – 4,2%, wobei hier die Mortalität innerhalb des ersten Lebensjahres 50% beträgt (Talner, 1998). Im klinischen Alltag bezeichnet der Begriff Heterotaxie einen Organsitus, der weder dem Situs solitus noch dem Situs inversus completus zugeordnet werden kann (Lin et al., 2000). Der Begriff Situs ambiguus wird hierbei synonym gebraucht. Phänotypisch existieren zwei Hauptvarianten der Heterotaxie-Syndrome: Links-Isomerismus und Rechts-Isomerismus. Der Begriff Isomerismus bezeichnet hierbei die symmetrische Anlage normalerweise asymmetrischer Organe oder Organsysteme. Das assoziierte Fehlbildungsspektrum der Heterotaxie-Syndrome umfasst eine Vielzahl von kardiovaskulären und viszeralen Anomalien, die mit unterschiedlicher Häufigkeit bei Rechts-Isomerismus und Links-Isomerismus auftreten (Abbildung 6). |
Die Quelle ist nicht genannt. |
|
| [9.] Cpk/Fragment 015 01 - Diskussion Bearbeitet: 30. April 2016, 21:58 WiseWoman Erstellt: 8. February 2015, 19:53 (Hindemith) | BauernOpfer, Berg et al 2007, Cpk, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 15, Zeilen: 1 ff. (komplett) |
Quelle: Berg et al 2007 Seite(n): 144, 145, Zeilen: 144: r. Spalte: 18 ff.; 145: Abb. 10 |
|---|---|
| 2.2.3 Echokardiographie beim atrioventrikulären Septumdefekt des Feten
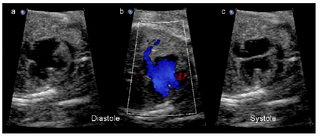
Atrioventrikuläre Septumdefekte (AVSD) sind mit 16-18% die am häufigsten pränatal diagnostizierten Herzfehler (Allan et al., 1994; Fesslova et al., 1999). Sie umfassen einen Septum primum Defekt, einen hoch liegenden Ventrikelseptumdefekt sowie eine gemeinsame Atrioventrikularklappe. Im Vierkammerblick fällt vor allem in der Diastole das fehlende Herzkreuz auf (Abb. 9a). In der Systole ist kein Versatz der Trikuspidalklappe nach apikal nachweisbar, daher wirkt die AV-Klappenebene wie eine durchgezogene Linie (Abb. 9c). In der Farbkodierung fällt in der Diastole über dem fehlenden Herzkreuz oft ein fusionierter Einfluss auf (Abb. 9b), während in der Systole häufig eine charakteristische mittig gelegene AV-Klappeninsuffizienz nachweisbar ist. Atrioventrikuläre Septumdefekte sind vor allem mit Aneuploidien (Trisomie 21 und 18), Heterotaxie-Syndromen (Berg et al., 2003) und komplexen Fehlbildungssyndromen assoziiert. Der isolierte atrioventrikuläre Septumdefekt ist selten (Birk und Silverman, 2003). Abb. 9a,b,c: Atrioventrikulärer Septumdefekt im Vier-Kammer-Blick. In der Diastole fällt im B-Bild (a) das fehlende Herzkreuz auf, in der Farbkodierung (b) der gemeinsame Einfluss (blau kodiert) in beide Ventrikel. In der Systole ist kein Versatz der Trikuspidalklappe nach apikal nachweisbar, daher wirkt die AV-Klappenebene wie eine durchgezogene Linie (c) (aus (Berg et al., 2007). |
Atrioventrikuläre Septum-Defekte (AVSD) sind mit 16–18% die am häufigsten pränatal diagnostizierten Herzfehler [20, 21]. Sie umfassen einen Septum-primum-Defekt, einen hochliegenden Ventrikelseptum-Defekt sowie eine gemeinsame AV-Klappe. Im 4KB fällt vor allem in der Diastole das fehlende Herzkreuz auf (> Abb. 10a). In der Systole ist kein Versatz der Trikuspidalklappe nach apikal nachweisbar, daher wirkt die AVKlappenebene wie eine durchgezogene Linie (> Abb. 10c). In der Farbkodierung fällt in der Diastole über dem fehlenden Herzkreuz oft ein fusionierter Einfluss auf (> Abb. 10b), während in der Systole häufig eine charakteristische mittig gelegene AV-Klappenregurgitation nachweisbar ist. Atrioventrikuläre Septum-Defekte sind vor allem mit Aneuploidien (Trisomie 21 und 18), Heterotaxie-Syndromen [14] und komplexen Fehlbildungssyndromen assoziiert. Der isolierte atrioventrikuläre Septum-Defekt ist selten [22].
[Seite 145] Abb. 10 a–c Atrioventrikulärer Septum-Defekt im Vier-Kammer-Blick. In der Diastole fällt im B-Bild a das fehlende Herzkreuz auf, in der Farbkodierung b der gemeinsame Einfluss (blau kodiert) in beide Ventrikel. In der Systole ist kein Versatz der Trikuspidalklappe nach apikal nachweisbar, daher wirkt die AV-Klappenebene wie eine durchgezogene Linie c. 14 Berg C, Geipel A, Smrcek J et al. Prenatal diagnosis of cardiosplenic syndromes: a 10-year experience. Ultrasound Obstet Gynecol 2003; 22: 451–459 20 Fesslova V, Nava S, Villa L. Evolution and long term outcome in cases with fetal diagnosis of congenital heart disease: Italian multicentre study. Fetal Cardiology Study Group of the Italian Society of Pediatric Cardiology. Heart 1999; 82: 594–599 21 Allan LD, Sharland GK, Milburn A et al. Prospective diagnosis of 1006 consecutive cases of congenital heart disease in the fetus. J Am Coll Cardiol 1994; 23: 1452–1458 22 Birk E, Silverman NH. Intracardiac shunt malformations. In: Yagel S, Silverman NH, Gembruch U (Hrsg). Fetal Cardiology. London: Martin Dunitz, 2003: 201–210 |
Die Quelle ist für die Abbildung genannt, nicht aber für den Text. |
|
| [10.] Cpk/Fragment 014 01 - Diskussion Bearbeitet: 30. April 2016, 21:56 WiseWoman Erstellt: 8. February 2015, 19:48 (Hindemith) | Cpk, Fragment, Georgiadis 2008, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 14, Zeilen: 1 ff. (komplett) |
Quelle: Georgiadis 2008 Seite(n): 11, 12, Zeilen: 11: 16 ff.; 12: 1 ff. |
|---|---|
| [Die Zuhilfenahme der farbkodierten Dopplersonographie (Abb. 8b)] unterstützt die Visualisierung und Beurteilung der einzelnen kardialen Strukturen im ersten Trimenon und verkürzt somit die Untersuchungszeit (Smrcek et al., 2006b). Die beiden häufigsten Indikationen zur frühen fetalen Echokardiographie betreffen Schwangerschaften mit familiärem Risiko und Feten mit einer erweiterten Nackentransparenz. Bei der erstgenannten Risikogruppe (Wiederholungsrisiko ca. 2-3%) geht es in erster Linie um die Beruhigung und Rückversicherung, dass eine weitestgehend normale kardiale Anatomie vorliegt. In der zweiten Risikogruppe steigt die Prävalenz von Herzfehlern mit zunehmender Nackentransparenz exponentiell an (Atzei et al., 2005). Sie lag bei euploiden Feten mit einer NT bis 3,4 mm (> 95. Perzentile) bei 1,8%, mit einer NT von 3,5-4,4 mm bei 3,5% und mit einer NT von 4,5-5,4 mm bei 6,4%. Damit ist die Prävalenz von Herzfehlern im Kollektiv der Feten mit einer NT > 3,5 mm höher als in Familien mit einer anamnestischen Belastung. Eine Trikuspidalinsuffizienz im ersten Trimenon (Abb. 8c) erhöht bei Feten mit erweiterter Nackentransparenz zusätzlich das Aneuploidierisiko und das Risiko für das vorliegen kardialer Vitien (Huggon et al., 2002).
Abb. 8a,b,c: Transvaginale Sonographie des Vier-Kammer-Blickes in der 11+0. SSW. Im B-Bild (a) kommen die beide Ventrikel, beide Vorhöfe, das intakte Ventrikelseptum und die deszendierende Aorta zur Darstellung (RV, rechter Ventrikel; RA, rechter Vorhof; LV, linker Ventrikel; LA, linker Vorhof). Die Farbdoppler-Sonographie (b) demonstriert in der Diastole den getrennten Einfluss (rot kodiert) in beide Ventrikel. Der Spektraldoppler der Trikuspidalklappe (c) zeigt im negativen Dopplerspektrum das physiologische Füllungsmuster des rechten Ventrikels mit e-Welle („early Diastole“ = passive Füllungsphase) und a-Welle (atriale Kontraktion = aktive Füllungsphase). Im positiven Dopplerspektrum ist der „Jet“ einer Trikuspidalregurgitation mit einer Maximalgeschwindigkeit von > 120 cm/s dargestellt (e, e-Welle; a, a-Welle; TI, Trikuspidalregurgitation) (aus Berg et al., 2007). |
Die Zuhilfenahme der farbkodierten Dopplersonographie (Abb. 5b) unterstützt die Visualisierung und Beurteilung der einzelnen kardialen Strukturen im ersten Trimenon und verkürzt somit die Untersuchungszeit (Smrcek et al., 2006). Die beiden häufigsten Indikationen zur frühen fetalen Echokardiographie betreffen Schwangerschaften mit familiärem Risiko und Feten mit einer erweiterten Nackentransparenz. Bei der erstgenannten Risikogruppe (Wiederholungsrisiko ca. 2-3%) geht es in erster Linie um die Beruhigung und Rückversicherung, dass eine weitestgehend normale kardiale Anatomie vorliegt. In der zweiten Risikogruppe steigt die Prävalenz von Herzfehlern mit zunehmender Nackentransparenz exponentiell an (Atzei et al., 2005). Sie lag bei euploiden Feten mit einer NT bis 3,4 mm (> 95. Perzentile) bei 1,8%, mit einer Nackentransparenz von 3,5-4,4 mm bei 3,5% und mit einer Nackentransparenz von 4,5-5,4 mm bei 6,4%. Damit ist die Prävalenz von Herzfehlern im Kollektiv der Feten mit einer Nackentransparenz > 3,5 mm höher als in Familien mit einer anamnestischen Belastung. Eine Trikuspidalinsuffizienz im ersten Trimenon (Abb. 5c) erhöht bei Feten mit erweiterter Nackentransparenz zusätzlich das Aneuploidierisiko und das Risiko für das vorliegen kardialer Vitien (Huggon et al., 2002).
[Seite 12] Abb. 5a,b,c: Transvaginale Sonographie des Vierkammerblickes in der 11+0. Schwangerschaftswoche. Im B-Bild (a) kommen beide Ventrikel, beide Vorhöfe, das intakte Ventrikelseptum und die deszendierende Aorta zur Darstellung (RV, rechter Ventrikel; RA, rechter Vorhof; LV, linker Ventrikel; LA, linker Vorhof). Die Farbdoppler-Sonographie (b) demonstriert in der Diastole den getrennten Einfluss (rot kodiert) in beide Ventrikel. Der Spektraldoppler der Trikuspidalklappe (c) zeigt im negativen Dopplerspektrum das physiologische Füllungsmuster des rechten Ventrikels mit e-Welle („early Diastole“ = passive Füllungsphase) und a-Welle (atriale Kontraktion = aktive Füllungsphase). Im positiven Dopplerspektrum ist der „Jet“ einer Trikuspidalregurgitation mit einer Maximalgeschwindigkeit von > 120 cm/s dargestellt (e, e-Welle; a, a-Welle; TI, Trikuspidalregurgitation) (aus Berg et al., 2007). |
Die Quelle ist nicht genannt. Der Text lässt sich auch in der Quelle Berg et al. (2007) finden, die für die Abbildung (aber nicht den Text) angegeben ist. Es ist unklar, ob Berg et al. (2007) oder Georgiadis (2008) letztendlich die herangezogene Quelle für diese Übernahme war, auch eine Einordnung als "Bauernopfer" ist daher denkbar. |
|
| [11.] Cpk/Fragment 013 01 - Diskussion Bearbeitet: 30. April 2016, 21:55 WiseWoman Erstellt: 8. February 2015, 19:10 (Hindemith) | Cpk, Fragment, Georgiadis 2008, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 13, Zeilen: 1 ff. (komplett) |
Quelle: Georgiadis 2008 Seite(n): 10, 11, Zeilen: 10: 12 ff.; 11: 1 ff. |
|---|---|
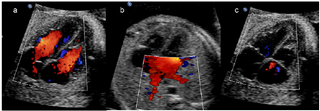
Abb. 7a,b,c: Farbdoppler-Echokardiographie des apikalen Vier-Kammer-Blickes. In der Diastole (a) lässt sich der getrennte Einfluss (rot kodiert) in beide Ventrikel darstellen. Bei niedrigen Pulsrepetitionsfrequenzen (b) kommen zusätzlich die in den linken Vorhof einmündenden Lungenvenen (rot kodiert) zur Darstellung. In der Systole (c) lässt sich kein Fluss über die Atrioventrikular-Klappen darstellen (aus Berg et al., 2007). Zirka 40-50% aller Herzfehler können unter optimalen Bedingungen (20.-22. Schwangerschaftswoche, trainierter Untersucher und gutes Equipment) im Vierkammerblick diagnostiziert werden (Berg et al., 2007). Auffälligkeiten im Vierkammerblick können den Herzrhythmus, die Herzgröße, die Lage des Herzens, die Herzachse, die Herzsepten, die Atrioventrikularklappen, die Ventrikelmorphologie und die Gefäße hinter dem Herzen betreffen. Zu den Anomalien, die nicht im Vierkammerblick entdeckt werden, gehören die Transpositionen und Malpositionen der großen Gefäße, Stenosen und Atresien der Semilunarklappen, hochsitzende Ventrikelseptumdefekte und Aortenbogenanomalien. Diese Herzanomalien können nur in den Ausflusstraktschnittebenen diagnostiziert werden, das heißt im Fünfkammer- beziehungsweise im Dreigefäßblick. Mit zunehmender Expertise der Untersucher und Benutzung von hochauflösenden Ultraschallgeräten ist die fetale Echokardiographie an ausgewählten Zentren zum festen Bestandteil der frühen Fehlbildungsdiagnostik geworden. Dabei hat sich der Untersuchungszeitraum zwischen 12+0 und 13+6 SSW als optimaler Zeitpunkt erwiesen. Die Untersuchung kann transabdominal oder transvaginal erfolgen (Smrcek et al., 2006b). Die transvaginale Untersuchungstechnik bietet zwar den Vorteil der besseren B-Bild Auflösung (Abb. 8a), hat aber den Nachteil der schlechteren Bewegungsfreiheit bei der Einstellung der verschiedenen Schnittebenen. |

Abb. 4a,b,c: Farbdoppler-Echokardiographie des apikalen Vierkammerblickes. In der Diastole (a) lässt sich der getrennte Einfluss (rot kodiert) in beide Ventrikel darstellen. Bei niedrigen Pulsrepetitionsfrequenzen (b) kommen zusätzlich die in den linken Vorhof einmündenden Lungenvenen (rot kodiert) zur Darstellung. In der Systole (c) lässt sich kein Fluss über die Atrioventrikular-Klappen darstellen (aus Berg et al., 2007). Zirka 40-50% aller Herzfehler können unter optimalen Bedingungen (20.-22. Schwangerschaftswoche, trainierter Untersucher und gutes Equipment) im Vierkammerblick diagnostiziert werden (Berg et al., 2007). [Seite 11] Auffälligkeiten im Vierkammerblick können den Herzrhythmus, die Herzgröße, die Lage des Herzens, die Herzachse, die Herzsepten, die Atrioventrikularklappen, die Ventrikelmorphologie und die Gefäße hinter dem Herzen betreffen. Zu den Anomalien, die nicht im Vierkammerblick entdeckt werden, gehören die Transpositionen und Malpositionen der großen Gefäße, Stenosen und Atresien der Semilunarklappen, hochsitzende Ventrikelseptumdefekte und Aortenbogenanomalien. Diese Herzanomalien können nur in den Ausflusstraktschnittebenen diagnostiziert werden, das heißt im Fünfkammer- beziehungsweise im Dreigefäßblick. Mit zunehmender Expertise der Untersucher und Benutzung von hochauflösenden Ultraschallgeräten ist die fetale Echokardiographie an ausgewählten Zentren zum festen Bestandteil der frühen Fehlbildungsdiagnostik geworden. Dabei hat sich der Untersuchungszeitraum zwischen 12+0 und 13+6 Schwangerschaftswochen als optimaler Zeitpunkt erwiesen. Die Untersuchung kann transabdominal oder transvaginal erfolgen (Smrcek et al., 2006). Die transvaginale Untersuchungstechnik bietet zwar den Vorteil der besseren B-Bild Auflösung (Abb. 5a), hat aber den Nachteil der schlechteren Bewegungsfreiheit bei der Einstellung der verschiedenen Schnittebenen. |
Die Quelle ist nicht genannt. Die Abbildung und Teile des Textes lassen sich auch in Berg et al. (2007) finden. Die Übernahme aus der dokumentierten Quelle ist aber wesentlich umfangreicher: daher keine Einordnung als Bauernopfer. |
|
| [12.] Cpk/Fragment 012 01 - Diskussion Bearbeitet: 30. April 2016, 21:53 WiseWoman Erstellt: 8. February 2015, 19:05 (Hindemith) | Cpk, Fragment, Georgiadis 2008, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 12, Zeilen: 1 ff. (komplett) |
Quelle: Georgiadis 2008 Seite(n): 9, 10, Zeilen: 9: 15 ff.; 10: 1 ff. |
|---|---|

Abb. 6a,b,c: Zweidimensionale Echokardiographie des apikalen Vier-Kammer-Blickes in drei unterschiedlichen Einstellungen. Die Übersicht (a) demonstriert die Größenverhältnisse im Thorax: die Herzachse ist 45°±15° nach links gekippt, 2/3 des Herzens liegen in der linken und 1/3 in der rechten Thoraxhälfte. Die Herzfläche nimmt 1/3 der Thoraxfläche ein. In der Zoom-Ansicht (b) können die anatomischen Details optimal beurteilt werden (das Herz sollte 30-50% des Bildausschnittes einnehmen). In der kaudalen Einstellung (c) kommt der Koronarsinus zur Darstellung (Berg et al., 2007). In der Farbkodierung lässt sich in der Diastole ein symmetrischer getrennter Einfluss in beide Ventrikel darstellen, die sich gleichmäßig füllen und durch das Ventrikelseptum getrennt sind (Abb. 7a). Auf der Vorhofebene kommt bei seitlicher Einstellung der Rechts-Links-Shunt über das Foramen ovale zur Darstellung. Bei optimaler Winkeleinstellung und Verwendung entsprechend niedriger Pulsrepetitionsfrequenzen lassen sich die vier von dorsal in den linken Vorhof einmündenden Lungenvenen darstellen (Abb. 7b). In der Systole sollte kein Rückfluss über die AV-Klappen in die Vorhöfe zur Darstellung kommen (Abb. 7c). Eine milde frühsystolische Trikuspidalinsuffizienz kommt allerdings bei bis zu 7 % der Feten im zweiten Trimenon vor. Dieser Befund ist meist transient und überwiegend als physiologisch zu werten (Gembruch, 1997; Gembruch und Smrcek, 1997). Eine Mitralregurgitation ist dagegen sehr selten physiologisch. |

Abb 3a,b,c: Zweidimensionale Echokardiographie des apikalen Vierkammerblickes in drei unterschiedlichen Einstellungen. Die Übersicht (a) demonstriert die Größenverhältnisse im Thorax: die Herzachse ist 45°±15° nach links gekippt, 2/3 des Herzens liegen in der linken und 1/3 in der rechten Thoraxhälfte. Die Herzfläche nimmt 1/3 der Thoraxfläche ein. In der Zoom-Ansicht (b) können die anatomischen Details optimal beurteilt werden (das Herz sollte 30-50% des Bildausschnittes einnehmen). In der kaudalen Einstellung (c) kommt der Koronarsinus zur Darstellung (aus Berg et al., 2007). [Seite 10] In der Farbkodierung lässt sich in der Diastole ein symmetrischer getrennter Einfluss in beide Ventrikel darstellen, die sich gleichmäßig füllen und durch das Ventrikelseptum getrennt sind (Abb. 4a). Auf der Vorhofebene kommt bei seitlicher Einstellung der Rechts-Links Shunt
|
Die Abbildung und der Text lassen sich auch in der für die Abbildung angegebenen Quelle Berg et al. (2007) finden. Die Übereinstimmung ist aber mit der dokumentierten Quelle größer: daher auch keine Einordnung als Bauernopfer. |
|
| [13.] Cpk/Fragment 011 01 - Diskussion Bearbeitet: 30. April 2016, 21:51 WiseWoman Erstellt: 8. February 2015, 18:54 (Hindemith) | Cpk, Fragment, Georgiadis 2008, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 11, Zeilen: 1 ff. (komplett) |
Quelle: Georgiadis 2008 Seite(n): , 8, 9, Zeilen: 8: 11 ff.; 9: 1 ff. |
|---|---|

Abb. 5: Einstellung der drei Haupt-Schnittebenen in der fetalen Echokardiographie (aus ISUOG, 2006). 2.2.2 Der Vierkammerblick Im Vierkammerblick (Abb. 6a) zeigt die Herzspitze nach links und die Herzachse ist 45° ± 15° nach links gekippt. Zwei Drittel des Herzens liegen in der linken Thoraxhälfte und das Herz nimmt rund ein Drittel der Thoraxfläche ein. Das Herz schlägt im Sinusrhythmus mit einer Frequenz von 110-160 Schlägen / Minute und einer 1:1 Überleitung zwischen Vorhöfen und Ventrikeln. Der rechte Ventrikel liegt thoraxwandnah, ist stärker trabekuliert und trägt im apikalen Teil das Moderatorband (Abb.6b). Der linke Ventrikel ist spitzenbildend und wirkt aufgrund seiner schwächeren Trabekulierung schlanker. Die Trikuspidalklappe inseriert etwas weiter apikal am Ventrikelseptum, während die Mitralklappe etwas weiter dorsal am Herzkreuz inseriert. Dieser Versatz des Klappenansatzes beträgt beim Feten 1 – 2 mm (Gembruch et al., 2006). Die einzige physiologische Kontinuitätsunterbrechung der Herzsepten findet sich im Bereich des Foramen ovale. Die Klappe des Foramen ovale inseriert am Septum primum und schlägt nach links. In den linken Vorhof münden von dorsal die Lungenvenen. Hinter dem Herzen findet sich nur ein Gefäß links von der Wirbelsäule und in unmittelbarer Nähe des linken Vorhofes quer angeschnitten: die Aorta descendens. Schallt man streng auf der Basis des Vierkammerblicks (d.h. kaudal), kommt in unmittelbarer Nähe und parallel zur Mitralklappe im linken Vorhof der Koronarsinus zur Darstellung (Abb.6c). Dieser bringt das sauerstoffarme koronarvenöse Blut zurück zum Herzen, „untertunnelt“ den linken Vorhof und mündet in den rechten Vorhof (Berg et al., 2007). |

Abb. 2: Einstellung der drei Haupt-Schnittebenen in der fetalen Echokardiographie (aus ISUOG, 2006) 2.2. Der Vierkammerblick Im Vierkammerblick (Abb. 3a) zeigt die Herzspitze nach links und die Herzachse ist 45° ± 15° nach links gekippt. Zwei Drittel des Herzens liegen in der linken Thoraxhälfte und das Herz nimmt rund ein Drittel der Thoraxfläche ein. Das Herz schlägt im Sinusrhythmus mit einer Frequenz von 110-160 Schlägen / Minute und einer 1:1 Überleitung zwischen Vorhöfen und Ventrikeln. [Seite 9] Der rechte Ventrikel liegt thoraxwandnah, ist stärker trabekuliert und trägt im apikalen Teil das Moderatorband (Abb. 3b). Der linke Ventrikel ist spitzenbildend und wirkt aufgrund seiner schwächeren Trabekulierung schlanker. Die Trikuspidalklappe inseriert etwas weiter apikal am Ventrikelseptum, während die Mitralklappe etwas weiter dorsal am Herzkreuz inseriert. Dieser Versatz des Klappenansatzes beträgt beim Feten 1 – 2 mm (Gembruch et al., 2006). Die einzige physiologische Kontinuitätsunterbrechung der Herzsepten findet sich im Bereich des Foramen ovale. Die Klappe des Foramen ovale inseriert am Septum primum und schlägt nach links. In den linken Vorhof münden von dorsal die Lungenvenen. Hinter dem Herzen findet sich nur ein Gefäß links von der Wirbelsäule und in unmittelbarer Nähe des linken Vorhofes quer angeschnitten: die Aorta descendens. Schallt man streng auf der Basis des Vierkammerblickes (d.h. kaudal), kommt in unmittelbarer Nähe und parallel zur Mitralklappe im linken Vorhof der Koronarsinus zur Darstellung (Abb. 3c). Dieser bringt das sauerstoffarme koronarvenöse Blut zurück zum Herzen, „untertunnelt“ den linken Vorhof und mündet in den rechten Vorhof (Berg et al., 2007). |
Die Quelle ist nicht genannt. Der gesamte Text (nicht aber die Abbildung und deren Unterschrift) ist auch in Berg et al. (2007) zu finden, die Übereinstimmung mit der dokumentierten Quelle ist aber etwas höher, daher auch keine Einordnung als Bauernopfer. |
|
| [14.] Cpk/Fragment 009 06 - Diskussion Bearbeitet: 30. April 2016, 21:49 WiseWoman Erstellt: 8. February 2015, 17:56 (Hindemith) | Cpk, Fragment, Georgiadis 2008, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 9, Zeilen: 6-12 |
Quelle: Georgiadis 2008 Seite(n): 7, Zeilen: 3 ff. |
|---|---|
| Im Vergleich zu den Kinder- und Ewachsenenkardiologen [sic] ist die fetale Echokardiographie in der Auswahl der Schnittebenen nicht durch den knöchernen Thorax oder durch die luftgefüllten Lungen begrenzt. Aus virtuell jeder Richtung kann das Herz eingeschallt werden und so wird verständlich, dass sich in den letzten Jahren eine ganze Vielzahl von Schnittebenen in der fetalen Echokardiographie herauskristallisiert hat.
Die drei wichtigsten Schnittebenen sind der Vierkammerblick, der Fünfkammerblick und der Dreigefäßblick (Abb. 4). |
Im Vergleich zu den Kinder- und Erwachsenenkardiologen ist die fetale Echokardiographie in der Auswahl der Schnittebenen nicht durch den knöchernen Thorax oder durch die luftgefüllten Lungen begrenzt. Aus virtuell jeder Richtung kann das Herz eingeschallt werden und so wird verständlich, dass sich in den letzten Jahren eine ganze Vielzahl von Schnittebenen in der fetalen Echokardiographie herauskristallisiert hat.
Die drei wichtigsten Schnittebenen sind der Vierkammerblick, der Fünfkammerblick und der Dreigefäßblick (Abb. 1). |
Fortsetzung auf der nächsten Seite. |
|
| [15.] Cpk/Fragment 010 01 - Diskussion Bearbeitet: 30. April 2016, 21:47 WiseWoman Erstellt: 8. February 2015, 18:46 (Hindemith) | Cpk, Fragment, Georgiadis 2008, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 10, Zeilen: 1 ff. (komplett) |
Quelle: Georgiadis 2008 Seite(n): 7 f., Zeilen: 7: 9 ff.; 8: 1 ff. |
|---|---|

Abb. 4: Die drei Haupt-Schnittebenen der fetalen Echokardiographie. Vierkammerblick a, Fünfkammerblick b, Dreigefäßblick c (aus Berg et al., 2007). Es ist empfehlenswert, die fetale Echokardiographie nicht am Herzen selbst zu beginnen, sondern am transabdominalen Querschnitt. Hier wird der abdominelle Situs festgelegt, nachdem anhand der Poleinstellung sowie der Stellung des kindlichen Rückens die Seitenzuordnung des Ultraschallbildes erfolgt ist. Unterschieden wird der Situs solitus, der Situs inversus und der Situs ambiguus. Beim physiologischen Situs solitus abdominalis sind Magen und deszendierende Aorta links der Wirbelsäule während Vena cava inferior, Portalsinus und Gallenblase rechts der Wirbelsäule zur Darstellung kommen. Die häufigste Situsanomalie in der Fetalperiode ist der Situs ambiguus (viszerokardiale Heterotaxie), ein Situs der sich weder dem Situs solitus noch dem Situs inversus zuordnen lässt. Von einem solchen Situs spricht man z.B. wenn sowohl der Magen als auch Portalsinus und Gallenblase rechts der Wirbelsäule zur Darstellung kommen. Der Situs ambiguus ist regelmäßig (>95%) mit Heterotaxiesyndromen und infolgedessen mit komplexen kardialen Vitien vergesellschaftet (Berg et al., 2003). Vom transabdominellen Querschnitt (möglichst von apikal) schwenkt man den Schallkopf nach kranial auf das kindliche Köpfchen zu. So wird zunächst die etwas schräg im Thorax befindliche Ebene des Vierkammerblicks aufgefunden und mit erneutem schwenken des Schallkopfes nach kranial der Fünfkammerblick und schließlich der Dreigefäßblick (Abb. 5). |

Abb. 1: Die drei Haupt-Schnittebenen der fetalen Echokardiographie. Vierkammerblick a, Fünfkammerblick b, Dreigefäßblick c. Es ist empfehlenswert, die fetale Echokardiographie nicht am Herzen selbst zu beginnen, sondern am transabdominalen Querschnitt. Hier wird der abdominelle Situs festgelegt, nachdem anhand der Poleinstellung sowie der Stellung des kindlichen Rückens die Seitenzuordnung des Ultraschallbildes erfolgt ist. Unterschieden wird der Situs solitus, der Situs inversus und der Situs ambiguus. Beim physiologischen Situs solitus abdominalis sind Magen und deszendierende Aorta links der Wirbelsäule, während Vena cava inferior, Portalsinus und Gallenblase rechts der Wirbelsäule zur Darstellung kommen. [Seite 8] Die häufigste Situsanomalie in der Fetalperiode ist der Situs ambiguus (viszerokardiale Heterotaxie), ein Situs, der sich weder dem Situs solitus, noch dem Situs inversus zuordnen lässt. Von einem solchen Situs spricht man z.B. wenn sowohl der Magen als auch Portalsinus und Gallenblase rechts der Wirbelsäule zur Darstellung kommen. Der Situs ambiguus ist regelmäßig (>95%) mit Heterotaxie-Syndromen und infolgedessen mit komplexen kardialen Vitien vergesellschaftet (Berg et al., 2003). Vom transabdominellen Querschnitt (möglichst von apikal) schwenkt man den Schallkopf nach kranial auf das kindliche Köpfchen zu. So wird zunächst die etwas schräg im Thorax befindliche Ebene des Vierkammerblickes aufgefunden und mit erneutem schwenken des Schallkopfes nach kranial der Fünfkammerblick und schließlich der Dreigefäßblick (Abb. 2). |
Den Text findet man auch in der Quelle Berg et al. (2007). Die Übereinstimmung mit der hier dokumentierten Quelle ist aber etwas höher. Interessanterweise findet man die Abbildung aber nicht in Berg et al. (2007). |
|
| [16.] Cpk/Fragment 006 14 - Diskussion Bearbeitet: 30. April 2016, 21:23 WiseWoman Erstellt: 8. February 2015, 21:22 (Hindemith) | BauernOpfer, Cpk, Fragment, Gesichtet, SMWFragment, Sadler 2003, Schutzlevel sysop |
|
|
| Untersuchte Arbeit: Seite: 6, Zeilen: 14-30 |
Quelle: Sadler 2003 Seite(n): 202, Zeilen: 17 ff. |
|---|---|
| 2.1.2 Unterteilung des Atrioventrikularkanals
Der Atrioventrikularkanal ist der eng gebliebene Teil des Herzschlauches zwischen dem Vorhof- und dem Kammerabschnitt. Bei der Ausbildung der Herzschleife wird er mit der Einflussbahn nach kranial und dorsal verlagert und liegt dann in einer etwas nach vorn geneigten Frontalebene hinter und über dem Ventrikelabschnitt. Am Ende der 4. Woche entwickeln sich ein oberes und ein unteres Endokardkissen im Atrioventrikularkanal. Zunächst öffnet sich der Atrioventrikularkanal nur in den primitiven linken Ventrikel und ist vom Bulbus cordis durch die Bulboventrikularfalte getrennt. Während der Unterteilung des Atrioventikularkanals [sic] muss sich die Spitze der Bulboventrikularfalte zurückbilden, damit der Blutstrom aus den Vorhöfen auch direkt in den primitiven rechten Ventrikel (den proximalen Abschnitt des Bulbus cordis) gelangen kann. Gegen Ende der 5. Woche reicht der hintere Ausläufer der Falte gerade bis zur Mitte der Ansatzfläche des oberen Endokardkissens und ragt sehr viel weniger vor als im vorhergehenden Stadium. Da der Atrioventrikularkanal sich gleichzeitig nach rechts ausweitet, besitzt der aus dem Vorhofbereich eintretende Blutstrom einen direkten Zugang zum primitiven linken und rechten Ventrikel. Zusätzlich zu den oberen und unteren Endokardkissen treten am rechten und linken Rand des Kanals laterale Atrioventrikularkissen auf (Abb. 1). |
Unterteilung des Atrioventrikularkanals
Der Atrioventrikularkanal ist der eng gebliebene Teil des Herzschlauches zwischen dem Vorhof- und dem Kammerabschnitt. Bei der Ausbildung der Herzschleife wird er mit der Einflußbahn nach kranial und dorsal verlagert und liegt dann in einer etwas nach vorn geneigten Frontalebene hinter und über dem Ventrikelabschnitt (Abb. 12.7). Am Ende der 4. Woche entwickeln sich ein oberes und ein unteres Endokardkissen im Atrioventrikularkanal. Zunächst öffnet sich der Atrioventrikularkanal nur in den primitiven linken Ventrikel und ist vom Bulbus cordis durch die Bulboventrikularfalte getrennt (Abb. 12.7). Während der Unterteilung des Atrioventrikularkanals muß sich die Spitze der Bulboventrikularfalte zurückbilden, damit der Blutstrom aus den Vorhöfen auch direkt in den primitiven rechten Ventrikel (den proximalen Abschnitt des Bulbus cordis) gelangen kann. Gegen Ende der 5. Woche reicht der hintere Ausläufer der Falte gerade bis zur Mitte der Ansatzfläche des oberen Endokardkissens und ragt sehr viel weniger vor als im vorhergehenden Stadium (Abb. 12.14). Da der Atrioventrikularkanal sich gleichzeitig nach rechts ausweitet, besitzt der aus dem Vorhofbereich eintretende Blutstrom einen direkten Zugang zum primitiven linken und rechten Ventrikel. Zusätzlich zu den oberen und unteren Endokardkissen treten am rechten und linken Rand des Kanals laterale Atrioventrikularkissen auf (Abb. 12.13 und 12.14). |
Auf der nächsten Seite, am Ende des Unterkapitels gibt es einen Verweis auf die Quelle. Dieser macht aber den Umfang und den wörtlichen Charakter der Übernahme nicht deutlich. |
|