Diese Zusammenstellung basiert auf Befunden einer laufenden Plagiatsanalyse (Stand: 2017-11-21) – es handelt sich insofern nicht um einen abschließenden Bericht. Zur weiteren Meinungsbildung wird daher empfohlen, den jeweiligen Stand der Analyse auf der Seite http://de.vroniplag.wikia.com/wiki/Mek zum Vergleich heranzuziehen.
Eine kritische Auseinandersetzung mit der Habilitationsschrift von Prof. Dr. Dr. Martin Ekkehard Keck: Neurobiologische Wirkmechanismen antidepressiver Therapieverfahren. Pharmakotherapie und repetitive transkranielle Magnetstimulation im Tiermodell
Habilitationsschrift, vorgelegt der Medizinischen Fakultät der Ludwig-Maximilians-Universität München. Jahr der Habilitation: 2003.1, 2
→ Kein Nachweis in der Deutsche Nationalbibliothek
→ Nachweis: Bibliotheksverbund Bayern
→ Nachweis: UB LMU München
→ 12. Dezember 2017: Süddeutsche Zeitung: „[D]ie Pressestelle der Universität [teilt] auf Nachfrage mit: ,Der Untersuchungsausschuss hat einen Verstoß gegen die Regeln der guten wissenschaftlichen Praxis festgestellt.ʻ Aber nach Prüfung der Ereignisse im Jahr 2003 und der individuellen Umstände, könne der Vorwurf grob fahrlässigen Verhaltens nicht erhoben werden.“
1 Im Lebenslauf der Dissertation 2005 (Universität Utrecht), S. 150, wird 2004 als Jahr der Habilitation angegeben.
2 Die Namen der lt. § 8 Abs. 1 S. 1 HabilO mind. drei Gutachter sind öffentlich nicht bekannt.
Der Barcode drückt den Anteil der Seiten aus, die Fremdtextübernahmen enthalten, nicht den Fremdtextanteil am Fließtext. Je nach Menge des übernommenen Textes werden drei Farben verwendet:
- schwarz: bis zu 50 % Fremdtextanteil auf der Seite
- dunkelrot: zwischen 50 % und 75 % Fremdtextanteil auf der Seite
- hellrot: über 75 % Fremdtextanteil auf der Seite
Weiße Seiten wurden entweder noch nicht untersucht oder es wurde nichts gefunden. Blaue Seiten umfassen Titelblatt, Inhaltsverzeichnis, Literaturverzeichnis, Vakatseiten und evtl. Anhänge, die in die Berechnung nicht einbezogen werden.
Der Barcode stellt den momentanen Bearbeitungsstand dar. Er gibt nicht das endgültige Ergebnis der Untersuchung wieder, da Untersuchungen im VroniPlag Wiki stets für jeden zur Bearbeitung offen bleiben, und somit kein Endergebnis existiert.
72 Seiten mit Plagiatstext
Seiten mit weniger als 50% Plagiatstext
17 Seiten: 080 014 086 037 128 172 048 007 067 069 034 019 044 017 010 023 022
Seiten mit 50%-75% Plagiatstext
12 Seiten: 012 013 021 071 085 121 030 045 035 047 068 070
Seiten mit mehr als 75% Plagiatstext
43 Seiten: 092 087 088 089 095 104 096 098 105 099 100 101 102 103 025 028 031 032 033 026 027 046 050 090 093 094 049 122 123 097 124 125 126 029 127 036 169 091 168 170 171 165 020
Vorbemerkungen
- Am 12. Mai 2016 berichtete die Süddeutsche Zeitung über einen „in einer anonymen E-Mail“ erhobenen Plagiatsvorwurf gegen die Habilitationsschrift des Direktors der Klinik am Max-Planck-Institut für Psychiatrie in München. (1) Der Bericht zitierte den Betroffenen mit der Aussage, er weise den Vorwurf wissenschaftlichen Fehlverhaltens „entschieden zurück“ und habe „dem Präsidenten der Max-Planck-Gesellschaft umgehend eine Stellungnahme zukommen lassen“ und die Universität um eine Prüfung der Vorwürfe gebeten.
- Eine Stellungnahme veröffentlichte am Folgetag auch das Max-Planck-Institut für Psychiatrie. (2)
- In einem am 22. Mai 2016 in der Süddeutschen Zeitung publizierten Leserbrief äußerte sich die Verfasserin der Dissertation Erhardt (2003) und schrieb darin u.a.:
„Die gemeinsam unter seiner [M.K.s] Anleitung erzielten Ergebnisse wurden von uns in den Jahren 2002 und 2004 mit Herrn K[...] als Erst- bzw. Letztautor in renommierten internationalen wissenschaftlichen Zeitschriften veröffentlicht. Es ist daher vollkommen klar, dass die darin verwendeten Daten ebenso das geistige Eigentum von Herrn K[...] sind.“ (3)
Frau Erhardt ist ebenfalls an der Klinik am Max-Planck-Institut beschäftigt. (4)
- Am 15. März 2017 zitierte das Fernsehmagazin Kontrovers auf der Homepage des Bayerischen Fernsehens auszugsweise aus einem Schreiben des Betroffenen an die Universität München, in dem dieser angab,
„dass die erwähnten Texte das Ergebnis gemeinsamer, von mir geleiteter Anstrengungen sind. Diese stellen die Ergebnisse einer Gemeinschaftsarbeit dar, welche als gemeinsame Textpassagen in die Dissertation [...] bzw. meine Habilitation [...] einfließen. Die identischen Textpassagen sind daher der allgemein akzeptierten und nicht anders zu bewerkstelligenden wissenschaftlichen Arbeitsweise meines Fachgebietes (hier explizit Grundlagenforschung) geschuldet.“ (5)
- Die unabhängige Analyse der Habilitationsschrift im VroniPlag Wiki wurde im Juni 2017 begonnen.
Kapitelübersicht
- Die Habilitationsschrift enthält zahlreiche wörtliche und sinngemäße Textübernahmen, die nicht als solche kenntlich gemacht sind. Als betroffen festgestellt wurden bisher (Stand: 21. November 2017) folgende Kapitel, die sich teilweise als vollständig, nahezu vollständig oder größtenteils übernommen erwiesen haben – siehe Klammervermerke:
- 1 EINLEITUNG
- 1.3 Kausale Therapiestrategien [Anf.] (S. 19-20): Seite 20 – [größtenteils (exkl. erste 3 Sätze)]
- 2 MATERIAL UND METHODEN [Anf.] (S. 25): Seite 25 – [vollständig]
- 2.1 Tiere und Tierhaltung (S. 25): Seite 25 – [vollständig]
- 2.2 Operative Eingriffe und allgemeiner experimenteller Ablauf
- 2.6 Morphinsensitivierung (S. 37): Seite 37 – [vollständig (wörtlich)]
- 2.13 Glukokortikoid- und Mineralokortikoid-Rezeptormessungen (S. 44-45): Seiten 44, 45
- 2.15 Histologie (S. 45-46): Seiten 45, 46 – [nahezu vollständig (exkl. letzten Satz)]
- 2.16 Zellkulturtechnik (S. 46-48): Seiten 46, 47
- 2.17 Substanzdetektion (S. 48-50): Seiten 48, 49, 50 – [größtenteils (exkl. 3 Sätze)]
- 2.18 Statistik (S. 50-51): Seite 50
- 3 MECHANISMEN DER DYSREGULATION DES HPA-SYSTEMS: TIERMODELLE
- 4 NEUROBIOLOGISCHE GRUNDLAGEN PHARMAKOLOGISCH-ANTIDEPRESSIVER BEHANDLUNGSSTRATEGIEN
- 4.2 Alprazolam und Temazepam
- 4.2.1 Ausgangspunkt und Fragestellung (S. 85): Seite 85 – [großteils (exkl. letzte 3 Sätze)]
- 4.2.2 Experimenteller Ansatz (S. 85-86): Seite 86
- 4.2.3 Verhaltenscharakterisierung: Wirkung von Alprazolam und Temazepam auf das Schwimmverhalten (S. 87): Seite 87 – [vollständig]
- 4.2.4 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von AVP im PVN und im Plasma (S. 88-91): Seiten 88, 89, 90, 91 – [vollständig]
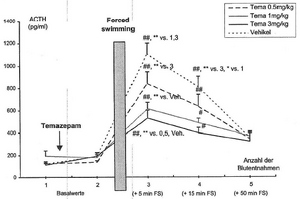
- 4.2.5 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von ACTH im Plasma (S. 92-93): Seiten 92, 93 – [vollständig]
- 4.2.6 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von Kortikosteron im Plasma (S. 93-94): Seiten 93, 94 – [vollständig (wörtlich)]
- 4.2.7 Wirkung von Alprazolam und Temazepam auf die ACTH-Sekretion in Rattenhypophysenzellkulturen (S. 94-95): Seiten 94, 95 – [vollständig (wörtlich)]
- 4.2.8 Diskussion [Anf.] (S. 96): Seite 96 – [vollständig]
- 4.2.8.1 Unterschiedliche Effekte von Triazolobenzodiazepinen und Benzodiazepinen? (S. 96-97): Seiten 96, 97 – [nahezu vollständig (exkl. einen Halbsatz)]
- 4.2.8.2 Beeinflussung der intrahypothalamischen Freisetzungsmuster von AVP durch Benzodiazepine [Anf.] (S. 97-98): Seiten 97, 98 – [vollständig]
- 4.2.8.2.1 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von AVP im Plasma (S. 99-100): Seiten 99, 100 – [vollständig]
- 4.2.8.2.2 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von ACTH und Kortikosteron im Plasma (HPA-Achse) (S. 100-102): Seiten 100, 101 – [nahezu vollständig (exkl. letzten Satz)]
- 4.2.8.2.3 Keine direkte Wirkung von Alprazolam und Temazepam auf die ACTH- Sekretion der Adenohypophyse (S. 102): Seite 102 – [vollständig]
- 4.2.8.2.4 Versuch eines erklärenden Gesamtmodells der Wirkung von Alprazolam und Temazepam im PVN (S. 102-105): Seiten 102, 103, 104, 105 – [vollständig]
- 5 NEUROBIOLOGISCHE GRUNDLAGEN DER rTMS
- 5.2 Auswirkungen der rTMS bei kommerziell erworbenen Ratten
- 5.2.1 Akute rTMS
- 5.2.1.1 Experimenteller Ansatz (S. 121): Seite 121
- 5.2.1.2 Wirkung auf die Freisetzung von Monoaminen [Anf.] (S. 121): Seite 121 – [vollständig (wörtlich)]
- 5.2.1.2.1 Intrazerebrale Dopaminfreisetzung nach akuter rTMS bei anästhesierten Ratten (S. 122-124): Seiten 122, 123, 124 – [nahezu vollständig (exkl. 1 Satz)]
- 5.2.1.2.2 Intrazerebrale Dopaminfreisetzung nach akuter rTMS bei wachen Ratten (S. 125-126): Seiten 125, 126 – [vollständig]
- 5.2.1.2.3 Intraaccumbale Dopaminfreisetzung nach akuter rTMS bei morphinvorbehandelten, wachen Tieren im Nucleus accumbens Shell (S. 126-128): Seiten 126, 127, 128 – [vollständig (wörtlich)]
- 5.4 Diskussion: Neurobiologische Wirkmechanismen der rTMS
- 5.4.3 Veränderungen der intrazerebralen Freisetzung von Neuromodulatoren und Neurotransmittern im ZNS
Die Quellen
- Die Habilitationsschrift wird vom Verfasser mit 2003 datiert. Die beiden dieser in umfangreichen Teilen u.a. zugrundeliegenden Dissertationen von Schindele und Erhardt stammen ebenfalls aus dem Jahr 2003. Diese zeitliche Nähe wirft die Frage nach der genauen Datierung der Arbeiten bzw. der Übernahmerichtung auf. Dazu lässt sich anhand der Arbeiten selbst sowie öffentlich verfügbarer Informationen sagen:
- Zur Dissertation Schindele (2003):
- Die jüngste Publikation in der Bibliographie stammt aus dem August 2002.
- Das Kapitel 4.2 Alprazolam und Temazepam (S. 85-105) der untersuchten Arbeit deckt sich zu großen Teilen mit in der Promotionsschrift enthaltenen Ausführungen. Die jüngste in diesem erwähnte Publikation stammt ebenfalls aus 2002. Sollte der Urheber der Ausführungen tatsächlich der Verfasser und nicht Schindele sein, stellte sich die Frage, warum Ersterer dort nicht auch – wie mehr als 50 Mal auf den übrigen gut 150 Seiten des Haupttextes seiner Arbeit – aktuelle Literatur aus 2003 aufgeführt hat, da er die Habilitationsschrift wahrscheinlich nicht vor dem 3. November 2003 eingereicht hat (siehe unten).
- Der Tag der mündlichen Prüfung wird mit dem 9. Oktober 2003 angegeben.
- Zur Dissertation Erhardt (2003):
- Die Abfassung ihres Lebenslaufs (S. 92 f.) datiert die Autorin auf „März 2003“.
- Als Tag der mündlichen Prüfung gibt sie den 15. Mai 2003 an.
- Zur Habilitationsschrift:
- Bei der Bibliographie fällt auf, dass die jüngste vom Verfasser aufgenommene Publikation aus dem Jahr 2003 mit „in press“ angegeben wird:
Müller, M.B., Uhr, M., Holsboer, F. & Keck, M.E. (2003b) Hypothalamic-pituitary-adrenocortical system and mood disorders: highlights from mutant mice. Neuroendocrinology, in press. [2004; 79: 1-12]
Diese Publikation wurde am 14. August 2003 beim Journal eingereicht und von diesem am 3. November 2003 akzeptiert; sie erschien im Januar 2004 (online am 2. Februar 2004).
Wenn man voraussetzt, dass Schindeles Dissertation nicht nach seiner mündlichen Prüfung am 9. Oktober 2003 und die Habilitationsschrift des Verfassers wegen der Angabe „in press“ – die man lege artis nur verwendet, wenn ein Titel bereits zur Veröffentlichung akzeptiert, aber noch nicht veröffentlicht wurde – bei Müller et al. (2003b) nicht vor dem 3. November 2003 eingereicht wurde, lagen zwischen der Abgabe der Dissertation und der Abgabe der Habilitationsschrift mindestens 25 Tage (möglicherweise aber auch erheblich mehr).
Der Verfasser kannte also wahrscheinlich – da er Mitbetreuer der Arbeit war (s.u.) – Schindeles Dissertation in ihrer Endfassung, bevor er die untersuchte Arbeit einreichte. - In der „Danksagung“ (S. 2) heißt es u.a.:
„Tobias Welt, Dr. Nicola Toschi und Dr. Angelika Erhardt danke ich sehr für ausdauernde - oft nächtelange - Mitarbeit und kritisch-konstruktives Hinterfragen unserer gemeinsamen Anstrengungen.“
Demnach war dem Verfasser die Promotion von Erhardt als bereits vollzogen bekannt. - Der Verfasser schreibt zudem im Lebenslauf seiner 2005 eingereichten Dissertation an der Universität Utrecht, dass er die Habilitation im November 2004 erlangt hat (S. 150).
- Bei der Bibliographie fällt auf, dass die jüngste vom Verfasser aufgenommene Publikation aus dem Jahr 2003 mit „in press“ angegeben wird:
- Schindele, dessen Dissertation (lt. dortiger S. 2) der Verfasser der untersuchten Habilitationsschrift mitbetreute, wird in dieser nirgends erwähnt. Auch die Dissertation Erhardts, die (lt. dortiger unnummerierter zweiter Seite) er ebenfalls mitbetreute, die Habilitationsschrift Engelmanns (2000), der Handbuchtext von Holsboer (1999) sowie fünf weitere, in geringerem Ausmaß als Übernahmequellen dokumentierte Texte bleiben ungenannt; nur für die psychopharmakologiehistorische Abhandlung Webers (1999) trifft dies nicht zu.
Insgesamt werden somit 9 von 10 bisher festgestellten Übernahmequellen nirgends angegeben.
Engelmann dankt er lediglich dafür, „mein kritisch-wissenschaftliches Denken nachhaltig und wohlmeinend“ gefördert zu haben; Holsboer u.a. „für wesentliche Anregungen“ und „die kritische wissenschaftliche Begleitung“.
- 5 von 10 Übernahmequellen wurden wie die untersuchte Arbeit als Qualifikationsschrift am Max-Planck-Institut für Psychiatrie, München, angefertigt. Für vier gilt dies nicht, ein MPI-Bezug besteht dennoch:
- Der Autor der Quelle Holsboer (1999) war von 1989 bis 2014 dessen Direktor. (6)
- Der Autor der Quelle Landgraf (2003) war dort Arbeitsgruppenleiter für Verhaltensneuroendokrinologie. (7)
- Die Co-Autorin der Quelle Ohl / Landgraf (2000) war lt. dortiger S. 268 Mitarbeiterin; sowohl Ohl als auch Landgraf dankt der Verfasser im Vorwort.
- Der Autor der Quelle Ströhle (2003) war lt. dortiger S. 279 ebenfalls Mitarbeiter am MPI.
Herausragende Fundstellen
- Mit wenigen Auslassungen nahezu vollständig übernommen ist aus Schindele (2003) im Teil 4 (Neurobiologische Grundlagen pharmakologisch-antidepressiver Behandlungsstrategien) der Inhalt des Kapitels 4.2 (Alprazolam und Temazepam) mit seinen zahlreichen Unterkapiteln (S. 85-105).
- Fragment 091 01: Identische Abbildungen in untersuchter Arbeit und Quelle, aber zum Teil unterschiedliche zugrundeliegende Stichprobengrößen stellen die Integrität der präsentierten Versuchsergebnisse in Frage.
- Mit wenigen Auslassungen nahezu vollständig übernommen ist aus Erhardt (2003) im Teil 5 (Neurobiologische Grundlagen der rTMS) der Inhalt des
- zum Kap. 5.2 (Auswirkungen der rTMS bei kommerziell erworbenen Ratten) gehörenden Unterkapitels 5.2.1 (Akute rTMS, S. 121-128)
- zum Kap. 5.4 (Diskussion: Neurobiologische Wirkmechanismen der rTMS) gehörenden Unterkapitels 5.4.3.3.1 (Dopaminfreisetzung im Nucleus accumbens bei morphinsensitivierten Ratten - rTMS als therapeutische Option im Drogenentzug?, S. 168-172).
Andere Beobachtungen
- Die Habilitation wurde mit dem vom Bayerischen Wissenschaftsministerium verliehenen Bayerischen Habilitationsförderpreis 2002 finanziell gefördert (Danksagung, S. 2; s.a. Deutsches Ärzteblatt, H. 42/2002 vom 18. Oktober 2002, S. A 2804 (PDF) sowie Bayerisches Ärzteblatt, Nr. 10/2002, S. 516 ("Der Förderpreis mit einer Förderungshöchstdauer von drei Jahren besteht aus einem monatlichen Stipendium von 2815 € und einem jährlichen Sachkostenzuschuss von bis zu 7700 €.") (PDF)).
- Dass „erstmalig die Wirkung zweier Benzodiazepine auf die mittels Mikrodialysetechnik gemessene Freisetzung von AVP aus den magnozellulären Neuronen des PVN untersucht“ worden sei, reklamieren sowohl der Verfasser der Habilitationsschrift wie auch Schindele (2003) in seiner Dissertation jeweils für sich; siehe Fragment 097 01.
- Bemerkenswert ist zudem, dass der Verfasser das Ziel der Habilitationsschrift seiner Quelle Engelmann (2000) als eines der Ziele seiner eigenen Arbeit ausgibt; siehe Fragment 021 29.
- Der Verfasser referenziert fast nur englischsprachige Quellen und führt solche im Literaturverzeichnis auf; die bisherigen Funde stammen aber ausschließlich aus deutschsprachigen Quellen.
- In mindestens 11 Fällen gibt der Verfasser als Nachweis für von ihm getätigte Aussagen Quellen an, mit denen sich diese (so) nicht belegen lassen:
- Fragment 012 28
- Fragment 013 16
- Fragment 014 01
- Fragment 017 22
- Fragment 020 01
- Fragment 022 25
- Fragment 023 03
- Fragment 030 12
- Fragment 047 01
- Fragment 071 05
- Fragment 080 03
- (Bei diesen Beobachtungen handelt es sich lediglich um Kollateraleffekte der Dokumentation; eine systematische Überprüfung des Referenzsystems der untersuchten Arbeit ist im Rahmen dieser Analyse nicht erfolgt.)
- Die zum Zeitpunkt der Einreichung der Habilitationsschrift gültige Habilitationsordnung für die Medizinische Fakultät der Ludwig-Maximilians-Universität München vom 19. August 1992, zuletzt geändert durch Satzung vom 12. Februar 1999 (PDF), enthält u.a. folgende Aussagen und Bestimmungen:
- § 2 Zulassungsvoraussetzungen und Antragsverfahren
„(2) [...] Bei Gemeinschaftsarbeiten muss der eigene Anteil durch einen ergänzenden Hinweis so dargelegt werden, dass er deutlich abgrenzbar und bewertbar ist.
(4) [...] Es ist eine Versicherung an Eides Statt über die Eigenständigkeit der schriftlichen Habilitationsleistung sowie eine Erklärung über die Vollständigkeit der Angabe der verwendeten Hilfsmittel abzugeben.“ - § 7 Schriftliche Habilitationsleistung
„(2) Die schriftliche Habilitationsleistung muss erkennen lassen, dass der Bewerber eine bedeutende wissenschaftliche Fragestellung in dem Fachgebiet, für das er die Habilitation anstrebt, selbständig entwickelt und umfassend bearbeitet hat.“
- § 2 Zulassungsvoraussetzungen und Antragsverfahren
Statistik
- Es sind bislang 90 gesichtete Fragmente dokumentiert, die als Plagiat eingestuft wurden. Bei 89 von diesen handelt es sich um Übernahmen ohne Verweis auf die Quelle („Verschleierungen“ oder „Komplettplagiate“). Bei einem Fragment ist die Quelle zwar angegeben, die Übernahme jedoch nicht ausreichend gekennzeichnet („Bauernopfer“).
- Die untersuchte Arbeit hat 174 Seiten im Hauptteil. Auf 72 dieser Seiten wurden bislang Plagiate dokumentiert, was einem Anteil von 41.4 % entspricht.
Die 174 Seiten lassen sich bezüglich des Textanteils, der als Plagiat eingestuft ist, wie folgt einordnen:
- Ausgehend von dieser Aufstellung lässt sich abschätzen, wieviel Text der untersuchten Arbeit gegenwärtig als plagiiert dokumentiert ist: Es sind, konservativ geschätzt, rund 25 % des Textes im Hauptteil der Arbeit.
- Die Dokumentation beinhaltet 12 Quellen.
- In der Dokumentation werden technisch bedingt auch die Quellen Padberg et al. (2003) und Wotjak (1996) als Plagiatsquelle mitgezählt, obwohl aus diesen nur Fragmente der Kategorie „Keine Wertung“ vorhanden sind. Insgesamt gibt es somit statt 12 lediglich 10 Quellen, aus denen als Plagiat gesichtete Fragmente vorliegen.
Illustration
Folgende Grafik illustriert das Ausmaß und die Verteilung der dokumentierten Fundstellen. Die Farben bezeichnen den diagnostizierten Plagiatstyp:
(grau=Komplettplagiat, rot=Verschleierung, gelb=Bauernopfer)
Die Nichtlesbarkeit des Textes ist aus urheberrechtlichen Gründen beabsichtigt.
Zum Vergrößern auf die Grafik klicken.
Textparallelen nach Quellen:
hellgrün = Droste (2003)
oliv = Engelmann (2000)
türkis = Erhardt (2003)
orange = Holsboer (1999)
hellrosa = Landgraf (2003)
hellgelb = Ohl / Landgraf (2000)
ockerbraun = Peller (2002)
violett = Schindele (2003)
dunkelblau = Ströhle (2003)
braun = Weber (1999)
Anmerkung: Die Grafiken repräsentieren den Analysestand vom 21. November 2017.
Definition von Plagiatkategorien
Die hier verwendeten Plagiatkategorien basieren auf den Ausarbeitungen von Wohnsdorf / Weber-Wulff: Strategien der Plagiatsbekämpfung, 2006. Eine vollständige Beschreibung der Kategorien findet sich im VroniPlag-Wiki. Die Plagiatkategorien sind im Einzelnen:
Übersetzungsplagiat
Ein Übersetzungsplagiat entsteht durch wörtliche Übersetzung aus einem fremdsprachlichen Text. Natürlich lässt hier die Qualität der Übersetzung einen mehr oder weniger großen Interpretationsspielraum. Fremdsprachen lassen sich zudem höchst selten mit mathematischer Präzision übersetzen, so dass jede Übersetzung eine eigene Interpretation darstellt. Zur Abgrenzung zwischen Paraphrase und Kopie bei Übersetzungen gibt es ein Diskussionsforum.
Komplettplagiat
Text, der wörtlich aus einer Quelle ohne Quellenangabe übernommen wurde.
Verschleierung
Text, der erkennbar aus fremder Quelle stammt, jedoch umformuliert und weder als Paraphrase noch als Zitat gekennzeichnet wurde.
Bauernopfer
Text, dessen Quelle ausgewiesen ist, der jedoch ohne Kenntlichmachung einer wörtlichen oder sinngemäßen Übernahme kopiert wurde.
Quellen nach Fragmentart
Die folgende Tabelle schlüsselt alle gesichteten Fragmente zeilenweise nach Quellen und spaltenweise nach Plagiatskategorien auf.
- ÜP = Übersetzungsplagiat,
- KP = Komplettplagiat,
- VS = Verschleierung,
- BO = Bauernopfer,
- KW = Keine Wertung,
- KeinP = Kein Plagiat.
| Quelle |
Jahr | ÜP |
KP |
VS |
BO |
KW |
KeinP |
∑ |
ZuSichten |
Unfertig |
|---|---|---|---|---|---|---|---|---|---|---|
| Droste | 2003 | 0 | 0 | 2 | 0 | 0 | 0 | 2 | 0 | 0 |
| Engelmann | 2000 | 0 | 0 | 11 | 0 | 2 | 0 | 13 | 0 | 0 |
| Erhardt | 2003 | 0 | 13 | 10 | 0 | 1 | 0 | 24 | 0 | 0 |
| Holsboer | 1999 | 0 | 0 | 11 | 0 | 1 | 0 | 12 | 0 | 0 |
| Landgraf | 2003 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 2 | 0 |
| Ohl Landgraf | 2000 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 |
| Padberg et al | 2003 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 0 |
| Peller | 2002 | 0 | 0 | 2 | 0 | 0 | 0 | 2 | 0 | 0 |
| Schindele | 2003 | 0 | 14 | 22 | 0 | 0 | 0 | 36 | 0 | 0 |
| Ströhle | 2003 | 0 | 0 | 2 | 0 | 0 | 0 | 2 | 0 | 0 |
| Weber | 1999 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 |
| Wotjak | 1996 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 |
| ∑ | - | 0 | 27 | 62 | 1 | 4 | 0 | 94 | 8 | 0 |
Fragmentübersicht
90 gesichtete, geschützte Fragmente
| Fragment | SeiteArbeit | ZeileArbeit | Quelle | SeiteQuelle | ZeileQuelle | Typus |
|---|---|---|---|---|---|---|
| Mek/Fragment 007 19 | 7 | 19-22 | Holsboer 1999 | 287 | re. Sp. 9 ff. | Verschleierung |
| Mek/Fragment 010 10 | 10 | 10-13 | Ströhle 2003 | 280 | 51 ff. | Verschleierung |
| Mek/Fragment 012 02 | 12 | 02-10, 20-27 | Weber 1999 | 153, 171, 172 | 153: 18-20; 171: 15-23; 172: 35-42 | BauernOpfer |
| Mek/Fragment 012 28 | 12 | 28-33 | Holsboer 1999 | 294 | re. Sp. 20 ff. | Verschleierung |
| Mek/Fragment 013 16 | 13 | 16-17, 22-29 | Ströhle 2003 | 283, 284 | 283: 24 f.; 284: 01 ff. | Verschleierung |
| Mek/Fragment 013 17 | 13 | 17-22 | Holsboer 1999 | 294 | re. Sp. 28 ff. | Verschleierung |
| Mek/Fragment 014 01 | 14 | 01-10 | Holsboer 1999 | 296 | li. Sp. 12 ff. | Verschleierung |
| Mek/Fragment 017 15 | 17 | 15-17 | Landgraf 2003 | 274, 275 | 274: re. Sp. 29-31; 275: mittl. Sp. 01 | Verschleierung |
| Mek/Fragment 017 22 | 17 | 22-26 | Ohl Landgraf 2000 | 265 | li. Sp. 10 ff. | Verschleierung |
| Mek/Fragment 019 06 | 19 | 06-08 | Engelmann 2000 | 011 | 28-33 | Verschleierung |
| Mek/Fragment 020 01 | 20 | 01-18; 20-23; 29-32 | Holsboer 1999 | 274, 285, 297, 299 | 274: rechte Spalte 3 ff.; 285: linke Spalte 01 ff.; 297: linke Spalte 34 ff.; 299: linke Spalte 11 ff. | Verschleierung |
| Mek/Fragment 021 01 | 21 | 01-07 | Holsboer 1999 | 299 | 31-41 | Verschleierung |
| Mek/Fragment 021 19 | 21 | 19-25 | Holsboer 1999 | 294 | re. Sp. 37 ff. | Verschleierung |
| Mek/Fragment 021 29 | 21 | 29-32 | Engelmann 2000 | 012 | 25-28 | Verschleierung |
| Mek/Fragment 022 25 | 22 | 25-31 | Peller 2002 | 007-008 | 007: 19-21; 008: 06-11 | Verschleierung |
| Mek/Fragment 023 03 | 23 | 03-06 | Peller 2002 | 007 | 21-25 | Verschleierung |
| Mek/Fragment 025 01 | 25 | 01-12 | Engelmann 2000 | 002, 016 | 002: 19-28; 016: 01-05 | Verschleierung |
| Mek/Fragment 025 13 | 25 | 13-15, 20-30 | Schindele 2003 | 29 | 02-04, 05-12 | Verschleierung |
| Mek/Fragment 025 15 | 25 | 15-20 | Erhardt 2003 | 020 | 07-12 | Verschleierung |
| Mek/Fragment 026 03 | 26 | 03-31 | Schindele 2003 | 033-034 | 033:06-26; 034:01-07 | KomplettPlagiat |
| Mek/Fragment 027 01 | 27 | 01-07, 10-21 | Schindele 2003 | 031, 034 | 031: 01-16; 034: 07-10 | Verschleierung |
| Mek/Fragment 028 00 | 28 | Abb. 1 | Erhardt 2003 | 022 | 04 | KomplettPlagiat |
| Mek/Fragment 028 01 | 28 | 01 ff. (komplett) | Schindele 2003 | 031, 032 | 031:19-21,23-26; 032:01-13 | Verschleierung |
| Mek/Fragment 029 01 | 29 | 01-12 | Schindele 2003 | 32 | 13-20 | KomplettPlagiat |
| Mek/Fragment 030 12 | 30 | 12-30 | Schindele 2003 | 034-037 | 034:18-22; 035:01-18; 036:01-25; 037:01-02 | Verschleierung |
| Mek/Fragment 031 01 | 31 | 01-03 | Schindele 2003 | 37 | 02-04 | KomplettPlagiat |
| Mek/Fragment 031 05 | 31 | 05-31 | Erhardt 2003 | 20-21, 27 | 20:22-28; 21: 06-08; 027:04-22 | KomplettPlagiat |
| Mek/Fragment 032 01 | 32 | 01-31 | Erhardt 2003 | 021 + 028 | 021:07-10; 028:01ff. | KomplettPlagiat |
| Mek/Fragment 033 00 | 33 | 00 | Erhardt 2003 | 029 | 00 | KomplettPlagiat |
| Mek/Fragment 033 02 | 33 | 02-03, 04-12 | Engelmann 2000 | 018 | 01-15 | Verschleierung |
| Mek/Fragment 034 01 | 34 | 01-14, 15-17 | Engelmann 2000 | 018 | 09-11, 15-17, 20-29 | Verschleierung |
| Mek/Fragment 035 13 | 35 | 13-30 | Schindele 2003 | 038 | 01-21 | Verschleierung |
| Mek/Fragment 036 01 | 36 | 01-05 | Schindele 2003 | 038 | 21-25 | KomplettPlagiat |
| Mek/Fragment 036 06 | 36 | 06-24 | Engelmann 2000 | 014, 016, 017 | 014: 13, 15, 16; 016: 23-25; 017: 01-15 | Verschleierung |
| Mek/Fragment 037 12 | 37 | 12-22 | Erhardt 2003 | 023 | 03-16 | KomplettPlagiat |
| Mek/Fragment 044 21 | 44 | 21-25, 29-30 | Droste 2003 | 048 | 03-09, 22-25 | Verschleierung |
| Mek/Fragment 045 05 | 45 | 01-02, 05-12 | Droste 2003 | 048-050 | 048: 23-26: 049: 17-19; 050: 04-06, 09-14 | Verschleierung |
| Mek/Fragment 045 24 | 45 | 24-29 | Schindele 2003 | 041 | 19-25 | Verschleierung |
| Mek/Fragment 046 01 | 46 | 01-08, 11-17 | Schindele 2003 | 042, 045 | 042:01-09; 045:09-19 | KomplettPlagiat |
| Mek/Fragment 046 10 | 46 | 10-11 | Erhardt 2003 | 030 | 01-02 | Verschleierung |
| Mek/Fragment 047 01 | 47 | 01-17 | Schindele 2003 | 045-046 | 045:18-22; 046:01 ff. | KomplettPlagiat |
| Mek/Fragment 048 15 | 48 | 15-18, 21-31 | Schindele 2003 | 044 | 02-25 | Verschleierung |
| Mek/Fragment 049 01 | 49 | 01-11 | Schindele 2003 | 044 | 15-25 | KomplettPlagiat |
| Mek/Fragment 049 15 | 49 | 15-31 | Erhardt 2003 | 033-034 | 033:23-29; 034:01-06 | KomplettPlagiat |
| Mek/Fragment 050 01 | 50 | 01-15 | Erhardt 2003 | 034-035 | 034:12-22; 035:01-04 | KomplettPlagiat |
| Mek/Fragment 050 16 | 50 | 16-21; 27-31 | Schindele 2003 | 047 | 01 ff. | Verschleierung |
| Mek/Fragment 067 09 | 67 | 09-14 | Engelmann 2000 | 060 | 15-20 | Verschleierung |
| Mek/Fragment 068 12 | 68 | 12-20, 23-24 | Holsboer 1999 | 295-297 | 295: rechtes Spalte, 30-22, 296: linke Spalte, 01-02+62-69; rechte Spalte, 08 ff.; 297: linke Spalte, 29-33 | Verschleierung |
| Mek/Fragment 068 26 | 68 | 26-33 | Engelmann 2000 | 033, 050 | 033: 03-06, 10-14; 050: 19-22 | Verschleierung |
| Mek/Fragment 069 02 | 69 | 02-07, 11-16 | Engelmann 2000 | 006, 007, 033, 051 | 006: 08-12; 007: 01-03; 033: 14-21; 051: 13-16 | Verschleierung |
| Mek/Fragment 070 08 | 70 | 08-15 | Holsboer 1999 | 299 | rechte Spalte, 12ff | Verschleierung |
| Mek/Fragment 070 21 | 70 | 21-30 | Engelmann 2000 | 089, 094 | 089: 04-10; 094: 08-15 | Verschleierung |
| Mek/Fragment 071 05 | 71 | 05-16 | Holsboer 1999 | 303 | li. Sp. 21 ff., re. Sp. 1 ff. | Verschleierung |
| Mek/Fragment 080 03 | 80 | 03-10 | Holsboer 1999 | 274 | re. Sp. 03 ff. | Verschleierung |
| Mek/Fragment 085 03 | 85 | 03-18 | Schindele 2003 | 011; 026 | 011:03-07,13-21; 026:02-07 | Verschleierung |
| Mek/Fragment 086 05 | 86 | 05-17 | Schindele 2003 | 040-041 | 040: Abbildung; 041:01-13 | Verschleierung |
| Mek/Fragment 087 01 | 87 | 01-12 | Schindele 2003 | 049-050 | 049:02-03, 06-07; 050:01-04, 07-08, 11; 051:01 | Verschleierung |
| Mek/Fragment 088 01 | 88 | 01 ff. (komplett) | Schindele 2003 | 051-054 | 051:07-13; 052:13-20; 053:13-20; 054:07-08 | Verschleierung |
| Mek/Fragment 089 01 | 89 | 01-08 | Schindele 2003 | 052 | 03-10 | KomplettPlagiat |
| Mek/Fragment 090 01 | 90 | 01-08 | Schindele 2003 | 053 | 03-12 | KomplettPlagiat |
| Mek/Fragment 091 01 | 91 | 01-06 | Schindele 2003 | 054-055 | 054:06-11; 055: Abbildung 3.6 | KomplettPlagiat |
| Mek/Fragment 092 01 | 92 | 1 ff. (komplett) | Schindele 2003 | 056-058 | 056:01-17; 057:01-20; 058:01-09 | Verschleierung |
| Mek/Fragment 093 01 | 93 | 01 ff. (komplett) | Schindele 2003 | 056, 058-060 | 056:08-14; 058:12-13; 059:09-15; 060:09-12 | KomplettPlagiat |
| Mek/Fragment 094 01 | 94 | 01 ff. (komplett) | Schindele 2003 | 057, 062 | 057:07-14; 062:01-12 | KomplettPlagiat |
| Mek/Fragment 095 01 | 95 | 01 ff. (komplett) | Schindele 2003 | 062-063 | 062:Tab. 3.1; 063:01-06 | KomplettPlagiat |
| Mek/Fragment 096 04 | 96 | 04-10, 13-26, 28-29 | Schindele 2003 | 065, 066, 076 | 065: 02-09, 16-22; 066: 01-02; 076: 05-12 | Verschleierung |
| Mek/Fragment 097 01 | 97 | 01-16, 19-29 | Schindele 2003 | 066-069, 076 | 066: 01-08; 067: 03-09; 068: 05-08; 069: 04-08; 076: 16-20, 26-28 | Verschleierung |
| Mek/Fragment 098 01 | 98 | 01 ff. (komplett) | Schindele 2003 | 067-069 | 067:09-18; 068:01-04; 069:09-12, 15-22 | Verschleierung |
| Mek/Fragment 099 01 | 99 | 01 ff. (komplett) | Schindele 2003 | 070-071 | 070:01 ff.; 071:01-11 | Verschleierung |
| Mek/Fragment 100 01 | 100 | 01 ff. (komplett) | Schindele 2003 | 071-073 | 071:9-17; 072:01ff.; 073:01-10 | Verschleierung |
| Mek/Fragment 101 01 | 101 | 01 ff. (komplett) | Schindele 2003 | 073, 074 | 073:09-33, 074:01 + 05-08 + 13-21 | Verschleierung |
| Mek/Fragment 102 03 | 102 | 03-28 | Schindele 2003 | 075, 077 | 075:01ff.; 077:01-05 | Verschleierung |
| Mek/Fragment 103 01 | 103 | 01-25, 29-31 | Schindele 2003 | 077-078 | 077: 06-30; 078: 01-02 | Verschleierung |
| Mek/Fragment 103 25 | 103 | 25-29 | Engelmann 2000 | 051 | 24-28 | Verschleierung |
| Mek/Fragment 104 01 | 104 | 01 ff. (komplett) | Schindele 2003 | 078 | 03-27 | Verschleierung |
| Mek/Fragment 105 01 | 105 | Abb. 22 | Schindele 2003 | 079 | Abb. 4.2 | KomplettPlagiat |
| Mek/Fragment 121 09 | 121 | 09-24 | Erhardt 2003 | 023, 044 | 023:03-16; 044:02-05 | KomplettPlagiat |
| Mek/Fragment 122 01 | 122 | 01 ff. (komplett) | Erhardt 2003 | 044-045 | 044:06-11; 045:01-06 | KomplettPlagiat |
| Mek/Fragment 123 01 | 123 | 01-15, 18-31 | Erhardt 2003 | 044,046-047 | 044:12-26; 046:06-15; 047:06-09 | Verschleierung |
| Mek/Fragment 124 01 | 124 | 01 ff. (komplett) | Erhardt 2003 | 046-048 | 046:01-05; 047:01-05; 047: 8-16; 048: 01-07 | Verschleierung |
| Mek/Fragment 125 01 | 125 | 01 ff. (komplett) | Erhardt 2003 | 048-050 | 048:08-14; 049:01-08; 050:01-12 | Verschleierung |
| Mek/Fragment 126 01 | 126 | 01-12 | Erhardt 2003 | 049-051 | 049:09-11; 050:13-17; 051:01-11 | KomplettPlagiat |
| Mek/Fragment 127 01 | 127 | 01 ff. (komplett) | Erhardt 2003 | 051-054 | 051:06-11; 052:01-09; 053:01-07; 054:01-05 | KomplettPlagiat |
| Mek/Fragment 128 01 | 128 | 01-07 | Erhardt 2003 | 051 | 13-17 | KomplettPlagiat |
| Mek/Fragment 165 01 | 165 | 01 ff. (komplett) | Erhardt 2003 | 005-006; 060-061 | 005:27-31; 006:04-08; 060:11-30; 061:01-05 | Verschleierung |
| Mek/Fragment 168 02 | 168 | 02-33 | Erhardt 2003 | 067-068 | 067:04-32; 068:01-14 | KomplettPlagiat |
| Mek/Fragment 169 01 | 169 | 01 ff. (komplett) | Erhardt 2003 | 068-069 | 068:14-33; 069:01-14 | Verschleierung |
| Mek/Fragment 170 01 | 170 | 01 ff. (komplett) | Erhardt 2003 | 069-070 | 069:22-32; 070:01-31 | Verschleierung |
| Mek/Fragment 171 01 | 171 | 01 ff. (komplett) | Erhardt 2003 | 070-072 | 070:31-33; 071:01-33; 072:01-04 | Verschleierung |
| Mek/Fragment 172 01 | 172 | 01-07 | Erhardt 2003 | 072 | 03-11 | Verschleierung |
Textfragmente
Anmerkung zur Farbhinterlegung
Die Farbhinterlegung dient ausschließlich der leichteren Orientierung des Lesers im Text. Das Vorliegen einer wörtlichen, abgewandelten oder sinngemäßen Übernahme erschließt sich durch den Text.
Hinweis zur Zeilenzählung
Bei der Angabe einer Fundstelle wird alles, was Text enthält (außer Kopfzeile mit Seitenzahl), als Zeile gezählt, auch Überschriften. In der Regel werden aber Abbildungen, Tabellen, etc. inklusive deren Titel nicht mitgezählt. Die Zeilen der Fußnoten werden allerdings beginnend mit 101 durchnummeriert, z. B. 101 für die erste Fußnote der Seite.
90 gesichtete, geschützte Fragmente
| [1.] Mek/Fragment 007 19 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 007, Zeilen: 19-22 |
Quelle: Holsboer 1999 Seite(n): 287, Zeilen: re. Sp. 9 ff. |
|---|---|
| Nach Neuropeptid-induzierter Aktivierung reagieren die Rezeptoren nicht direkt mit den verschiedenen second-messenger-Systemen, sondern nutzen das Effektorsystem der Guanosintriphosphat (GTP)-bindenden Proteine (G-Proteine). | Nach Liganden-induzierter Aktivierung reagieren diese Rezeptoren nicht direkt mit den verschiedenen Second-messenger-Systemen, sondern nutzen ein Effektorsystem. Diese Effektoren sind eine Familie strukturell eng verwandter Guanosintriphosphat(GTP)-bindender Proteine (G-Proteine), die sehr komplex aufgebaut sind und daher in unterschiedlicher Weise ein von außen an die Zelle herangetragenes Signal in das Zellinnere weiterleiten können. |
Kein Hinweis auf die Quelle, die in der gesamten Arbeit nirgends erwähnt wird. Da Neuropeptide ein Beispiel für Liganden sind, spezifiziert der Verfasser hier die Ausführungen Holsboers (1999). |
| [2.] Mek/Fragment 010 10 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 010, Zeilen: 10-13 |
Quelle: Ströhle 2003 Seite(n): 280, Zeilen: 51 ff. |
|---|---|
| [CRH-enthaltende Neurone finden sich aber auch extrahypothalamisch im Neokortex, der Amygdala, dem Nucleus interstitialis der Stria terminalis (engl. bed nucleus of the stria terminalis, BNST), Hippocampus, Nucleus accumbens, Substantia nigra, Locus coeruleus, dem periaquäduktalen Grau sowie den Raphé-Kernen.] Von besonderem Interesse für die Rolle von CRH bei Stress und Angst ist die Innervation des Locus coeruleus und der zentralen Amygdala (Curtis & Valentino, 1994, Van Bockstaele et al., 1998).
Curtis, A.L. & Valentino, R.J. (1994) CRF neurotransmission in locus coeruleus: a possible site of antidepressant action. Brain Research Bulletin, 35, 581-587. Van Bockstaele, E.J., Colago, E.E. & Valentino, R.J. (1998) Amygdaloid corticotropin-releasing factor targets locus coeruleus dendrites: substrate for the co-ordinalion of emotional and cognitive limbs of the stress response. Journal of Neuroendocrinology, 10, 743-757. |
[Seite 280]
Insbesondere die Innervation des Locus coeruleus und der zentralen Amygdala sind für die Rolle von CRH bei Stress und Angst von besonderer Bedeutung. [ [Seite 281] Dagegen ist der CRH-R2 stärker im PVN, dem lateralen Septum, den zentralen und medialen Teilen der Amygdala sowie dem serotoninergen Nucleus Raphe vorhanden. Eine gemischte Rezeptorexpression findet sich im Bulbus olfactorius, dem Hippokampus, dem entohirnalen Kortex, der Stria terminalis und dem periaqueduktalen Höhlengrau [6]. Bemerkenswerterweise findet sich nur eine gering bis mäßig ausgeprägte Expression von CRH-R1 in der zentralen Amygdala und der Substantia nigra. 6. Chalmers DT, Lowenberg TW, de Souza EB (1995) Localization of novel corticotropin-releasing factor receptor (CRF2) mRNA expression to specific subcortical nuclei in rat brain: Comparison with CRF1 receptor mRNA expression. J Neurosci 15:6340–6350 ] |
Kein Hinweis auf die eigentliche Quelle, die in der gesamten Arbeit nirgends erwähnt wird. Statt seiner tatsächlichen deutschsprachigen Quelle gibt der Verf. für den zweiten Satz zwei englischsprachige Referenzen an. Der in eckige Klammern gesetzte erste Satz weist ebenfalls Parallelen zur Quelle, S. 281, auf. Da der Verf. aber einige Ergänzungen macht, wird er nicht als Plagiat gewertet (und geht nicht mit in die Zeilenzählung ein). |
| [3.] Mek/Fragment 012 02 |
| BauernOpfer |
|---|
| Untersuchte Arbeit: Seite: 012, Zeilen: 02-10, 20-27 |
Quelle: Weber 1999 Seite(n): 153, 171, 172, Zeilen: 153: 18-20; 171: 15-23; 172: 35-42 |
|---|---|
| Emil Kraepelin forderte bereits 1916 in seinem ersten Memorandum zur Gründung einer „Forschungsanstalt für Psychiatrie“, dass eine richtungweisende psychiatrische Grundlagenforschung keinesfalls auf „chemische Stoffwechselanalysen“ verzichten dürfe (Kraepelin, 1916; Weber, 1999). Die Grundprinzipien der neuroendokrinen Funktion des HPA-Systems mit dem Konzept der sekretorischen Aktivität von Neuronen wurden dann folgerichtig durch Ernst und Berta Scharrer, die von 1931 bis 1933 an der Deutschen Forschungsanstalt für Psychiatrie in München, dem heutigen Max-Planck-Institut für Psychiatrie, tätig waren, charakterisiert (Scharrer & Scharrer, 1954). [Manfred Bleuler fasste 1954 erstmals den damaligen Erkenntnisstand bezüglich Physiologie und Pathophysiologie der verschiedenen Hormonregulationssysteme und ihrer möglichen Bedeutung für die Ätiologie und Pathogenese psychiatrischer Erkrankungen zusammen (Bleuler, 1954).] [...]
[...] Seit den späten 1950er Jahren wurden Untersuchungen zu Veränderungen der Stresshormonregulation bei depressiven Patienten vorgenommen; die Entdeckung eines zeitlichen Zusammenhanges zwischen dem Auftreten einer peripher messbaren Funktionsstörung des HPA-Systems und dem psychopathologischen Syndrom resultierte später in der Formulierung einer ätiologischen Hypothese, nach der die Entstehung einer Depression durch eine Dysregulation des HPA-Systems mitverursacht wird (Holsboer et al., 1980,1983,1984,1999a; Weber, 1999). Bleuler, M. (1954) Endokrinologische Psychiatrie. Georg Thieme Verlag, Stuttgart. Holsboer, F., Bender, W., Benkert, O., Klein, H.E. & Schmauss, M. (1980) Diagnostic value of dexamethasone suppression test in depression. Lancet, 2, 706. Holsboer, F. (1983) Prediction of clincal [sic] course by dexamethasone suppression test (DST) response in depressed patients - physiological and clinical construct validity of the DST. Pharmacopsychiatry, 16, 186-191. Holsboer, F., von Bardeleben, U., Gerken, A., Stalla, G.K. & Müller, O.A. (1984) Blunted corticotropin and normal cortisol response to human corticotropin-releasing factor in depression. New England Journal of Medicine, 311, 1127. Holsboer, F. (1999a) The rationale for corticotropin-releasing hormone receptor (CRH-R) antagonists to treat depression and anxiety. [Review] [163 refs]. Journal of Psychiatric Research, 33, 181-214. Kraepelin, E. (1916) Ein Forschungsinstitut für Psychiatrie. Zeitschrift für die gesamte Neurologie und Psychiatrie, 32, 1-38. Scharrer, E. & Scharrer, B. (1954) Neurosekretion. In Bargmannn [sic], W. (ed.) Handbuch der mikroskopischen Anatomie des Menschen., Stuttgart, pp. 953-1066. Weber, M.M. (1999) Die Entwicklung der Psychopharmakologie im Zeitalter der naturwissenschaftlichen Medizin: Ideengeschichte eines psychiatrischen Therapiesystems, Urban & Vogel, München. |
[Seite 153]
Kraepelin stellte in seinem ersten Memorandum zur Gründung einer „Forschungsanstalt für Psychiatrie“ fest, daß eine richtungweisende psychiatrische Grundlagenforschung auf „chemische Stoffwechselanalysen“ nicht verzichten darf [390]. [Seite 171] Die für die spätere neurobiologische Forschung richtungweisenden Arbeiten führte das Biologen—Ehepaar Ernst (*1905 - †1965) und Berta Scharrer (*1906 - †1995) durch, die von 1931 bis 1933 Walther Spielmeyers Neuropathologischer Abteilung der Deutschen Forschungsanstalt für Psychiatrie angehörten [382]. In einer Serie von Studien, die sie zwischen 1928 und 1954 publizierten, klärten sie die Grundprinzipien der neuroendokrinen Funktion des Hypothalamus-Hypophysen-Systems auf [651, 652, 653]. Das von ihnen entwickelte Konzept einer unmittelbaren sekretorischen Aktivität von Neuronen stieß jedoch bis in die 1950er Jahre auf heftige Kritik, da es mit den herkömmlichen neuroanatomischen und physiologischen Auffassungen nicht vereinbar war. [Auch die Psychiatrie erkannte den Wert dieser Untersuchungen zunächst nicht. Manfred Bleuler, der den Forschungsstand der ersten Jahrhunderthälfte 1954 in einer Monographie zusammenfaßte, gelangte daher zu dem ernüchternden Ergebnis, daß zwischen den „hochfliegenden Hoffnungen“ und dem „bisherigen Arbeitsaufwand“ ein eklatantes „Mißverhältnis“ bestehe: sogar Kraepelin und Freud hätten sich zu „falschen Erwartungen“ hinreißen lassen [73].] [Seite 172] [Die Untersuchungen von Florian Holsboer während der 1980er Jahre ergaben, daß diese Normalisierung der gestörten Streßhormonregulation der Verbesserung der psychopathologischen Symptomatik vorauseilt, wobei ein Wiederauftreten der Regulationsstörung mit einem erhöhten Rückfallrisiko für eine erneute depressive Episode verbunden ist.] [...] [...] Die Genese dieses psychopharmakologischen Konzepts läßt sich rückblickend somit folgendermaßen zusammenfassen: Frühe Beobachtungen über die physiologische Funktion der Corticoidhormone veranlaßten zur Untersuchung der Streßhormonregulation bei depressiven Patienten. Die Feststellung eines zunächst lediglich zeitlichen Zusammenhangs zwischen dem Auftreten einer Regelkreisstörung und dem psychopathologischen Syndrom führte zur Formulierung einer ätiologischen Hypothese: die Entstehung der Depression ist durch eine Dysfunktion des hypothalamisch-hypophysär-adrenocorticalen Systems mitverursacht. [73] Bleuler, Manfred (1954) Endokrinologische Psychiatrie. Stuttgart. [382] Korf, H.-W. (1995) Gehirn und Hormone: das Konzept der Neurosekretion von Ernst und Berta Scharrer (in: Berühmte Ärzte und Forscher in Frankfurt am Main. Festschrift zur 500. Versammlung der Frankfurter Medizinischen Gesellschaft am 21. Juni 1995, hrsg. v. H.W. Doerr und H.-W. Korf, 62—83). Frankfurt/M. [390] Kraepelin, Emil (1916) Ein Forschungsinstitut für Psychiatrie. ZgNP, 32, 1—38. [651] Scharrer, Ernst (1928) Die Lichtempfindlichkeit blinder Elritzen. Untersuchungen über das Zwischenhirn der Fische. Zeitschrift für vergleichende Physiologie, 7, 1—38. [652] Scharrer, Ernst; Scharrer, Berta (1937) Über Drüsen-Nervenzellen und neuroskretorische Organe bei Wirbellosen und Wirbeltieren. Biological Revue [sic], 12, 185—216. [653] Scharrer, Ernst; Scharrer, Berta (1954) Neurosekretion (in: Handbuch der mikroskopischen Anatomie des Menschen, hrsg. v. W. Bargmann, VI/5, 953—1066). Stuttgart. |
Die Quelle wird genannt. Die beinahe wörtliche Übernahme des ersten Satzes und die sinngemäße des folgenden werden jedoch nicht kenntlich gemacht. Für den längeren untersten Satz wird Weber (1999) zwar als eine von fünf Referenzen – bei denen „Holsboer et al.“ bzgl. Holsboer (1999a) unzutreffend ist – genannt, jedoch wird dieser in Teilen wörtlich übernommen („HPA“ steht hierbei für hypothalamic-pituitary-adrenal). Da sich der dritte, in eckige Klammern gesetzte Satz des Verfassers erheblich von den Ausführungen der Quelle unterscheidet – wenn auch eigentlich eine übernommene Aussage nur ausgeschmückt wird –, wird dieser nicht als Plagiat gewertet. |
| [4.] Mek/Fragment 012 28 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 012, Zeilen: 28-33 |
Quelle: Holsboer 1999 Seite(n): 294, Zeilen: re. Sp. 20 ff. |
|---|---|
| Die bei der Depression gut dokumentierte Überaktivität des HPA-Systems ist primär durch eine vermehrte Synthese und Freisetzung von CRH und AVP erklärbar. Dies stimmt mit Befunden einer erhöhten CRH-Konzentration im Liquor sowie einer gegenregulatorisch verminderten CRH-Bindung im frontalen Kortex bei Patienten, die wegen Depression Suizid verübten, überein (zur Übersicht: Nemeroff & Owens, 2002).
Nemeroff, C.B & Owens, M.J. (2002) Treatment of mood disorders [Review], Nature Neuroscience, 5, 1068-1070. |
Die Hyperaktivität des HPA-Systems ist primär durch die vermehrte Freisetzung von CRH erklärbar, was mit Befunden einer erhöhten CRH-Konzentration in der Zerebrospinalflüssigkeit (CSF) sowie einer verminderten CRH-Bindung im frontalen Kortex bei Patienten, die wegen Depression Suizid begangen haben, übereinstimmt (Übersichten: Owens und Nemeroff 1991; Holsboer et al. 1992).
Owens MJ, Nemeroff CB (1991) Physiology and pharmacology of corticotropin-releasing factor. Pharmacol Rev 43: 425-473 Holsboer F, Spengler D, Heuser I (1992) The role of corticotropin-releasing hormone in the pathogenesis of Cushing’s disease, anorexia nervosa, alcoholism, affective disorders and dementia. Prog Brain Res 93: 385-417 |
Der Verfasser referenziert eine Publikation aus dem Jahr 2002, verwendet aber tatsächlich (und teils wörtlich) den unerwähnt bleibenden Text von Holsboer aus dem Jahr 1999 als Schreibvorlage. Die Quelle zitiert Publikationen aus den Jahren 1991 und 1992. Der Verweis des Verfassers auf Nemeroff & Owens (2002) ist insofern überraschend, als dass sich dort von 27 genannten Literaturtiteln nur insgesamt drei mit dem corticotropin-releasing hormone (CRH) bzw. dem corticotropin-releasing factor (CRF) befassen; bei Owens & Nemeroff (1991) umfasst die Literaturliste hingegen gut 11 Seiten, und die Mehrzahl der Titel scheint vom CRH bzw. CRF zu handeln. |
| [5.] Mek/Fragment 013 16 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 013, Zeilen: 16-17, 22-29 |
Quelle: Ströhle 2003 Seite(n): 283, 284, Zeilen: 283: 24 f.; 284: 01 ff. |
|---|---|
| 50-60% der depressiven Patienten zeigen eine basal erhöhte Plasmakonzentration von ACTH und Kortisol. [...] Bei Durchführung eines kombinierten Dexamethason-Suppressions/CRH-Stimulations-Tests zeigt sich bei bis zu 90% der untersuchten depressiven Patienten eine paradoxe Reaktion insofern, als nach Dexamethason-Vorbehandlung die Suppression von ACTH ausbleibt und es sogar zu einer verstärkten ACTH-Freisetzung kommt - trotz erhöhter endogener (Kortisol) und exogener (Dexamethason) Glukokortikoidkonzentrationen (Heuser et al., 1994b; Holsboer, 1999a; Künzel et al., 2003a).
Heuser, I.J., Yassouridis, A. & Holsboer, F. (1994b) The combined DEX/CRH test- a refined laboratory lest for psychiatric disorders. Journal of Psychiatric Research, 28, 341-356. Holsboer, F. (1999a) The rationale for corticotropin-releasing hormone receptor (CRH-R) antagonists to treat depression and anxiety. [Review] [163 refs]. Journal of Psychiatric Research, 33, 181-214. Künzel, H.E., Binder, E.B., Nickel, T., Ising, M., Fuchs, B., Majer, M., Pfennig, A., Ernst, G., Kern, N., Schmid, D.A., Uhr, M., Holsboer, F. & Modell, S. (2003a) Pharmacological and nonpharmacological factors influencing hypothalamic-pituitary-adrenocortical axis reactivity in acutely depressed psychiatric in-patients, measured by the Dex-CRH test. Neuropsychopharmacology, in press. |
[Seite 283]
50-60% der Patienten mit einer Major-Depression zeigen diskrete Veränderungen der basalen, d. h. nicht stimulierten Konzentrationen von ACTH und Kortisol. [Seite 284] Ein erstaunlicher Befund ergab sich bei der Untersuchung von Patienten mit einer Depression nach Dexamethason-Vorbehandlung und nachfolgender CRH-Stimulation, dem sog. DEX/CRH-Test (Abb. 3). Die verminderte Dexamethason-induzierte Kortisolsuppression und die abgeschwächte ACTH-Freisetzung aufgrund des negativen Feedbacks sollten eigentlich additiv wirksam werden. Gegensätzlich zur Erwartung zeigen depressive Patienten jedoch eine paradoxe Reaktion, d. h. eine Dexamethason-Vorbehandlung führt zu einer vermehrten ACTH- und Kortisolreaktion auf CRH und dies trotz erhöhter endogener (Kortisol) und exogener (Dexamethason) Konzentrationen von Glukokortikoiden [18]. 18. Holsboer F (2000) The corticosteroid receptor hypothesis of depression. Neuropsychopharmacology 23:477–501 |
Kein Hinweis auf die eigentliche – deutschsprachige – Quelle, die in der gesamten Arbeit nirgends erwähnt wird. Eine Zahlenangabe, dass „bei bis zu 90% der untersuchten depressiven Patienten [...] nach Dexamethason-Vorbehandlung die Suppression von ACTH ausbleibt“, findet sich so weder in dieser noch in den drei angegebenen englischsprachigen Referenzen. In der Auslassung findet sich eine nicht kenntlich gemachte Übernahme aus der Quelle Holsboer (1999), siehe Fragment 013 17, aus der auch unmittelbar im Anschluss an das vorliegende Fragment fortgesetzt wird, siehe Fragment 014 01. |
| [6.] Mek/Fragment 013 17 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 013, Zeilen: 17-22 |
Quelle: Holsboer 1999 Seite(n): 294, Zeilen: re. Sp. 28 ff. |
|---|---|
| Die Ergebnisse neuroendokriner Funktionstests beweisen ebenfalls eine gestörte Regulation des HPA-Systems bei Depression. Zum einen werden ACTH und Kortisol durch Dexamethason nicht adäquat unterdrückt, zum anderen ist die ACTH-Sekretion nach CRH-Stimulation bei Depressiven geringer als bei Kontrollen, was für eine gegenregulatorisch verminderte hypophysäre CRH1-Rezeptor-Kapazität als Folge einer dauerhaften Stimulation durch CRH spricht. | Auch Ergebnisse neuroendokriner Funktionstests beweisen eine gestörte Regulation des HPA-Systems bei Depression. Zum einen werden ACTH und Kortisol durch Dexamethason nicht adäquat unterdrückt, des weiteren ist die ACTH-Sekretion nach CRH-Stimulation bei depressiven Patienten geringer als bei Kontrollen, was für eine verminderte CRH-Rezeptor-Kapazität infolge einer länger andauernden Stimulation durch CRH spricht. |
Großteils wörtliche Übernahme ohne Angabe der Quelle, die in der Arbeit nirgends genannt ist. Sechs Zeilen unter dem Fragment wird zwar u.a. "Holsboer 1996a" referenziert, doch handelt es sich dabei um eine englischsprachige Publikation, die den Inhalt daher so nicht enthalten kann. CRH1 ist synonym zu CRH. |
| [7.] Mek/Fragment 014 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 014, Zeilen: 01-10 |
Quelle: Holsboer 1999 Seite(n): 296, Zeilen: li. Sp. 12 ff. |
|---|---|
| [Da Dexamethason als synthetisches Glukokortikoid die Blut-Hirn-Schranke nur in minimalen Mengen passieren kann und gleichzeitig die Glukortikoidsynthese der Nebennierenrinde hemmt, sind die – bei depressiven Patienten vermutlich ohnehin subsensitiven (De Leo et al., 1992) - Kortikoidrezeptoren des Gehirns ihrer natürlichen Liganden beraubt, ohne dass] Dexamethason dies zu kompensieren vermag. Dexamethason wirkt aufgrund seiner fehlenden Bindung an das Kortikosteroid-bindende Globulin sowie des aktiven Transports aus Neuronen durch p-Glykoproteine der Blut-Hirn-Schranke (Müller et al., 2003a, 2003b) vorwiegend hypophysär; es kommt im Gehirn also in der Folge zu einer „funktionellen Adrenalektomie“. Als zentrale kompensatorische Reaktion resultiert hieraus eine nochmals erhöhte Freisetzung von CRH und AVP (s. unten), so dass nach Gabe von zusätzlichem, synthetischen CRH im Stimulationstest die intrinsischen CRH/AVP-Effekte an CRH1-Rezeptoren der kortikotropen Zellen des Hypophysenvorderlappens synergistisch verstärkt werden und die Dexamethason-Suppression auf Hypophysenebene teilweise aufgehoben wird.
De Leo, R., Cerri, G., Balducci, D., Moglie, F., Scarpino, O. & Guidi, M. (1992) Computer modelling of brain cortex excitation by magnetic field pulses. Journal of Medical Engineering & Technology, 16, 149-156. Müller, M.B., Keck, M.E., Binder, E.B., Kresse, A.E., Hagemeyer, T.P., Landgraf, R., Holsboer, F. & Uhr, M. (2003a) ABCB1 (MDRI)-type glycoproteins at the blood-brain barrrier modulate the activity of the hypothalamic-pituitary-adrenocortical system: implications for affective disorder. Neuropsychopharmacology, in press. Müller, M.B., Uhr, M., Holsboer, F. & Keck, M.E. (2003b) Hypothalamic-pituitary-adrenocortical system and mood disorders: highlights from mutant mice. Neuroendocrinology, in press. |
Da Dexamethason durch ein im Multidrug-resistance(mdr)-Gen kodiertes und in den Endothelzellen der Blut-Hirn-Schranke exprimiertes P-Glykoprotein aus den Endothelzellen in das Gefäßlumen zurücktransportiert wird und damit erschwert in das Gehirn eindringt, sind die Glukokortikoid- und Mineralkortikoidrezeptoren ihres natürlichen Liganden beraubt, ohne daß dies von Dexamethason kompensiert werden würde (Flens et al. 1996). Im ZNS kommt die niedrig dosierte Dexamethasongabe somit funktionell einer Adrenalektomie gleich. Als zentrale kompensatorische Reaktion kommt es zu einer stark erhöhten Sekretion von CRH und v.a. von AVP, so daß nach exogener Gabe von CRH die intrinsischen AVP-Effekte an kortikotrophen Zellen synergistisch verstärkt werden können und die Dexamethasonsuppression auf Hypophysenebene teilweise aufgehoben wird (von Bardeleben und Holsboer 1989).
Bardeleben U von, Holsboer F (1989) Cortisol response to a combined dexamethasone-human corticotropin-releasing hormone challenge in patients with depression. J Neuroendocrinol 1: 485–488 Flens MJ, Zaman GJR, Valk P van der et al. (1996) Tissue distribution of the multidrug resistance protein. Am J Pathol 148: 1237–1247 |
Kein Hinweis auf die Quelle. Zuvor wird auf S. 13 zwar „Holsboer, 1999a“ und auf S. 14 im folgenden Absatz „Holsboer, 2000“ referenziert, doch handelt es sich dabei um englischsprachige Publikationen, die den Inhalt in dieser sprachlichen Form nicht enthalten können. Der erste (sich größtenteils auf S. 13 befindende) Satz weist zwar stärkere Variationen auf, doch bleibt – auch im Kontext mit dem nachfolgenden Inhalt – die Schreibvorlage erkennbar. Man beachte zudem, dass bei De Leo et al. (1992) weder von Kortikoidrezeptoren noch von Depression überhaupt die Rede ist. |
| [8.] Mek/Fragment 017 15 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 017, Zeilen: 15-17 |
Quelle: Landgraf 2003 Seite(n): 274, 275, Zeilen: 274: re. Sp. 29-31; 275: mittl. Sp. 01 |
|---|---|
| Einen experimentellen Zugriff zum Substrat der Generierung von Emotionen und Verhalten, d.h. dem Gehirn, bietet letztlich nur ein geeignetes Tiermodell. | [Seite 274]
Einen experimentellen Zugriff zum Substrat der Generierung von Emotionen, d. h. dem Gehirn, bietet letztlich nur [Seite 275] ein geeignetes Tiermodell. |
Kein Hinweis auf die Quelle, die in der gesamten Arbeit nirgends erwähnt wird. Am Ende des folgenden, hier nicht wiedergegebenen Satzes werden Ohl & Keck (2003) referenziert. Da es sich dabei um einen englischsprachigen Aufsatz handelt, kann sich die Aussage dort jedoch so nicht finden. Trotz der Kürze Wertung als Plagiat, da ein nichttrivialer Satz – mit einer Ergänzung – wörtlich übernommen wurde. |
| [9.] Mek/Fragment 017 22 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 017, Zeilen: 22-26 |
Quelle: Ohl Landgraf 2000 Seite(n): 265, Zeilen: li. Sp. 10 ff. |
|---|---|
| [Der Terminus „Tiermodell“ wird in der psychiatrischen Grundlagenforschung als Überbegriff für verschiedene methodische Ansätze verwendet (Ohl & Landgraf, 2000).] Er umfasst zum einen Verhaltenstests, bei denen bestimmte Verhaltensweisen wie Angst oder Passivität durch einen situativen Kontext oder pharmakologische Manipulationen hervorgerufen werden. Zum anderen beinhaltet er Tiere, die aufgrund von Genmanipulationen oder selektiver Zucht ein basal verändertes, angeborenes Verhalten aufweisen.
Ohl, F. & Landgraf, R. (2000) Animal models of anxiety. Neuroforum, 4, 257-262. |
Um die Neurobiologie der Angst sowie die Entstehung von Angsterkrankungen untersuchen zu können, sind Tiermodelle unverzichtbar. In der Neuropharmakologie werden sowohl Verhaltenstests, bei denen Angstverhalten durch einen situativen Kontext oder pharmakologische Manipulation hervorgerufen wird, als auch Tiere, die aufgrund von Genmanipulation oder selektiver Zucht ein basal verändertes Angstverhalten zeigen, als Tiermodelle bezeichnet. Die Zusammenfassung dieser verschiedenen Modelle unter einem Sammelbegriff ist allerdings etwas unglücklich, denn es handelt sich hier um methodisch sehr unterschiedliche Ansätze. |
Der vom Verf. referenzierte englischsprachige Aufsatz ist auf den angegebenen Seiten nicht vorhanden; hingegen findet sich auf S. 263-268 ein deutschsprachiger derselben Autoren zum selben Thema. Bei Zeitschriften ist im Literaturverz. des Verf. üblicherweise der Jahrgang fett gesetzt; richtig wäre in diesem Fall – die Zeitschrift ist 2000 im VI. Jahrgang erschienen – daher „6“ statt „4“. Auch im IV. Jahrgang 1998 findet sich auf den angegebenen Seiten nicht der genannte Beitrag. Da auch an anderen Stellen der untersuchten Arbeit die Referenzierung englischsprachiger Texte bei gleichzeitigen wörtlichen Übernahmen aus ungenannten deutschsprachigen festgestellt werden kann, wird das Fragment als „Verschleierung“ gewertet. |
| [10.] Mek/Fragment 019 06 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 019, Zeilen: 06-08 |
Quelle: Engelmann 2000 Seite(n): 011, Zeilen: 28-33 |
|---|---|
| Anders als konditionierte Testsysteme greifen unkonditionierte Tests auf artgerechte, ethologisch relevante Stimuli zurück und sind von der Lern- und Gedächtnisleistung weitestgehend unabhängig. | [...] Dabei haben konditionierte Tests zwar den Vorteil einer leichteren Objektivierbarkeit, bergen aber die Gefahr, daß die gemessene Verhaltensleistung nicht nur von dem emotionalen Zustand, sondern auch von der Lern- und Gedächtnisleistung bestimmt wird. Anders als die konditionierten Testsysteme greifen unkonditionierte Tests auf artgerechte, ethologisch relevante Stimuli zurück. |
Kein Hinweis auf die Quelle, die in der gesamten Arbeit nirgends genannt ist. |
| [11.] Mek/Fragment 020 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 020, Zeilen: 01-18; 20-23; 29-32 |
Quelle: Holsboer 1999 Seite(n): 274, 285, 297, 299, Zeilen: 274: rechte Spalte 3 ff.; 285: linke Spalte 01 ff.; 297: linke Spalte 34 ff.; 299: linke Spalte 11 ff. |
|---|---|
| [So führte die Entdeckung der] antidepressiven Wirksamkeit von Imipramin (Tofranil®, Markteinführung 1958 durch Geigy) und der Monoaminooxidasehemmmer, wie z.B. Iproniazid (Chessin et al., 1957), sowie die stimmungsverschlechternde Wirkung von Reserpin, welches Katecholaminvesikel deputiert, zu Depressionshypothesen, die auf der Annahme einer verringerten präsynaptischen Freisetzung und postsynaptischen Verfügbarkeit biogener Amine basieren. In deutlich erweiterter und modifizierter Form sind die Monoaminmangel-Hypothesen bis heute wichtigster Ausgangspunkt für die Entwicklung neuer Generationen von Antidepressiva, die im wesentlichen immer selektiver in die neuronalen Wiederaufnahmemechanismen biogener Amine eingreifen (Holsboer, 1999a). Von Bedeutung ist jedoch, dass die klinische Wirkung der antidepressiven Pharmakotherapie erst lange, d.h. drei bis sechs Wochen, nach der akuten Erhöhung der Neurotransmitterkonzentration im synaptischen Spalt eintritt. Zudem entfalten Substanzen mit zunächst gegensätzlichem Wirkprinzip, wie Serotonin-Wiederaufnahmehemmer und Serotonin-Wiederaufnahmeverstärker, wie z.B. Tianeptin, dieselbe antidepressive Wirksamkeit (Nickel et al., 2003). Hieraus kann geschlossen werden, dass die beschriebenen pharmakologischen Effekte lediglich am Anfang einer Kaskade zellulärer Ereignisse stehen, die als Resultat molekularer und systemischer Anpassung zur antidepressiven Wirkung führen.
[1.3.1 CRH1-Rezeptor-Antagonismus] Allen bislang untersuchten Antidepressiva ist gemeinsam, dass sie einen verzögerten Wirkungseintritt besitzen und dass dem Beginn ihrer klinischen Wirksamkeit die Normalisierung der krankheitsassoziierten Hyperaktivität des HPA-Systems vorausgeht. [...] Diese erklärt nicht nur die Vulnerabilität für Depression und ihre bevorzugte Auslösung durch Stressoren, sondern auch einen möglichen Wirkmechanismus der Antidepressiva (Holsboer & Barden, 1996). Aus der Kortikosteroidrezeptorhypothese folgt, dass [primär eine verminderte Rezeptorfunktion mit hieraus resultierender abgeschwächter negativer Rückkopplung zur Hyperaktivität zentraler CRH- und AVP-sezerniernder Neurone führt.] Chessin, M., Dubnick, B., Kramer, E.R. & Scott, C.C. (1957) Modification of pharmacology of reserpine and serotonin by iproniazid. Journal of Pharmacology & Experimental Therapeutics, 119, 453-460. Holsboer, F. (1999a) The rationale for corticotropin-releasing hormone receptor (CRH-R) antagonists to treat depression and anxiety. [Review] [163 refs]. Journal of Psychiatric Research, 33, 181-214. Nickel, T., Sonntag, A., Schill, J., Zobel, A.W., Ackl, N., Brunnauer, A., Murck, H., lsing, M., Yassouridis, A., Steiger, A., Zihl, J. & Holsboer, F. (2003) Clinical and neurobiological effects of tianeptine and paroxetine in major depression. Journal of Clincal Psychopharmacology, 23, 155-168. Holsboer, F. & Barden , N. (1996) Antidepressants and Hypothalamic- Pituitary-Adrenocortical [sic] Regulation. Endocrine Reviews, 17, 187-205. |
[Seite 274]
Die Entdeckung der antidepressiven Wirkung von Imipramin und Monoaminoxidasehemmern sowie die stimmungsverschlechternde Wirkung von Reserpin, das die Katecholaminvesikel entspeichert, führten zu Depressionshypothesen, die auf der Annahme einer verminderten präsynaptischen Freisetzung und postsynaptischen Verfügbarkeit biogener Amine basierten. Diese Hypothesen wurden in den letzten 10 Jahren erheblich – unter Einbeziehung veränderter Rezeptorfunktion und nachgeschalteter zellulärer Vorgänge – erweitert. In ihrer hierdurch modifizierten Form sind die Monoaminmangelhypothesen“ [sic] heute noch der wichtigste Ausgangspunkt für die Entwicklung neuer Generationen von Antidepressiva. [Seite 285] Die Antidepressiva werden nach ihrem akuten Wirkmechanismus, z.B. in NA-Wiederaufnahmehemmer, SSRIs oder Monoaminoxidasehemmer, klassifiziert. Dabei muß allerdings gesehen werden, daß die klinische Wirkung lange nach der akuten Erhöhung der Neurotransmitterkonzentration im synaptischen Spalt und auch viel später als die Herunterregulation der β-Adrenozeptoren und der 5-HT2-Bindungsstellen (Riva und Creese 1989) erfolgt. Daraus kann geschlossen werden, daß diese pharmakologischen Effekte nur am Anfang einer Serie von zellulären Ereignissen stehen, die als Ergebnis molekularer und systemischer Anpassung zur antidepressiven Wirkung führen. [Seite 297] Die Kortikosteroidrezeptorhypothese erklärt nicht nur die Vulnerabilität für Depression und ihre bevorzugte Auslösung durch Stressoren, sondern auch einen Wirkmechanismus der Antidepressiva. Die Arbeitsgruppe um Nick Barden in Kanada hat in verschiedenen Zellkulturen einschließlich Neuronen Hinweise gefunden, daß Antidepressiva die Expression von GR stimulieren (Pepin et al. 1989). [Seite 299] Allen bisher untersuchten Antidepressiva ist gemeinsam, daß sie eine verzögerte Wirklatenz besitzen und daß dem Einsatz ihrer klinischen Wirkung die Normalisierung der initialen HPA-Hyperaktivität vorauseilt (Übersicht: Holsboer und Barden 1996). [...] Aus der Kortikosteroidrezeptorhypothese folgt, daß primär eine verminderte Rezeptorfunktion zur Hyperaktivität CRH-sezernierender Neuronen im PVN führt und daß Antidepressiva durch Erhöhung der Rezeptorfunktion die Kortikosteroid-induzierte Transrepression des CRH- (und AVP-) Gens erhöhen. Riva MA, Creese I (1989) Reevaluation of the regulation of β-adrenergic receptor binding by desipramine treatment. Mol Pharmacol 36: 211-218 Pepin MC, Beaulieu S, Barden N (1989) Antidepressants regulate glucocorticoid receptor messenger RNA concentrations in primary neuronal cultures. Brain Res Mol Brain Res 6: 77-83 Holsboer F, Barden N (1996) Antidepressants and HPA regulation. Endocr Rev 17: 187-205 |
Der Autor gibt zwar u.a. einen (englischsprachigen) Artikel von Holsboer aus dem Jahr 1999 als „Holsboer, 1999a“ an, verwendet jedoch tatsächlich einen deutschen Text aus einem Lehrbuch desselben Autors ohne korrekten Zitationsnachweis. Bei Holsboer (1999a) ist zudem von „Antidepressiva, die im wesentlichen immer selektiver in die neuronalen Wiederaufnahmemechanismen biogener Amine eingreifen“, so nicht die Rede; auf S. 181 f. heißt es:
Aussagen über „biogenic amine[s]“ finden sich in dessen Abhandlung an anderen Stellen nicht. Eine modifizierte Wiederholung der ersten beiden Sätze findet sich außerdem auf S. 80, siehe Fragment 080 03. |
| [12.] Mek/Fragment 021 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 021, Zeilen: 01-07 |
Quelle: Holsboer 1999 Seite(n): 299, Zeilen: 31-41 |
|---|---|
| [Aus der Kortikosteroidrezeptorhypothese folgt, dass] primär eine verminderte Rezeptorfunktion mit hieraus resultierender abgeschwächter negativer Rückkopplung zur Hyperaktivität zentraler CRH- und AVP-sezerniernder Neurone führt. Antidepressiva erhöhen durch eine Verbesserung der Glukokortikoid-Rezeptorfunktion die Kortikosteroid-induzierte Transrepression des CRH- sowie des AVP-Gens. Da dieser Effekt längere Zeit in Anspruch nimmt, wurde vorgeschlagen, die Latenz bis zum Eintritt der klinischen Antidepressivawirkung durch Kombination mit einem CRH-Rezeptor-Antagonisten zu verkürzen (Holsboer, 1999a).
Holsboer, F. (1999a) The rationale for corticotropin-releasing hormone receptor (CRH-R) antagonists to treat depression and anxiety. [Review] [163 refs]. Journal of Psychiatric Research, 33, 181-214. |
Aus der Kortikosteroidrezeptorhypothese folgt, daß primär eine verminderte Rezeptorfunktion zur Hyperaktivität CRH-sezernierender Neuronen im PVN führt und daß Antidepressiva durch Erhöhung der Rezeptorfunktion die Kortikosteroid-induzierte Transrepression des CRH- (und AVP-) Gens erhöhen. Da letzterer Effekt längere Zeit in Anspruch nimmt, wurde vorgeschlagen, die Latenz bis zum Eintritt der Antidepressivawirkung durch Kombination mit einem CRH-Rezeptor-Antagonisten zu verkürzen (Holsboer 1999).
Holsboer, F. (1999) The rationale for corticotropin-releasing hormone receptor (CRH-R) antagonists to treat depression and anxiety. [Review] [163 refs]. Journal of Psychiatric Research, 33, 181-214. |
Der Verfasser referenziert zwar einen (englischsprachigen) Artikel von Holsboer aus dem Jahr 1999, verwendet jedoch, anstatt sich die Mühe zu machen, die entsprechenden Passagen selbst zu übersetzen, tatsächlich einen deutschen Text aus einem Lehrbuch desselben Autors und ohne korrekten Quellennachweis. |
| [13.] Mek/Fragment 021 19 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 021, Zeilen: 19-25 |
Quelle: Holsboer 1999 Seite(n): 294, Zeilen: re. Sp. 37 ff. |
|---|---|
| Im Dexamethason/CRH-Test führte bei gesunden Probanden erst die kombinierte Gabe von AVP und CRH, im Gegensatz zur alleinigen Verabreichung von CRH, durch die synergistische Wirkung an den kortikotropen Zellen des Hypophysenvorderlappens zur Aufhebung der Dexamethason-induzierten Suppression der Freisetzung von ACTH und Kortisol (von Bardeleben et al., 1985). Bei Patienten mit Depression hingegen kann dieser Effekt bereits durch die alleinige Gabe von CRH erzielt werden. [Hieraus wurde gefolgert, dass bei depressiven Patienten nicht nur CRH, sondern auch AVP vermehrt exprimiert wird (von Bardeleben & Holsboer, 1989).]
von Bardeleben, U., Holsboer, F., Stalla, G.K. & Müller, O.A. (1985) Combined administration of human corticotropin-releasing factor and lysine vasopressin induces cortisol escape from dexamethasone suppression in healthy subjects. Life Sciences, 37, 1613-1618. [von Bardeleben, U. & Holsboer, F. (1989) Cortisol response to a combined dexamethasone-human corticotropin-releasing hormone challenge in patients with depression. J Neuroendocrinol, 1, 485-488.] |
Es fand sich ferner, daß eine CRH-Hypersekretion allein nicht die verminderte Supprimierbarkeit durch Dexamethason erklären kann, denn selbst sehr hohe CRH-Dosen können bei gesunden Probanden die durch Dexamethason bewirkte Suppression von ACTH und Kortisol nur geringfügig aufheben (Wiedemann und Holsboer 1997). Erst die kombinierte Anwendung von CRH und Vasopressin (AVP) führt durch eine synergistische Wirkung an kortikotrophen Zellen zur völligen Aufhebung der Dexamethason-induzierten ACTH- und Kortisolsuppression (von Bardeleben et al. 1985). Bei Patienten mit Depression dagegen kann bereits durch CRH allein eine starke ACTH- und Kortisolstimulation - trotz Dexamethasonvorbehandlung - hervorgerufen werden.
Wiedemann K, Holsboer F (1997) The effect of repeated human cort icotropin-releasing hormone administration on dexamethasone-suppressed pituitary-adrenocortical activity in healthy subjects. Biol Psychiatry 42: 882-888 Bardeleben U von, Holsboer F, Stalla GK, Müller OA (1985) Combined administration of human corticotropin-releasing factor and lysine vasopressin induces cortisol escape from dexamethasone suppression in healthy subjects . Life Sciences 37: 1.613-1.618 |
Kein Hinweis auf die eigentliche Quelle. Referenziert sind zwei englischsprachige Publikationen, die den Inhalt in dieser sprachlichen Form nicht enthalten können. Trotz Umformulierungen bleibt die Schreibvorlage erkennbar. Der letzte Satz geht nicht in die Zeilenzählung ein. |
| [14.] Mek/Fragment 021 29 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 021, Zeilen: 29-32 |
Quelle: Engelmann 2000 Seite(n): 012, Zeilen: 25-28 |
|---|---|
| Auf der Grundlage der genannten Befunde und Hypothesen bestand ein Ziel der vorliegenden Habilitationsarbeit darin, die Bedeutung des intrazerebral synthetisierten und freigesetzten AVP für die Regulation der neuroendokrinen Sekretion und der Verhaltensantwort unter definierten [Stressbedingungen zu charakterisieren.] | Auf der Grundlage der genannten Befunde und Hypothesen bestand das Ziel der vorliegenden Habilitationsarbeit darin, die Bedeutung von intrazerebral freigesetztem AVP für die Regulation der neuroendokrinen [sic] und Verhaltensantwort unter definierten Streßbedingungen zu ermitteln. |
Der Autor gibt das Ziel der Habilitationsschrift von Engelmann (2000) als eines der Ziele seiner eigenen aus – bei nahezu wörtlicher Textübernahme. Der fehlende und ergänzte Begriff „Sekretion“ dürfte sich hierbei aus dem Zusammenhang ergeben haben. |
| [15.] Mek/Fragment 022 25 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 022, Zeilen: 25-31 |
Quelle: Peller 2002 Seite(n): 007-008, Zeilen: 007: 19-21; 008: 06-11 |
|---|---|
| In Abgrenzung zur in der neurophysiologischen Diagnostik vornehmlich gebräuchlichen Einzelreiz-TMS, [sic] bezieht sich der Begriff rTMS auf die Applikation von mindestens zwei Einzelreizen, welche mit einem definierten Interstimulusintervall über einem umschriebenen Kortexareal appliziert werden (Wassermann et al., 1996; Wassermann, 2000). Das verwendete Stimulationsprotokoll lässt sich neben der Reizfrequenz unter anderem durch die Reizintensität, die Stimulusform (monophasisch/biphasisch) sowie die Anzahl und [Dauer der Reizserien definieren.]
Wassermann, E.M., Grafman, J., Berry, C., Hollnagel, C., Wild , K., Clark, K. & Hallett, M. (1996) Use and safety of a new repetitive transcranial magnetic stimulator. Electroencephalography and clinical Neurophysiology, 101, 412-417. Wassermann, E.M. (2000) Side effects of rTMS. Depression and Anxiety, 12, 124-129. |
[Seite 008]
In Abgrenzung zu der Einzelreiz-TMS und der oben erwähnten Doppelreiz-TMS wurde auf einer Konsensuskonferenz (NINDS, Bethesda, Maryland, USA) im Jahr 1996 festgelegt, dass nur dann von einer rTMS gesprochen werden sollte, wenn über einem umschriebenen Kortexareal mehr als zwei Magnetstimuli mit einem konstanten Interstimulusintervall appliziert werden (Wassermann et al., 1998: 1-16). [Seite 007] Das verwendete Stimulationsprotokoll läßt sich durch die verwendete Reizfrequenz, die Reizintensität, die Stimulusform, die Anzahl und Dauer der applizierten Reizserien beschreiben. Wassermann, E.M., Risk and safety of repetitive transcranial magnetic stimulation: report and suggested guidelines from the international workshop on the safety of repetitive transcranial magnetic stimulation, June-7 [sic], 1996, Electroencephalogr. Clin. Neurophysiol., 108 (1998) 1-16 |
Der Autor verschleiert die zugrunde liegende Quelle durch geschicktes Weglassen von Satzbestandteilen bzw. durch Hinzufügen zusätzlicher Information. Diese wird in der gesamten Arbeit nicht genannt. Wegen der wörtlichen Übereinstimmungen wird der erste Satz trotz abweichender Bedeutung und unterschiedlichen Referenzen als Plagiat gewertet. Eine Aussage, dass „sich der Begriff rTMS auf die Applikation von mindestens zwei Einzelreizen“ bezieht, findet sich weder bei Wassermann et al. (1996) noch bei Wassermann (2000) so oder ähnlich. Darüber hinaus verwendet der Verf. im Literaturverzeichnis bei dem Titel des Aufsatzes von Wassermann (2000) eine Abkürzung, was mit wissenschaftlichen Gepflogenheiten nicht im Einklang steht; tatsächlich lautet dieser Side effects of repetitive transcranial magnetic stimulation. Fortsetzung in Fragment 023 03 auf der nächsten Seite. |
| [16.] Mek/Fragment 023 03 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 023, Zeilen: 03-06 |
Quelle: Peller 2002 Seite(n): 007, Zeilen: 21-25 |
|---|---|
| [Als biologischer Bezugspunkt für die Stärke der in präklinischen und klinischen Studien angewendeten TMS wird derzeit die motorische Reizschwelle gewählt.] Hierbei handelt es sich um diejenige Reizintensität, bei der mindestens die Hälfte der über dem primär motorischen Kortex applizierten Magnetstimuli im Zielmuskel (meist der M. abductor pollicis brevis) ein Potential (> 50 µV) auslösen (Rossini et al., 1994; Rossini & Rossi, 1998).
Rossini, P.M., Barker, A.T., Berardelli, A., Caramia, M.D., Caruso, G., Cracco, R.Q., Dimitrijevic, M.R., Hallett, M., Katayama, Y., Lücking, C.H., Maertens de Noordhout, A.L., Marsden, C.D., Murray, N.M.F., Swash, M. & Tomberg, C. (1994) Non- invasive [sic] electrical and magnetic stimulation of the brain, spinal cord and roots: basic principles and procedures for routine clinical application. Electroencephalography and clinical Neurophysiology, 91, 79-92. Rossini, P.M. & Rossi, S. (1998) Clinical applications of motor evoked potentials. Electroencephalography and clinical Neurophysiology, 106, 180-194. |
Die Stimulusintensität der rTMS wird entweder in Prozent der maximalen Stimulusintensität des Magnetstimulators oder in Prozent der motorischen Reizschwelle angegeben. Die motorische Reizschwelle ist die Stimulusintensität, bei der die Hälfte der applizierten Magnetstimuli im Zielmuskel eine motorische Antwort auslösen (Rossini et al., 1994: 79-92).
Rossini, P.M., Barker, A.T., Beradelli [sic], A., Caramia, M.D., Caruso, G., Cracco. [sic] R.Q., Dimitrijevic, M.R., Hallett, M., Katayama, Y., Lücking, H.C. [sic], Maertens de Noordhout, A.L., Marsden, C.D., Murray, N.M.F., Rothwell, J.C., Swash, M., Tomberg, C., Non-invasive electrical and magnetic stimulation of the brain, spinal cord and roots: basic principles and procedures for routine clinical application. Report of an IFCN committee, Electroencephal. Clin. Neurophysiol., 91 (1994) 79 - 92 |
Fortsetzung von Fragment 022 25 auf der Vorseite; die Quelle wird in der untersuchten Arbeit nicht genannt. Da der in eckige Klammern gesetzte erste Satz inhaltlich deutlich abweicht, wird er nicht als Plagiat gewertet. Vom Musculus abductor pollicis brevis bzw. von einer Spannung größer als 50 Mikrovolt o.ä. ist weder bei Rossini et al. (1994) noch bei Rossini & Rossi (1998) die Rede. Bei Rossini et al. (1994) fehlt beim Verf. zudem der Co-Autor Rothwell. |
| [17.] Mek/Fragment 025 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 025, Zeilen: 01-12 |
Quelle: Engelmann 2000 Seite(n): 002, 016, Zeilen: 002: 19-28; 016: 01-05 |
|---|---|
| 2 MATERIAL UND METHODEN
In diesem Abschnitt erfolgen allgemeine, studienübergreifende Angaben zu den im
Rahmen dieser Arbeit eingesetzten Methoden und Techniken. Detaillierte
Informationen zum Ablauf der Versuche werden in den jeweiligen Kapiteln gegeben. Engelmann, M., Ebner, K., Landgraf, R., Holsboer, F. & Wotjak, C.T. (1999) Emotional stress triggers intrahypothalamic but not peripheral release of oxytocin in male rats. Journal of Neuroendocrinology, 11, 867-872. Selye, H. (1950) Stress. Acta, Montreal. Selye, H. (1971) Hormones and resistance. Part I and II. Springer-Verlag, Berlin, Heidelberg, New York. |
[Seite 16]
2. Material und Methoden In diesem Abschnitt erfolgen allgemeine Angaben zu den im Rahmen dieser Arbeit eingesetzten Methoden und Techniken. Detaillierte Informationen zum Ablauf der Versuche werden in den Kapiteln gegeben, in denen die jeweiligen Studien vorgestellt werden. [Seite 2] In Anlehnung an Selye (1971) gilt in der vorliegenden Arbeit die Aktivierung der Hypothalamus-Adenohypophysen-Nebennierenrinden (HPA)-Achse [gemessen an einer erhöhten Plasmakonzentration des Adrenocorticotropen Hormons (ACTH) und/oder Corticosterons (Cort)] als hinreichendes Kriterium für eine Charakterisierung als Streß. Dabei wurde auf Grund von verschiedenen Voruntersuchungen (vgl. Engelmann et al., 1996a) festgelegt, daß Streß dann vorliegt, wenn unter den definierten Bedingungen 15 min nach Beginn der Stimulusexposition die mittlere ACTH-Konzentration im Plasma mehr als 100 pg/ml betrug. Mit dem Begriff Stressor wird der experimentell verabreichte Stimulus bezeichnet, der bei den Versuchstieren zu Streß führt. Engelmann, M., Trivikraman, K.V., You, S., Nemeroff, C.B., Montkowski, A., Landgraf, R., Holsboer, F., Plotsky, P.M. (1996a). Endocrine and behavioral effects of airpuff-startle in rats. Psychoneuroendocrinology 21, 391-400. Selye, H. (1971) Hormones and resistance. Part I and II. Springer-Verlag, Berlin, Heidelberg, New York. |
Der Autor referenziert zwar dieselbe Arbeit von Selye (1971), gibt jedoch deren Inhalte mit Engelmanns (2000) Worten wieder. Der von Engelmann angeführte Aufsatz bzgl. Voruntersuchungen hinsichtlich der Definition von Stress wird nicht erwähnt. Die eigentliche Quelle ist in der gesamten untersuchten Arbeit nirgends genannt. Bei diesem Fragment handelt es sich um den gesamten Einleitungstext zum Teil 2 vor Beginn des ersten Unterkapitels. |
| [18.] Mek/Fragment 025 13 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 025, Zeilen: 13-15, 20-30 |
Quelle: Schindele 2003 Seite(n): 29, Zeilen: 02-04, 05-12 |
|---|---|
| 2.1 Tiere und Tierhaltung
Als Versuchstiere dienten Wistar Ratten, die von einem kommerziellen Anbieter (Charles River, Sulzfeld, Deutschland) bezogen wurden. [...] Nach Anlieferung hatten die Tiere im Durchschnitt 7 Tage Zeit, sich im Tierstall des Max-Planck-lnstituts für Psychiatrie einzugewöhnen. Sie wurden in Gruppen zu 6 Tieren unter Standardbedingungen gehalten (Temperatur 22±2 °C, Luftfeuchtigkeit 60±5 %, 12 h Licht-Dunkel-Zyklus, wobei das Licht um 7.00 Uhr eingeschaltet wurde) mit freiem Zugang zu Futter und Wasser. Die Ratten wogen zum Zeitpunkt der Experimente bzw. operativen Eingriffe zwischen 250 und 400 g. Nach operativen Eingriffen wurden die Tiere einzeln in Plexiglaskäfigen (23 x 39 x 36 cm) gehalten. Bis zum jeweiligen Versuchsbeginn blieben jeweils mindestens drei Tage Zeit zur Erholung und Habituation an die veränderten Haltungsbedingungen. Sämtliche Versuche wurden von der Regierung von Oberbayern genehmigt. |
2.1 Tiere und Tierhaltung
Als Versuchstiere dienten junge männliche Wistar Ratten, die von einem kommerziellen Anbieter (Charles River, Sulzfeld, Deutschland) bezogen wurden (Alter: 3-4 Monate; n = 144). Nach Anlieferung hatten die Tiere im Durchschnitt 7 Tage Zeit, sich im Tierstall des Instituts einzugewöhnen. Sie wurden in Gruppen zu 6 Tieren unter Standardbedingungen gehalten (Temperatur 22 ± 2 °C, Luftfeuchtigkeit 60 ± 5 %, 12 h Licht-/12 h Dunkel-Zyklus, wobei das Licht um 7.00 Uhr eingeschaltet wurde) mit freiem Zugang zu Futter und Wasser. Die Ratten wogen zum Zeitpunkt der Operation zwischen 250 und 400 g. Nach der Operation wurden die Tiere einzeln in Plexiglaskäfige (23 x 39 x 36 cm) gesetzt. Bis zum Versuchsbeginn hatten sie dann 3 Tage Zeit sich zu erholen und an ihren neuen Käfig zu habituieren. Die Versuche wurden von der Regierung von Oberbayern genehmigt. |
Kein Hinweis auf die Quelle. Zwar nur die Versuchsbeschreibung, aber die Übereinstimmungen sind z.T. wörtlich und die Quelle ist nirgends in der untersuchten Arbeit genannt. In der Auslassung befindet sich Fragment 025 15, für das Erhardt (2003) als Quelle diente. |
| [19.] Mek/Fragment 025 15 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 025, Zeilen: 15-20 |
Quelle: Erhardt 2003 Seite(n): 020, Zeilen: 07-12 |
|---|---|
| Für die Experimente mit Morphinverabreichung wurden Sprague-Dawley Ratten im Alter von 3-4 Monaten und Gewicht von 200-250 g gewählt. Von dieser Rattenrasse existieren bereits grundlegende experimentelle Daten zur Dopaminfreisetzung im mesolimbischen System bei Drogenabhängigkeit und Sensibilisierung, die teilweise die Grundlage unserer Arbeitshypothesen bildeten. | Für die Experimente 3 (n=23) und 4 (n=14) mit Morphinverabreichung wurden Sprague-Dawley Ratten im Alter von 2-3 Monaten und Gewicht von 200-250 g (Charles River WIGA GmbH, Sulzfeld) gewählt. Von dieser Rattenrasse existieren bereits grundlegende experimentelle Daten zum Dopaminverhalten im mesolimbischen System bei Drogenabhängigkeit und Sensibilisierung, die teilweise die Grundlage unserer Arbeitshypothese bilden. |
Keine Quellennennung. |
| [20.] Mek/Fragment 026 03 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 26, Zeilen: 03-31 |
Quelle: Schindele 2003 Seite(n): 033-034, Zeilen: 033:06-26; 034:01-07 |
|---|---|
| Unter Zuhilfenahme eines Stereomikroskops (Olympus SZ30, Japan) wurde die rechte Vena jugularis freigelegt und durch einen kurzen Schnitt eröffnet. Der aus einem 3,5 cm langen Silikonschlauch bestehende Katheter (Silastic®, Dow Corning Cop. , Midland, USA: Durchmesser innen: 0,6 mm; Durchmesser außen: 1,2 mm), welcher 1,0 cm auf ein ca . 15 cm langes Stück Polyethylen-Schlauch (SIMS Portex®, Kent, England; Durchmesser: 0,58 mm) aufgezogen wurde, wurde durch die kleine Gefäßöffnung etwa 3 cm bis in den rechten Vorhof des Herzens eingeführt. Anschließend wurde der Katheter in das Blutgefäß eingenäht. Das andere Ende des Katheters wurde subkutan in den Nacken des Tieres geführt und durch die Haut nach außen geleitet, wo er mit einer Naht befestigt wurde. Abschließend wurde der Katheter mit einer antibiotikumshaltigen (Gentamicin 30000 IU/Ratte, Centravet, Bad Bentheim) und isotonen Kochsalzlösung (Pharmacia, Erlangen) gefüllt. Die Wunde wurde mit Metallclips verschlossen.
Am Morgen des Versuchstags wurde der über einen etwa 50 cm langen Polyethylen-Schlauch (SIMS Portex®, Kent, England; Durchmesser: 0,58 mm) mit einer 1-ml Plastikspritze verbunden. Zwei Stunden vor Versuchsbeginn wurde der Katheter mit steriler heparinisierter Kochsalzlösung (30 IU/ml isotoner Kochsalzlösung: Heparin-Natrium-25000-Ratiopharm®, Ratiopharm GmbH, Ulm) gespült. Die Plastikspritze befand sich außerhalb des Käfigs und ermöglichte somit eine für die Ratte störungsfreie Blutentnahme. Nach dem Anschließen und initialem Spülen hatten die Tiere mindestens zwei Stunden Zeit sich an die experimentellen Bedingungen zu gewöhnen. Zu definierten Zeitpunkten wurden 0,8 ml (für die Bestimmung von ACTH, Kortikosteron und AVP) bzw. 0,3 ml (für die Bestimmung von ACTH und Kortikosteron) Blut in die Plastikspritze aufgenommen. Unmittelbar danach wurde den Tieren das gleiche Volumen steriler, isotoner Kochsalzlösung (Pharmacia, Erlangen, Deutschland) reinfundiert Die Blutproben wurden in eisgekühlte, EDTA-beschichtete Tubes (EDTA 1000A, KABE Labortechnik GmbH, Nümbrecht-Eisenroth) gegeben, die 10 µl Trasylol® (10000 KIE/ml, Bayer AG, Leverkusen) als [Proteaseinhibitor enthielten.] |
Unter Zuhilfenahme eines Stereomikroskops (Olympus SZ30, Japan) wurde die rechte Vena jugularis freigelegt und durch einen kurzen Schnitt eröffnet. Der aus einem 3,5 cm langen Silikonschlauch bestehende Katheter (Silastic®, Dow Corning Cop., Midland, USA: Durchmesser innen: 0,6 mm; Durchmesser außen: 1,2 mm), welcher 1,0 cm auf ein ca. 15 cm langes Stück Polythene-Schlauch (SIMS Portex®, Kent, England; Durchmesser: 0,58 mm) aufgezogen wurde, wurde durch die kleine Gefäßöffnung etwa 3 cm bis in den rechten Vorhof des Herzens eingeführt. Anschließend wurde der Katheter in das Blutgefäß eingenäht. Das andere Ende des Katheters wurde subkutan in den Nacken des Tieres geführt und durch die Haut nach außen geleitet, wo er mit einer Naht befestigt wurde. Abschließend wurde der Katheter mit einer antibiotikumhaltigen (Gentamicin 30000 IU/Ratte, Centravet, Bad Bentheim, Deutschland) und isotonen Kochsalzlösung (Pharmacia, Erlangen, Deutschland) gefüllt. Die Wunde wurde mit Metallclips und der Katheter durch Abknicken verschlossen.
[...] Am Morgen des Versuchstags wurde der Jugularvenenkatheter über einen etwa 50 cm langen Polythene-Schlauch (SIMS Portex®, Kent, England; Durchmesser: 0,58 mm) mit einer 1-ml Plastikspritze verbunden. Zwei Stunden vor Versuchsbeginn wurde der Katheter mit steriler heparinisierter Kochsalzlösung (30 IU/ml isotoner Kochsalzlösung: Heparin-Natrium-25000- Ratiopharm®, Ratiopharm GmbH, Ulm, Deutschland) gespült. Die Plastikspritze befand sich außerhalb des Käfigs und ermöglichte somit eine für die Ratte störungsfreie Blutentnahme. Nach dem Anschließen und initialem Spülen hatten die Tiere zwei Stunden Zeit sich an die experimentellen Bedingungen zu gewöhnen. [Seite 34] Zu definierten Zeitpunkten wurden 0,8 ml (für die Bestimmung von ACTH, CORT und AVP) bzw. 0,3 ml (für die Bestimmung von ACTH und CORT) Blut in die Plastikspritze aufgenommen. Unmittelbar danach wurde den Tieren das gleiche Volumen steriler, isotoner Kochsalzlösung (Pharmacia, Erlangen, Deutschland) reinfundiert. Die Blutproben wurden in eisgekühlte, EDTA-beschichtete Tubes (EDTA 1000A, KABE Labortechnik GmbH, Nümbrecht-Eisenroth, Deutschland) gegeben, die 10 µl Trasylol® (10000 KIE/ml, Bayer AG, Leverkusen, Deutschland) als Proteaseinhibitor enthielten. |
Ein Verweis auf die Quelle fehlt. |
| [21.] Mek/Fragment 027 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 027, Zeilen: 01-07, 10-21 |
Quelle: Schindele 2003 Seite(n): 031, 034, Zeilen: 031: 01-16; 034: 07-10 |
|---|---|
| Anschließend wurden sie für 5 Minuten bei 4000 Umdrehungen pro Minute und 4 °C zentrifugiert (Zentrifuge: Z233MK, Hermle GmbH, Wehingen). Das Plasma wurde für die Analyse von AVP (180 µl), ACTH (80 µl) Kortikosteron (10 µl), Prolaktin (100 µl), Oxytozin (200 µl), Testosteron (100 µl) und Laktat (80 µl) aliquotiert und bei -20 °C aufbewahrt.
2.2.2 Mikrodialyse Die chirurgische Implantation der selbstgebauten, U-förmigen Mikrodialyse-Sonde [(die U-förmige Membran kann von Substanzen mit einem Molekulargewicht kleiner als 18 kDa passiert werden und weist eine relative Durchlassrate von etwa 2% in vitro auf)] erfolgte unter tiefer Halothan-Narkose (Hoechst AG, Frankfurt am Main). Zum allgemeinen Ablauf der Operation gehörte keimarmes Arbeiten und eine postoperative Versorgung der Tiere mit einem Depot-Antibiotikum (Tardomycel®, 0,01 ml/100g Körpergewicht, Bayer AG, Leverkusen) subkutan. Vor dem operativen Eingriff wurde die Kopfhaut mit einem Lokalanästhetikum (Xylocain) besprüht und mit Cutasept® F desinfiziert. Das tief narkotisierte Tier wurde in einen stereotaktischen Apparat (Stoelting, USA) eingespannt. Mit Hilfe eines Skalpells wurde die Kopfhaut samt darunter liegendem Bindegewebe bis auf die Kalotte durchtrennt und das Bregma dargestellt. Auf das Bregma als den Schnittpunkt der Sutura coronalis und der Sutura sagittalis wurde der Stereotakt zunächst fixiert. Anschließend wurden folgende Koordinaten eingestellt, die aus einem stereotaktischen Atlas (Paxinos & Watson, 1986) erhoben und operateurspezifisch adaptiert wurden: |
[Seite 031]
2.2.2 Chirurgische Implantation der Mikrodialyse-Sonde Die chirurgische Implantation der selbstgebauten, U-förmigen Mikrodialyse-Sonde erfolgte unter tiefer Halothan-Narkose (Hoechst AG, Frankfurt am Main, Deutschland). Zum allgemeinen Ablauf der Operation gehörte keimarmes Arbeiten und eine postoperative Versorgung der Tiere mit einem Depot-Antibiotikum (Tardomycel®, 0,01 ml/100g Körpergewicht, Bayer AG, Leverkusen, Deutschland) subkutan. Vor dem operativen Eingriff wurde die Kopfhaut mit einem Lokalanästhetikum (Xylocain®) besprüht und mit Cutasept® F desinfiziert. Es wurde großer Wert darauf gelegt, dass die Operation für die Tiere möglichst atraumatisch war. Das tief narkotisierte Tier wurde in einen stereotaktischen Apparat (Stoelting, USA) eingespannt. Mit Hilfe eines Skalpells wurde die Kopfhaut samt darunterliegendem Bindegewebe bis auf die Kalotte durchtrennt und das Bregma dargestellt. Auf das Bregma als den Schnittpunkt der Sutura coronalis und der Sutura sagittalis (Paxinos & Watson, 1986) wurde der Stereotakt zunächst fixiert. Anschließend wurden folgende Koordinaten eingestellt, die aus einem stereotaktischen Atlas (Paxinos & Watson, 1986) erhoben und operateurspezifisch adaptiert wurden: [Seite 034] Anschließend wurden sie für 5 Minuten bei 4000 rpm und 4 °C zentrifugiert (Zentrifuge:: Z233MK, Hermle GmbH, Wehingen, Deutschland). Das Plasma wurde für die Analyse von AVP (180 µl), ACTH (80 µl) und CORT (10 µl) aliquotiert und bei -20 °C aufbewahrt. |
Kein Hinweis auf die Quelle. Ein ergänzender Klammerzusatz zu Beginn von Kap. 2.2.2 geht nicht mit in die Zeilenzählung ein. Der Autor verwendet anstelle der internationalen Abkürzung "CORT" lieber "Kortikosteron"; anstelle "rpm" verwendet er "Umdrehungen pro Minute". Die Spaltenüberschriften sowie die drei ersten Zeilen der Tabelle finden sich in der Quelle Erhardt (2003); siehe Fragment 027 22 (keine Wertung). |
| [22.] Mek/Fragment 028 00 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 028, Zeilen: Abb. 1 |
Quelle: Erhardt 2003 Seite(n): 022, Zeilen: 04 |
|---|---|

|

|
Kopie der Abbildung ohne Quellenangabe. |
| [23.] Mek/Fragment 028 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 028, Zeilen: 01 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 031, 032, Zeilen: 031:19-21,23-26; 032:01-13 |
|---|---|
| Um eine Läsion des Sinus sagittalis superior zu vermeiden und möglichst wenig Hirngewebe zu beschädigen, wurde die Sonde in einem Seitwinkel von 10° implantiert.
[Abb. 1] Mit einem Dentalbohrer (Durchmesser 1,2 mm) wurden die Durchtrittsstelle für die Mikrodialyse-Sonde und zwei Löcher für die beiden zur Fixierung des Implantats dienenden Titan-Mikroschrauben in den Schädelknochen gebohrt. Nach der stereotaktischen Einführung der Sonde wurde das Implantat mit Hilfe von lichthärtendem, dualem Zahnzement (Twinlook® cement, Kulzer, Dormagen) an den beiden Schrauben und der Kalotte befestigt. Auf die beiden Kanülenenden der Mikrodialyse-Sonde wurden zwei etwa 4,5 cm lange Polyethylen-Schläuche (SIMS Portex®, Kent, England; Durchmesser: 0,38 mm) aufgesteckt und mit Hilfe von Zahnzement (Kallocryl® CPGM, Dr. Speier GmbH, Münster) mit dem Implantat verbunden. Abschließend wurde die Wunde desinfiziert (Braunol®, Braun Melsungen AG, Melsungen). Am Tag des Experiments wurden die Ratten an die Mikrodialyse angeschlossen: Die um 45° nach außen gebogene Kanüle wurde mit einem Eppendorf-Tube zum Auffangen der Dialyseflüssigkeit verschlossen. Die gerade Kanüle wurde über einen ca. 1 m langen Polyethylen-Schlauch (SIMS Portex®, Kent, England; Durchmesser: 0,38 mm) mit einer Mikroperfusionspumpe (TSE-Systems, E 540220, Bad Homburg, [Deutschland) verbunden.] |
[...]
"Winkel": Um eine Zerstörung des Sinus sagittalis zu vermeiden und möglichst wenig Hirngewebe zu beschädigen, wurde die Sonde in einem Seitwinkel von 10° implantiert. [...] Mit einem Dentalbohrer (Durchmesser 1,2 mm) wurde die Durchtrittsstelle für die Mikrodialyse-Sonde und zwei Löcher für die beiden zur Fixierung des Implantats dienenden rostfreien Mikroschrauben in den Schädelknochen gebohrt. Nach der Einführung der Sonde mittels des Stereotakten wurde das Implantat mit Hilfe von lichthärtendem, dualem [Seite 32] Zahnzement (Twinlook® cement, Kulzer, Dormagen, Deutschland) an den beiden Schrauben und der Schädelkalotte befestigt. Auf die beiden Kanülenenden der Mikrodialyse-Sonde wurden zwei etwa, 4,5 cm lange Polythene-Schläuche (SIMS Portex®, Kent, England; Durchmesser: 0,38 mm) aufgesteckt und mit Hilfe von rotem Zahnzement (Kallocryl® CPGM, Dr, Speier GmbH, Münster, Deutschland) mit dem Implantat verbunden. Das System wurde zuvor mit Ringer-Lösung gespült und auf Durchgängigkeit überprüft Abschließend wurde die Wunde desinfiziert (Braunol®, Braun Melsungen AG, Melsungen, Deutschland). 2.2.3. Experimenteller Ablauf der Mikrodialyse Drei Tage später, am Tag des Experiments, wurden die Ratten an die Mikrodialyse angeschlossen: Die um 45° nach außen gebogene Kanüle wurde mit einem Eppendorf-Tube zum Auffangen der Dialyseflüssigkeit verschlossen. Die gerade Kanüle wurde über einen ca. 3 m langen Polythene-Schlauch (SIMS Portex®, Kent, England; Durchmesser. 0,38 mm) mit einer Mikroperfusionspumpe (TSE-Systems, E 540220, Bad Homburg, Deutschland) verbunden. |
Die Beschreibung von "Winkel" taucht bei Schindele 2003 als Tabellenlegende auf, in der untersuchten Arbeit im Fließtext. |
| [24.] Mek/Fragment 029 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 029, Zeilen: 01-12 |
Quelle: Schindele 2003 Seite(n): 32, Zeilen: 13-20 |
|---|---|
| In die Pumpe wurden Präzisionsglasspritzen (2,5 ml, Hamilton, Schweiz) eingelegt, die luftblasenfrei mit steriler Ringer-Lösung (Fresenius AG, Bad Homburg) gefüllt waren. Die Dialysegeschwindigkeit betrug 200 μl/h. Vor dem Beginn des eigentlichen Versuchs wurden die Mikrodialyse-Sonden mindestens 2 Stunden perfundiert, um eine Adaption des Hirngewebes an den Dialysevorgang zu gewährleisten. Während dieser Zeit stellt sich ein Gleichgewicht zwischen dem Dialysemedium und der extrazellulären Flüssigkeit ein.
Während des Experiments wurden alle 30 Minuten die Eppendorf-Tubes (1,5 ml, Eppendorf-Netheler-Hinz GmbH, Hamburg) gewechselt. In jedem Reaktionsgefäß befanden sich zur Stabilisierung der Peptide in der Dialyseflüssigkeit 10 μl einer 0,1 N HCl-Lösung. Die Tubes mit den Dialysaten wurden sofort zentrifugiert, auf Trockeneis gelagert und bei -20 °C eingefroren. [Abb. 2] |
In die Pumpe wurden Präzisionsglasspritzen (2,5 ml, Hamilton, Schweiz) eingelegt, die luftblasenfrei mit steriler Ringer-Lösung (Fresenius AG, Bad Homburg, Deutschland) gefüllt waren. Die Dialysegeschwindigkeit betrug 200 μl/h. Vor dem Beginn des eigentlichen Versuchs wurden die Mikrodialyse-Sonden 2 Stunden perfundiert, um eine Adaption des Hirngewebes an den Dialysevorgang zu gewährleisten. Während dieser Zeit stellt sich ein Gleichgewicht zwischen dem Dialysemedium und der extrazellulären Flüssigkeit ein.
Während des Experiments wurden alle 30 Minuten die Eppendorf-Tubes (1,5 ml, Eppendorf- Netheler-Hinz GmbH, Hamburg, Deutschland) gewechselt. In jedem Reaktionsgefäß befanden sich zur Stabilisierung der Peptide in der Dialyseflüssigkeit 10 μl einer 0,1 N HCl-Lösung. Die Tubes mit den Dialysaten wurden sofort zentrifugiert, auf Trockeneis gelagert und bei -20 °C eingefroren. |
Die Quelle ist nicht angegeben. |
| [25.] Mek/Fragment 030 12 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 030, Zeilen: 12-30 |
Quelle: Schindele 2003 Seite(n): 034-037, Zeilen: 034:18-22; 035:01-18; 036:01-25; 037:01-02 |
|---|---|
| Alprazolam (8-Chlor-1-methyl-6-phenyl-4H-[1,2,4]-triazolo[4,3-a][1,4] benzodiazepin; C17H13CIN4) ist ein sog. Triazolobenzodiazepin, d.h. ein Triazolring (ein 5er-Ring mit 3 Stickstoffen) ist in die Struktur der Benzodiazepine eingebaut. Alprazolam ist ein mittellangwirkendes Benzodiazepin mit einer Halbwertszeit von 10 bis 15 Stunden bei oraler Gabe beim Menschen (Söderpalm, 1987), allerdings nur annäherungsweise 30-60 Minuten bei Ratten, da diese eine wesentlich größere metabolische Kapazität als Menschen aufweisen (Skelton et al., 2000c). Bei Alprazolam wurden mehrere Metabolite identifiziert: α-Hydroxyalprazolam, 4-Hydroxyalprazolam, Desmethylalprazolam sowie 26 weitere Metabolite. Auf Grund ihrer raschen Clearance entfalten diese Metabolite jedoch keine bedeutsame biologische Aktivität.
Temazepam (7-Chlor-3-hydroxy-1-methyl-5-phenyl-1H-1,4-benzodiazepin-2(3H)-on; C16H13CIN2O2, Hydroxydiazepam) entsteht in einem Nebenstoffwechselweg beim Abbau von Diazepam. Temazepam ist ein Vertreter der mittellangwirkenden Benzodiazepine mit einer Halbwertszeit von 5 bis 13 Stunden bei oraler Gabe beim Menschen. Alprazolam (A 8800, Sigma-Aldrich, Taufkirchen) und Temazepam (T 8275, Sigma-Aldrich) wurden als Reinsubstanz bezogen (Erlaubnis nach § 3 des Betäubungsmittelgesetzes, BtM-Nummer 322 83 30, 14.04.2000) und in einer Konzentration von 2 mg/ml gelöst (Eltrosonic Type 07 Ultracleaner, Wiesbaden). Skelton, K.H., Nemeroff, C.B. & Owens, M.J. (2000c) [sic] A comparison of plasma alprazolam concentrations folowing [sic] different routes of chronic administration in the Sprague- Dawley rat: implications for psychotropic drug research. Psychopharmacology, 151, 76. Söderpalm, B. (1987) Pharmacology of the benzodiazepines; with special emphasis on alprazolam. Acta Psychiatrica Scandinavica, 76, 39-46. |
[Seite 034]
Bei Alprazolam wurden mehrere Metabolite identifiziert: a-Hydroxyalprazolam, 4-Hydroxyalprazolam, Desmethylalprazolam sowie 26 weitere Metabolite. Auf Grund ihrer raschen Clearance verursachen diese Metabolite keine bedeutsame biologische Aktivität (Abemethy et al., 1983; Dawson et al., 1984; Greenblatt et al., 1993). [Seite 35] 2.4.1 Alprazolam 8-Chlor-1-methyl-6-phenyl-4H-[1,2,4]-triazolo[4,3-a][1,4] benzodiazepin C17H13CIN4 [...] Es ist ein sog. Triazolobenzodiazepin. Ein Triazolring (ein 5er-Ring mit 3 Stickstoffen) ist in die Struktur der Benzodiazepine eingebaut. Alprazolam ist ein mittellangwirkendes Benzodiazepin mit einer Halbwertszeit von 10 bis 15 Stunden bei oraler Gabe beim Menschen (Dawson et al., 1984; Smith et al., 1984; Söderpalm, 1987), allerdings nur annäherungsweise 30-60 Minuten bei Ratten (Lau & Heatherington, 1997; Skelton et al., 2000b). Ratten haben eine wesentlich größere metabolische Kapazität als Menschen und eliminieren deshalb Benzodiazepine deutlich rascher (Skelton et al., 2000b).
2.4.2 Temazepam 7-Chlor-3-hydroxy-1-methyl-5-phenyl-1H-1,4-benzodiazepin-2(3H)-on C16H13CIN2O2 Hydroxydiazepam Temazepam entsteht in einem Nebenstoffwechselweg beim Abbau von Diazepam. [...] Temazepam ist ein Vertreter der mittellangwirkenden Benzodiazepine mit einer Halbwertszeit von 5 bis 13 Stunden bei oraler Gabe beim Menschen. [...] Alprazolam (A 8800, Sigma-Aldrich, Taufkirchen, Deutschland) und Temazepam (T 8275, Sigma-Aldrich, Taufkirchen, Deutschland) wurden als Reinsubstanz bezogen (Erlaubnis nach § 3 des Betäubungsmittelgesetzes, BtM-Nummer 322 83 30, 14.04.2000) und in einer [Seite 037] Konzentration von 2 mg/ml gelöst (Eltrosonic Type 07 Ultracleaner, Wiesbaden, Deutschland). Die Lösung bestand aus 55 % Propylenglycol12 (= 1,2-Propanediol, P 1009, Sigma-Aldrich, Taufkirchen, Deutschland) und 45 % Aqua destillata. 12 [...] Abernethy D R, Greenblatt D J, Divoll M und Shader R I (1983) Pharmacokinetics of alprazolam, in: Journal of Clinical Psychiatry 44 (Sec. 2): 45-47. Dawson G W, Jue S G und Brogden R N (1984) Alprazolam. A review of its pharmacodynamic properties and efficacy in the treatment of anxiety and depression, in: Drugs 27: 132-147. Greenblatt D J, von Moltke L L, Harmatz J S, Ciraulo D A und Shader R I (1993) Alprazolam pharmacokinetics, metabolism, and plasma levels. Clinical implications, in: Journal of Clinical Psychiatry 54 (Suppl.IO): 4-14. Lau C E und Heatherington A C (1997) Pharmacokinetic-pharmacodynamic modeling of stimulatory and sedative effects of alprazolam. Timing performance deficits, in: Journal of Pharmacology and Experimental Therapeutics 283: 1119-1129. Skelton K H, Nemeroff C B und Owens M J (2000b) A comparison of plasma alprazolam concentrations following different routes of chronic administration in the Sprague-Dawley rat. Implications for psychotropic drug research, in: Psychopharmacology 151:72-76. Smith R B, Kroboth P D, Vanderlugt J T, Phillips J P und Juhl R P (1984) Pharmacokinetics and pharmacodynamics of alprazolam after oral und IV administration, in: Psychopharmacology 84: 452-456. Söderpalm B (1987) Pharmacology of the benzodiazepines. With special emphasis on alprazolam, in: Acta Psychiatrica Scandinavica 76(Suppl. 335): 39-46. |
Der Text ist erheblich verkürzt, aber ansonsten wörtlich übernommen. Skelton et al. wird als (2000c) in der untersuchte Arbeit gesigelt, aber es gibt weder 2000a noch 2000b für dieses Autorenkollektiv. In Schindele 2003 wird (2000a) für eine Arbeit von Skelton, Nemeroff, Knight und Owens verwendet. |
| [26.] Mek/Fragment 031 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 031, Zeilen: 01-03 |
Quelle: Schindele 2003 Seite(n): 37, Zeilen: 02-04 |
|---|---|
| [Die] Lösung bestand aus 55 % Propylenglycol (= 1,2-Propanediol, P 1009, Sigma-Aldrich) und 45% Aqua destillata. Abschließend wurde mit 0,1 M NaOH bzw. 0,1 M HCl der pH auf ca. 7,4 eingestellt. | [Die] Lösung bestand aus 55 % Propylenglycol12 (= 1,2-Propanediol, P 1009, Sigma-Aldrich, Taufkirchen, Deutschland) und 45 % Aqua destillata. Abschließend wurde mit 0,1 M NaOH bzw. 0,1 M HCl der pH auf ca. 7,4 eingestellt.
12 Klockowski berichtet von Versuchen [sic] um die Löslichkeit von Benzodiazepinen zu testen (Klockowski & Levy, 1988). Auch Propylenglycol war dazu geeignet. Es zeigte bei eigenen Vorversuchen im Rahmen dieser Dissertation die beste Auflösung sowohl von Alprazolam als auch von Temazepam, die über einige Tage stabil waren und nicht wieder ausfielen. |
Kein Hinweis auf die Quelle. |
| [27.] Mek/Fragment 031 05 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 031, Zeilen: 05-31 |
Quelle: Erhardt 2003 Seite(n): 20-21, 27, Zeilen: 20:22-28; 21: 06-08; 027:04-22 |
|---|---|
| Für die Experimente wurde ein kommerzielles Stimulationsgerät verwendet (MagPro® der Firma DANTEC, Skovlunde, Dänemark). Die Impulsbreite des biphasisch konfigurierten Stimulus betrug 280ps. Die Stimulationsintensität wurde in A/ps gemessen. Der verwendete Prototyp einer runden Stimulationsspule (S60, DANTEC) hatte folgende Maße: innerer Durchmesser 6 mm, äußerer Durchmesser 57 mm; 21 Windungen, Windungshöhe 7 mm, Kabellänge 1,40 m.
Bei anästhesierten Tieren wurden insgesamt 1000 Stimuli, resultierend aus 20 Stimulationsdurchgängen (sog. trains), appliziert. Der maximale Induktionsmodulus mit einer Frequenz von 20 Hz für 2,5 s betrug dabei 4 Tesla (120 A/ps; 130% der motorischen Schwelle bei Ratten). Die Stimulationsparameter sowie der verwendete Spulenprototyp wurden gemäß Kernspintomographie-basierter, computergestützter Berechnungen der intrazerebralen Stromdichte gewählt (De Leo et al., 1992; Cerri et al., 1995; Ravazzani et al., 1996). Um klinische Standardbedingungen nachzuahmen (George et al., 1996; Padberg & Möller, 2003), wurde die Stimulationsspule über dem linken frontalen Kortex platziert. Die Stimulationsspule hatte direkten Kontakt zum Kopf der Tiere. Um Hitzeschäden an der Stimulationsspule zu vermeiden, musste nach jeder Stimulation ein Kühlintervall von etwa 2,5 Minuten eingelegt werden. Die Spule wurde mit Hilfe von Trockeneis auf jeweils 15 °C abgekühlt. Behandlung anästhesierter Tiere: Die Ratten wurden für die gesamte Dauer des Experiments mit einer einmaligen Urethan-Injektion anästhesiert (Ethylcarbamat, 1,4 g/kg KG, i.p.). Urethan wurde gewählt, weil diese Substanz nur schwache depressorische Wirkung auf das kardiovaskuläre und respiratorische System aufweist und Spinal- sowie Atemreflexe nicht beeinträchtigt werden. Hierdurch konnte während der angestrebten Narkose von etwa 8 Stunden auf eine endotracheale Intubation verzichtet werden. Die Tiere befanden sich während des Experiments auf einer Wärmedecke, um eine Auskühlung zu vermeiden. Die Körpertemperatur wurde kontinuierlich mit einer Thermostatprobe rektal gemessen [und auf einem Wert von 37,5 °C gehalten.] De Leo, R. , Cerri, G., Balducci, D., Moglie, F. , Scarpino, 0 . & Guidi, M. (1992) Computer modelling of brain cortex excitation by magnetic field pulses. Journal of Medical Engineering & Technology, 16, 149-156. Cerri, G., De Leo, R., Moglie, F. & Schiavoni, A. (1995) An accurate 3-D model for magnetic stimualtion of the brain cortex. Journal of Medical Engineering & Technology, 19, 7-16. Ravazzani, P., Ruohonen, J., Grandori, F. & Tognola, G . (1996) Magnetic stimulation of the nervous system. Induced electric field in unbounded, semiinfinite, sperical and cylindrical media. Annals of Biomedical Engineering, 24, 606-616. George, M.S., Wassermann, E.M. , Williams, W .A., Steppel, J., Pascuai-Leone, A. , Basser, P., Hallett, M. & Post, R.M. (1996) Changes in mood and hormone levels after rapid- rate transcranial magnetic stimulation (rTMS) of the prefrontal cortex. The Journal of Neuropsychiatry and Clinical Neurosciences, 8, 172-180. Padberg, F. & Möller, H.J. (2003) rTMS: does it have potential in the treatment of depression? CNS Drugs, 17, 383-403. |
[Seite 27]
Für die Experimente wurde ein kommerzielles Stimulationsgerät verwendet (MagPro® der Firma DANTEC, Skovlunde, Dänemark). Die Impulsbreite des biphasisch konfigurierten Stimulus betrug 280ps. Die Stimulationsintensität wurde in A/ps gemessen. Der verwendete Prototyp einer runden Stimulationsspule (S60, DANTEC) hatte folgende Maße: innerer Durchmesser 6 mm, äußerer Durchmesser 57 mm; 21 Windungen, Windungshöhe 7 mm, Kabellänge 1,40 m. Bei anästhesierten Tieren (Experiment 1) wurden insgesamt 1000 Stimuli, resultierend aus 20 Stimulationsdurchgängen, appliziert. Der maximale Induktionsmodulus mit einer Frequenz von 20 Hz für 2,5 s betrug dabei 4 Tesla (120 A/ps; 130% der motorischen Schwelle bei Ratten; Müller et al. 2000). Diese Stimulationsparameter wurden gemäss Kernspintomographie-basierter, computergestützter Berechnungen der intrazerebralen Stromdichte gewählt (Keck et al. 2002; Keck et al. 2000a,b, 2001). Um klinische Standardbedingungen nachzuahmen (Pascual-Leone et al. 1996), wurde die Stimulationsspule gemäss der Angaben des Atlas von Green (1963) über dem linken frontalen Kortex (d.h. über dem linken Auge der Ratte), plaziert. Die Stimulationsspule hatte direkten Kontakt zum Kopf der Tiere. Um Hitzeschäden an der Stimulationsspule zu vermeiden, musste nach jeder Stimulation ein Kühlintervall von etwa 2,5 min eingelegt werden. Die Spule wurde mit Hilfe von Trockeneis auf jeweils 15 C° abgekühlt. [Seite 020] Die Ratten wurden für die gesamte Dauer des Experiments 1 mit einer einmaligen Urethan-Injektion anästhesiert (Ethylcarbamat, 1,4 g/kg KG, i.p.). Urethan wurde gewählt, weil diese Substanz nur schwache depressorische Wirkung auf das kardiovaskuläre und respiratorische System aufweist und Spinal- sowie Atemreflexe nicht beeinträchtigt werden (Dalo und Larson 1990). Hierdurch konnte während der angestrebten Narkose von etwa 8 Stunden auf eine endotracheale Intubation verzichtet werden. [Seite 021] Die Tiere befanden sich während des Experiments auf einer Wärmedecke, um eine Auskühlung zu vermeiden. Die Körpertemperatur wurde kontinuierlich mit einer Thermostatprobe rektal gemessen und auf einem Wert von 37,5 °C gehalten. Müller, M. B., N. Toschi, Kresse A. E., Post A. und Keck M. E. (2000). "Long-term repetitive transcranial magnetic stimulation increases the expression of brain-derived neurotrophic factor and cholecystokinin mRNA, but not neuropeptide tyrosine mRNA in specific areas of rat brain." Neuropsychopharmacology 23(2): 205-215. Keck M. E., T. Welt, Muller M. B., Erhardt A., Ohl F., Toschi N., Holsboer F. und Sillaber I. (2002). "Repetitive transcranial magnetic stimulation increases the release of dopamine in the mesolimbic and mesostriatal system." Neuropharmacology 43(1): 101-109. Keck M. E., M. Engelmann, Muller M. B., Henniger M. S. H., Hermann B., Rupprecht R., Neumann I. D., Toschi N., Landgraf R. und Post A. (2000a). "Repetitive transcranial magnetic stimulation induces active coping strategies and attenuates the neuroendocrine stress response in rats." Journal of Psychiatric Research 34(4-5): 265-276. Keck, M. E., M. Hatzinger, Wotjak C. T., Landgraf R., Holsboer F. und Neumann I. D. (2000b). "Ageing alters intrahypothalamic release patterns of vasopressin and oxytocin in rats ." European Journal of Neuroscience 12(4): 1487-1494. Keck, M. E., T. Welt, Post A., Muller A. B., Toschi N., Wigger A., Landgraf R., Holsboer F. und Engelmann M. (2001). "Neuroendocrine and behavioral effects of repetitive transcranial magnetic stimulation in a psychopathological animal model are suggestive of antidepressant-like effects." Neuropsychopharmacoloqy 24(4): 337-349. Pascual-Leone, A., B. Rubio, Pallardo F. und Gatala M. D. (1996). "Rapid-rate transcranial magnetic stimulation of left dorsolateral prefrontal cortex in drugresistant depression." Lancet 348(9022): 233-7. Dalo, N. L. und A. A. Larson (1990). "Effects of urethane and ketamine on substance P- and excitatory amino acid-induced behavior in mice." European Journal of Pharmacology 184(1): 173-7. |
Kopie ohne Quellenangabe. |
| [28.] Mek/Fragment 032 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 032, Zeilen: 01-31 |
Quelle: Erhardt 2003 Seite(n): 021 + 028, Zeilen: 021:07-10; 028:01ff. |
|---|---|
| [Die Körpertemperatur wurde kontinuierlich mit einer Thermostatprobe rektal gemessen] und auf einem Wert von 37,5 °C gehalten. Die Tiefe der Narkose wurde durch die Auslösbarkeit des Kornealreflexes überprüft und eventuelle Abweichungen im Experimentprotokoll notiert.
Behandlung wacher Tiere: In rTMS-Pilotstudien an adulten Tieren, die nicht an die Stimulationsbedingungen gewöhnt waren, zeigten diese eine ausgeprägte Stressantwort, die sich in aggressivem Verhalten und motorischer Unruhe äußerte. Um die Stressreaktion im Experiment abzumildern, wurden die Ratten daher über zwei Wochen zweimal täglich an die Stimulationsbedingungen gewöhnt. Insbesondere waren 3 Faktoren wichtig: • Gewöhnung an den Menschen und an die Sitzposition in den Händen, • Gewöhnung an das rTMS-Geräuschartefakt, • wiederholte, linksfrontale Positionierung der Reizspule auf dem Kopf des Tieres. Demzufolge bestand das Handling aus dem Habituieren der Tiere an die Position in den menschlichen Händen (siehe Abb. 3), aus dem Aufsetzen der Stimulationskelle über dem linken Auge sowie aus der Applikation der rTMS- verursachten Geräuschartefakte im Raum. Der Erfolg der Gewöhnung zeigte sich daran, dass sich die Tiere während des Verabreichens von 300 Stimuli resultierend aus 6 Stimulationsfolgen (engl, trains) ruhig verhielten. Entsprechend dem Ablauf des Handlings, wurde der Kopf der Ratte während der 2,5 s langen Stimulationsfolge mit zwei Fingern leicht fixiert. Da rTMS eine direkte muskuläre Erregung der Kaumuskulatur auslöst, war bei den Tieren während der Stimulation ein leichter Kopftremor zu beobachten. Im anschließenden 2,5 Minuten langen Kühlintervall konnten die Tiere sich frei bewegen. Da das Handling durch die Stresshormonfreisetzung auch die intrazerebrale Ausschüttung von Dopamin beeinflussen kann (Barrot et al., 2000; Barrot et al., 2001), wurde eine Kontrollgruppe den gleichen Experimentbedingungen ausgesetzt wie die rTMS-Gruppe. Die scheinstimulierten Ratten (engl, sham Stimulation) wurden hierbei unter typischer Positionierung in den Experimentatorhänden dem akustischen Artefakt sowie dem „Tremorartefakt“ ausgesetzt. Dabei betrug die Entfernung der Stimulationsspule zum Kopf 10 cm. Barrot, M., Marinelli, M., Abrous, D.N., Rouge-Pont, F., Le Moal, M. & Piazza, P.V. (2000) The dopaminergic hyper-responsiveness of the shell of the nucleus accumbens is hormone-dependent. European Journal of Neuroscience, 12, 973-979. Barrot, M., Abrous, D.N., Marinelli, M., Rouge-Pont, F., Le Moal, M. & Piazza, P.V. (2001) lnfluence of glucocorticoids on dopaminergic transmission in the rat dorsolateral striatum. European Journal of Neuroscience, 13, 812-818. |
Die Körpertemperatur wurde kontinuierlich mit einer Thermostatprobe rektal gemessen und auf einem Wert von 37,5 °C gehalten. Die Tiefe der Narkose wurde durch die Auslösbarkeit des Kornealreflexes überprüft und eventuelle Abweichungen im Experimentprotokoll notiert.
[Seite 28] 2.6.2 Stimulation an wachen Tieren In rTMS-Pilotstudien an adulten Tieren, die nicht an die Stimulationsbedingungen gewöhnt waren, zeigten diese eine ausgeprägte Stressantwort, die sich in aggressivem Verhalten und motorischer Unruhe äußerte. [...] Um die Stressreaktion im Experiment abzumildern, wurden die Ratten über zwei Wochen zweimal täglich an die Stimulationsbedingungen gewöhnt. Insbesondere waren 3 Faktoren wichtig: • Gewöhnung an den Menschen und an die Sitzposition in den Händen • Gewöhnung an das rTMS-Geräusch • Wiederholte, linksfrontale Positionierung der Reizspule auf dem Kopf des Tieres. Demzufolge bestand das Handling aus dem Habituieren der Tiere an die Position in den menschlichen Händen (siehe Abb. 2.5), aus dem Aufsetzen der Stimulationskelle über dem linken Auge sowie aus der Applikation der rTMS- verursachten Geräuschartefakte im Raum. Der Erfolg der Gewöhnung zeigte sich daran, dass sich die Tiere während des Verabreichens von 300 Stimuli resultierend aus 6 Stimulationsfolgen (engl, trains) ruhig verhielten. Entsprechend dem Ablauf des Handlings, wurde der Kopf der Ratte während der 2,5 s langen Stimulationsfolge mit zwei Fingern leicht fixiert. Da rTMS eine direkte muskuläre Erregung der Kaumuskulatur auslöst, war bei den Tieren während der Stimulation ein leichter Kopftremor zu beobachten. Im anschließenden 2,5 min langen Kühlintervall konnten die Tiere sich frei bewegen. Da das Handling durch die Stresshormonfreisetzung auch die intrazerebrale Ausschüttung von Dopamin beeinflussen kann (Barrot et al. 2000), wurde eine Kontrollgruppe den gleichen Experimentbedingungen ausgesetzt wie die rTMS - Gruppe. Die scheinstimulierten Ratten (engl, sham Stimulation) wurden hierbei unter typischer Positionierung in Experimentatorhänden dem akustischen Artefakt sowie dem „Tremorartefakt“ ausgesetzt. Dabei betrug die Entfernung der Stimulationsspule zum Kopf 10 cm. Barrot, M., M. Marinelli, Abrous D. N., Rouge-Pont F., Le Moal M. und Piazza P. V. (2000). "The dopaminergic hyper-responsiveness of the shell of the nucleus accumbens is hormone-dependent." European Journal of Neuroscience 12(3): 973-9. |
Kopie ohne Quellenangabe. |
| [29.] Mek/Fragment 033 00 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 033, Zeilen: 00 |
Quelle: Erhardt 2003 Seite(n): 029, Zeilen: 00 |
|---|---|

Abb. 3: links-präfrontale rTMS: Position der Ratte in den Händen und Auflegen der Stimulationsspule über dem linken Auge. |

Abbildung 2.5: Handling: Position der Ratte in den Händen und das Auflegen der Stimulationsspule über dem linken Auge der Ratte für die links präfrontale rTMS. |
Kopie der Abbildung und deren Beschriftung ohne Quellenangabe. |
| [30.] Mek/Fragment 033 02 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 033, Zeilen: 02-03, 04-12 |
Quelle: Engelmann 2000 Seite(n): 018, Zeilen: 01-15 |
|---|---|
| 2.5.1 Elevated plus-maze
Dieser Test[, der ursprünglich zur Untersuchung von anxiolytischen bzw. anxiogenen Eigenschaften von Pharmaka entwickelt wurde (Pellow et al., 1985),] beruht auf dem inneren Konflikt der Versuchstiere zwischen ihrem Explorationsdrang auf der einen und der angeborenen Aversion gegenüber offenen, hellen und erhöhten Kompartimenten auf der anderen Seite. Er gilt als einer der nicht nur ethologisch, sondern auch pharmakologisch am besten validierten experimentellen Prozeduren zur Charakterisierung des angeborenen, nicht konditionierten angstbezogenen Verhaltens bei Ratten (Hogg, 1996). Die hier verwendete Testapparatur aus dunkelgrauem PVC bestand aus vier Armen (jeweils 10 x 50 cm), von denen zwei gegenüberliegende durch Seiten- und Endwände (38 cm hoch) begrenzt, die beiden [anderen ohne Begrenzung waren.] Hogg, S. (1996) A review of the validity and variability of the elevated plus-maze as an animal model of anxiety. Pharmacology, Biochemistry & Behavior, 54, 21-30. [Pellow, S., Chopin, P., File, S.E. & Briley, M. (1985) Validation of open:closed arm entries in an elevated plus-maze as a measure of anxiety in the rat. Journal of Neuroscience Methods, 14, 149-167.] |
2. 2. 2. Elevated plus-maze-Test
Der elevated plus-maze-Test gilt als eine der nicht nur ethologisch, sondern auch pharmakologisch am besten validierten experimentellen Prozeduren zur Charakterisierung des angeborenen (d. h. nicht konditionierten) angstbezogenen Verhaltens bei Ratten (siehe Übersichtsartikel von File,1992 und Hogg, 1996). Der Test basiert auf der Generierung eines Konfliktes zwischen dem Bedürfnis von Nagern, neue, unbekannte Umgebungen zu erkunden und der den Tieren angeborenen Aversion vor schutzlosen, d. h. offenen und erhöhten Flächen (Telle, 1966). Die Testapparatur bestand aus einer plusförmigen Plattform aus dunkelgrauem PVC, die ca. 70 cm über dem Bodenniveau angebracht und nach allen Seiten von einem undurchsichtigen Vorhang umgeben war. Zirka 30 cm hohe Seitenwände umgaben ein Paar der sich gegenüberliegenden (geschlossenen) Arme (je 10 x 50 cm). Das andere (offene) Armpaar war nur mit einer 0,3 cm hohen, umlaufenden Kante ausgestattet, die im Falle eines Balanceverlustes der Tiere deren Abrutschen verhindern sollte. File, S.E., Zangrossi Jr., H., Sanders, F.L., Mabbutt, P.S. (1994). Raised corticosterone in the rat after exposure to the elevated plus-maze. Psychopharmacology, 113, 543-546. Hogg, S. (1996). A review of the validity and variability of the elevated plus-maze as an animal model of anxiety. Pharmacol. Biochem. Behav. 54, 21-30. Telle, H.-J. (1966). Beitrag zur Kenntnis der Verhaltensweisen von Ratten, vergleichend dargestellt bei Rattus norvegicus und Rattus rattus. Z. angew. Zool. 53, 129-196. |
Die Ausführungen des Verfassers zum Elevated plus-maze-Test stammen sowohl aus der Quelle Engelmann (2000) als auch der Quelle Wotjak (1996). Da die aus ersterer übernommenen Anteile überwiegen, sind die beiden Fragmente der letzteren aus Darstellungsgründen der Kategorie „keine Wertung“ zugeordnet worden. Für diese Seite siehe daher auch Fragment 033 02a aus Wotjak (1996); lediglich der in eckige Klammern gesetzte Relativsatz am Anfang stammt anscheinend von dem Verfasser selbst. Fortsetzung auf der nächsten Seite. |
| [31.] Mek/Fragment 034 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 034, Zeilen: 01-14, 15-17 |
Quelle: Engelmann 2000 Seite(n): 018, Zeilen: 09-11, 15-17, 20-29 |
|---|---|
| Die Verbindung der Armpaare wurde durch eine 10 x 10 cm große „neutrale Zone“ gewährleistet Diese als symmetrisches Kreuz angeordnete Versuchsapparatur befand sich 73 cm über dem Boden. Die Lichtintensität direkt über der Apparatur betrug ca. 100 Lux. Um zu verhindern, dass die Tiere während des Tests durch den Experimentator gestört werden, wurde ein Vorhang um die Apparatur gezogen. Mit Hilfe einer Videokamera, die über dem Zentrum der Apparatur angebracht und mit einem Computer verbunden war, konnte das Verhalten der Tiere aufgezeichnet und ausgewertet werden. Zu Beginn des Tests wurde das Versuchstier so auf die neutrale Zone der Apparatur gesetzt, dass es in Richtung eines geschlossenen Armes blickte. Während der fünfminütigen Expositionszeit erfolgte die Erfassung folgender Parameter: (1) Anzahl der Eintritte in die geschlossenen und offenen Arme, (2) die jeweils darin verbrachte Zeit und (3) die Latenz bis zum ersten Eintritt in einen offenen Arm. Als Eintritt wurde gewertet, wenn sich das Tier mit beiden Vorderpfoten innerhalb des jeweiligen Armes befand. [Nach dem Ende der Expositionszeit wurde die Ratte wieder in den Heimkäfig gesetzt.] Die Apparatur wurde vor jeder Exposition gründlich mit einer desinfektionsmittelhaltigen Lösung gereinigt, um mögliche Geruchsspuren zu beseitigen. | Die Testapparatur bestand aus einer plusförmigen Plattform aus dunkelgrauem PVC, die ca. 70 cm über dem Bodenniveau angebracht und nach allen Seiten von einem undurchsichtigen Vorhang umgeben war. [...] Die Verbindung der Armpaare wurde durch eine 10 x 10 cm große, sogenannte "neutrale Zone" gewährleistet. Die Lichtintensität direkt über der elevated plus-maze-Apparatur betrug ca. 100 Lux.
[...] Vor der Exposition jedes Tieres wurde die Apparatur gründlich mit einer desinfektionsmittelhaltigen Lösung gereinigt, um mögliche Geruchsspuren zu beseitigen. Zu Beginn des Tests wurde das Versuchstier so auf die neutrale Zone der Apparatur gesetzt, daß es in Richtung auf einen geschlossenen Arm schaute. Während der darauffolgenden 5-minütigen Beobachtungszeit konnte das Verhalten der Ratte über eine computergestützte Videoausrüstung aufgezeichnet und analysiert werden. Folgende Parameter wurden registriert: (1) Anzahl der Eintritte in die offenen bzw. geschlossenen Arme (als Kriterium für einen Eintritt galt die Position beider Vorderpfoten), (2) Dauer des Aufenthaltes auf den offenen bzw. geschlossenen Armen und (3) Latenz bis zum ersten Eintritt in einen offenen Arm. |
Fortsetzung von der Vorseite. Die Ausführungen des Verfassers zum Elevated plus-maze-Test stammen sowohl aus der Quelle Engelmann (2000) als auch der Quelle Wotjak (1996). Da die aus ersterer übernommenen Anteile überwiegen, sind die beiden Fragmente der letzteren aus Darstellungsgründen der Kategorie „keine Wertung“ zugeordnet worden. Für diese Seite siehe daher auch Fragment 034 10 aus Wotjak (1996). Für den in eckige Klammern gesetzten vorletzten Satz gibt es keine Entsprechung. |
| [32.] Mek/Fragment 035 13 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 035, Zeilen: 13-30 |
Quelle: Schindele 2003 Seite(n): 038, Zeilen: 01-21 |
|---|---|
| 2.5.4 Forciertes Schwimmen (Forced Swimming)
Forciertes Schwimmen stellt ein ethologisch relevantes und komplexes Stressmodell dar, das nicht nur eine starke physische Belastung darstellt, sondern auch eine ausgeprägte emotionale Komponente beinhaltet. Es ist außerdem validiert für die Erfassung der Wirksamkeit antidepressiver Medikamente (Porsolt et al., 1978; Porsolt et al., 1979; Borsini & Meli, 1988; Cryan et al., 2002). Es besteht allgemeine Übereinstimmung, dass bei diesem Test eine gesteigerte Aktivität („Swimming", „Struggling“) eine aktive Stressbewältigungsstrategie widerspiegelt, während eine erhöhte Immobilität („Floating“) hinweisend für ein passives Bewältigungsverhalten ist. Das Versuchstier wurde aus dem Heimkäfig herausgenommen und für 5 Minuten in einen mit 23°C warmen Wasser gefüllten Schwimmbottich (50 cm hoher Plexiglaszylinder, Durchmesser: 30 cm) gesetzt. Der Bottich war bis auf 40 cm mit Wasser gefüllt. Somit war das Tier gezwungen, aktiv zu schwimmen („Swimming“, „Struggling“) oder sich passiv treiben zu lassen („Floating“). Nach dem 5-minütigen Schwimmen wurde die Ratte aus dem Wasser genommen, sorgfältig abgetrocknet und in ihren Heimkäfig zurückgesetzt. Das Schwimmverhalten der Tiere wurde während des Versuchs auf Video aufgezeichnet und später mit Hilfe eines Computerprogramms nach den drei charakteristischen Verhaltensweisen [ausgewertet:] Porsolt, R.D., Anton, G., Blavet, N. & Jalfre, M. (1978) Behavioural dispair in rats: a new model sensitive to antidepressant treatments. European Journal of Pharmacology, 47, 379-391. Porsolt, R.D., Bertin, A., Blavet, N., Deniel, M. & Jalfre, M. (1979) lmmobility induced by forced swimming in rats: effects of agents which modify central catecholamine and serotonin activity. European Journal of Pharmacology, 57, 201-210. Borsini, F. & Meli, A . (1988) Is the forced swimming test a suitable model for revealing antidepressant activity? Psychopharmacology, 94, 147-160. Cryan, J.F., Markou, A. & Lucki , I. (2002) Assessing antidepressant activity in rodents: recent developments and future needs. Trends in pharmacological sciences, 23, 238-245. |
2.5 Verhaltenstest: Schwimmstressor („Forced swimming”)
„Forced swimming“ stellt ein ethologisch relevantes und komplexes Stressormodell dar, das nicht nur eine starke physische Belastung darstellt, sondern auch eine ausgeprägt emotionalpsychische Komponente beinhaltet (Abel, 1994; West, 1990). Es ist außerdem validiert für die Erfassung der Wirksamkeit antidepressiver Therapieverfahren wie die Gabe von Antidepressiva, Elektrokrampftherapie und repetitive transkranielle Magnetstimulation (Borsini & Meli, 1988; Keck et al., 2000b; Lucki, 1997; Porsolt et al., 1977). Es besteht allgemeine Übereinstimmung, dass bei diesem Test eine gesteigerte Aktivität („Swimming“, „Struggling“) eine aktive Bewältigungsstrategie widerspiegelt, während eine erhöhte Immobilität („Floating“) hinweisend für ein passives Bewältigungsverhalten ist (Keck et al., 2000b). Das Versuchstier wurde aus dem Heimkäfig herausgenommen und für 5 Minuten in einen mit 23 °C warmen Wasser gefüllten Schwimmbottich (50 cm hoher Plexiglaszylinder, Durchmesser: 30 cm) gesetzt. Der Bottich war bis auf 40 cm mit Wasser gefüllt. Somit war das Tier gezwungen aktiv zu schwimmen („Swimming“, „Struggling“) oder sich passiv treiben zu lassen („Floating“). Die Mikrodialyse fand auch während des Schwimmens statt. Nach dem 5-minütigen Schwimmen wurde die Ratte aus dem Wasser genommen, sorgfältig abgetrocknet und in ihren Heimkäfig zurückgesetzt. Das Schwimmverhalten der Tiere wurde während des Versuchs auf Video aufgezeichnet und später mit Hilfe eines Programms am Computer nach den drei charakteristischen Verhaltensweisen ausgewertet: [...] Abel E L (1994) A further analysis of physiological changes in rats in the forced swim test, in: Physiology & Behavior 56: 795-800. West A p (1990) Neurobehavioral studies of forced swimming. The role of learning and memory in the forced swim test, in: Progress in Neuro-Psychopharmacology & Biological Psychiatry 14: 863-877. Borsini F und Meli A (1988) Is the forced swimming test a suitable model for revealing antidepressant activity?, in: Psychopharmacology 94: 147-160. Keck M E, Engelmann M, Müller M B, Henniger M S H, Hermann B, Rupprecht R, Neumann I D, Toschi N, Landgraf R und Post A (2000b) Repetitive transcranial magnetic stimulation induces active coping strategies and attenuates the neuroendocrine stress response in rats, in: Journal of Psychiatrie Research 34: 265-276. Lucki I (I 997) The forced swimming test as a model for core and component behavioral effects of antidepressant drugs, in: Behavioural Pharmacology 8. 523-532. Porsolt R D, Le Piechon M und Jalfre M (1977) Depression. A new animal model sensitive to antidepressant treatments, in: Nature 266: 730-732. |
Kein Hinweis auf die Quelle. |
| [33.] Mek/Fragment 036 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 036, Zeilen: 01-05 |
Quelle: Schindele 2003 Seite(n): 038, Zeilen: 21-25 |
|---|---|
| [... ausgewertet:] „Struggling“: Die Ratte bewegt stark alle vier Extremitäten, die Vorderfüße durchbrechen die Wasseroberfläche. „Swimming“: Die Ratte bewegt alle vier Extremitäten ohne dabei mit ihnen die Wasseroberfläche zu durchbrechen oder sie taucht aktiv. „Floating“: Die Ratte verharrt bewegungslos im Wasser mit lediglich gelegentlichen, leichten Bewegungen, um ihre Lage zu stabilisieren. | [...] ausgewertet: „Struggling": Die Ratte bewegt stark alle vier Extremitäten, die Vorderfüße durchbrechen die Wasseroberfläche. „Swimming": Die Ratte bewegt alle vier Extremitäten ohne dabei mit ihnen die Wasseroberfläche zu durchbrechen, oder sie taucht aktiv. „Floating": Die Ratte verharrt bewegungslos im Wasser mit lediglich gelegentlichen leichten Bewegungen um ihre Lage zu stabilisieren. |
Wörtliche Übernahme ohne Nennung der Quelle. |
| [34.] Mek/Fragment 036 06 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 036, Zeilen: 06-24 |
Quelle: Engelmann 2000 Seite(n): 014, 016, 017, Zeilen: 014: 13, 15, 16; 016: 23-25; 017: 01-15 |
|---|---|
| Da Ratten sehr gute Schwimmer sind, erfüllt forciertes Schwimmen das Kriterium der ethologischen und physiologischen Relevanz.
2.5.5 Soziale Diskrimination (Juvenile Recognition) Beim so genannten sozialen Diskriminationstest wird das olfaktorische, jungtierspezifische Kurzzeitgedächtnis von Ratten überprüft (Engelmann et al., 1995). Die Experimente wurden während der Aktivitätsphase der Tiere, d.h. zwischen 19:00 und 24:00 Uhr, in einem schwach beleuchteten Raum durchgeführt. Dem in einem Einzelkäfig sitzenden adulten Rattenmännchen wurde für 4 Minuten ein unbekanntes Jungtier (Wistar, 20-25 Tage alt, männlich oder weiblich) präsentiert und das Explorationsverhalten beobachtet. Mit Hilfe eines Computerprogramms wurde die Zeit erfasst, die das adulte Tier damit verbrachte, sich mit dem Jungtier zu beschäftigen. Nach einem Zeitintervall von 30 Minuten wurde dasselbe Jungtier zusammen mit einem zweiten, unbekannten Jungtier nochmals für 4 Minuten zu der adulten Ratte gesetzt und das Explorationsverhalten erneut beobachtet. Eine verringerte Explorationszeit des Rattenmännchens gegenüber demselben, schon innerhalb der ersten Exposition präsentierten Jungtier zeigt das olfaktorische, jungtierspezifische Kurzzeitgedächtnis an. Entsprechend wird das neue, bislang unbekannte Jungtier signifikant länger exploriert. Engelmann, M., Wotjak, C.T. & Landgraf, R. (1995) Social discrimination procedure: an alternative method to investigate juvenile recognition abilities in rats. Physiology & Behavior, 58, 315-321. |
[Seite 14]
Da Ratten gute Schwimmer sind, [...] erfüllte forciertes Schwimmen das Kriterium der ethologischen und physiologischen Relevanz. [Seite 16] 2. 2. 1. Soziale Diskrimination Beim sogenannten sozialen Diskriminations-Test wird das olfaktorische, jungtierspezifische Kurzzeitgedächtnis von Ratten überprüft (Engelmann et al., 1995). [Seite 17] Die Experimente wurden während der Aktivitätsphase der Tiere, d. h. zwischen 19.00 und 24.00 Uhr, in einem schwach beleuchteten Raum durchgeführt. Dem in einem Einzelkäfig sitzenden adulten Rattenmännchen wurde für 4 min ein unbekanntes Jungtier (Wistar, 20 - 25 Tage alt, männlich oder weiblich) präsentiert und das Explorationsverhalten beobachtet. Mit Hilfe eines Computerprogramms wurde die Zeit gemessen, die das adulte Tier damit verbrachte, sich mit dem Jungtier zu beschäftigen (anogenitales Schnüffels [sic] und Belecken). Nach einem Zeitintervall (Expositionsintervall, EI) von 30 min (EI 30) wurde dasselbe Jungtier zusammen mit einem zweiten, neuen Jungtier nochmals für 4 min zu der adulten Ratte gesetzt und das Explorationsverhalten erneut beobachtet. Eine verringerte Explorationszeit des Rattenmännchens gegenüber demselben, schon innerhalb der ersten Exposition präsentierten (und damit theoretisch schon bekannten) Jungtier während dieser zweiten Exposition zeigt das olfaktorische, jungtierspezifische Kurzzeitgedächtnis an. Dies wird dadurch bestätigt, daß das neue Jungtier vergleichsweise signifikant länger exploriert wird. Engelmann, M., Wotjak, C.T., Landgraf, R. (1995) Social discrimination procedure: an alternative method to investigate juvenile recognition abilities in rats. Physiol Behav. 58, 315-321. |
Kein Hinweis auf die eigentliche (deutschsprachige) Quelle, die in der gesamten Arbeit nirgends genannt ist. Das Unterkapitel 2.5.5 wird inkl. Literaturreferenz vollständig übernommen. |
| [35.] Mek/Fragment 037 12 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 037, Zeilen: 12-22 |
Quelle: Erhardt 2003 Seite(n): 023, Zeilen: 03-16 |
|---|---|
| Das verwendete Morphinhydrochlorid (Merck, Darmstadt) wurde in 0,9%iger Kochsalzlösung gelöst. Die Injektionsdosis wurde täglich dem Tiergewicht angepasst. Das Injektionsschema entsprach dem Sensibilisierungsschema von Acquas und Di Chiara (Acquas & Di Chiara, 1992). Die subkutanen Injektionen fanden zweimal täglich jeweils um 7.00 und 19.00 über 7 Tage statt. Die letzte Injektion wurde am 8. Tag morgens verabreicht, damit während der anschließenden Mikrodialyse- Operation keine Entzugszeichen provoziert wurden. Injektionsschema für Morphinhydrochlorid über sieben Tage:
Tag 1: 5 mg/kg, Tag 2-4: 10mg/kg, Tag 5-7: 15mg/kg; Tag 8: 10mg/kg. Kontrollgruppe: gleiches Behandlungsschema wie bei Morphinhydrochlorid unter Verwendung von 0,9%iger Kochsalzlösung (Vehikel). |
Das verwendete Morphin-Hydrochlorid (Merck, Darmstadt) wurde in 0,9%iger Kochsalzlösung aufgelöst. Die Injektionsdosis (s.u.) wurde täglich dem Tiergewicht angepasst. Das Injektionsschema entsprach dem Sensibilisierungsschema von Acquas und Di Chiara (1992). Die subkutanen Injektionen fanden zweimal täglich jeweils um 7.00 und 19.00 über 7 Tage statt. Die letzte Injektion wurde am 8. Tag morgens verabreicht, damit während der anschließenden Mikrodialyse-Operation keine Entzugszeichen provoziert wurden.
Injektionsschema für Morphinhydrochlorid über 7 Tage: Tag 1 5 mg/kg KG Tag 2-4 10mg/kg KG Tag 5-7 15mg/kg KG Tag 8 10mg/kg KG Kontrollgruppe: gleiches Vorbehandlungsschema wie bei Morphinhydrochlorid unter Verwendung von 0,9%iger Kochsalzlösung (Vehikel). |
Kopie ohne Quellenangabe. Das Fragment enthält das vollständige Kapitel 2.6 Morphinsensitivierung. |
| [36.] Mek/Fragment 044 21 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 044, Zeilen: 21-25, 29-30 |
Quelle: Droste 2003 Seite(n): 048, Zeilen: 03-09, 22-25 |
|---|---|
| Um Rezeptormessungen mittels des 3H-Steroid-Bindungsassays durchführen zu können, müssen die Versuchstiere adrenalektomiert werden, um kein endogenes Kortikosteron aufzuweisen. Hierzu wurde unter Halothan-Narkose auf der Höhe der Nebennieren bilateral ein kleiner Schnitt gesetzt. Diese wurden aus dem perirenalen Fettgewebe entnommen, anschließend erfolgte der Wundverschluss über Klammern. [...] Nach Präparation der Hypophyse wurden die Gehirne umgehend in verschiedene Areale (Hippocampus, Hypothalamus, Amygdala, frontaler Kortex, [Neokortex) dissektiert, welche sofort in flüssigem Stickstoff schockgefroren und anschließend bei -80°C aufbewahrt wurden.] | Um Rezeptor-Messungen mittels des 3H-Steroid-Bindungs-Assays durchführen zu können, müssen von endogenem Corticosteron freie Tiere verwendet werden. Aus diesem Grund wurden die Versuchstiere adrenalektomiert. Hierzu wurde auf der Höhe der Nebenniere beidseitig ein kleiner Schnitt gesetzt, über welchen der Zugang zur Nebenniere ermöglicht wurde. Sie wurden aus dem Fettgewebe entnommen, und anschließend die Wunden mit steriler Nähseide (Perma-Handseide, Ethicon, D.) verschlossen und zugeklammert.
[...] Die Gehirne der Tiere wurden in verschiedene Areale (Hippokampus, Hypothalamus, frontaler Kortex, Amygdala und Neokortex) dissektiert, die sofort in flüssigem Stickstoff schockgefroren und anschließend bei -80°C aufbewahrt wurden. |
Text wird teilweise wörtlich übernommen und im weiteren Verlauf im gleichen logischen Duktus fortgeführt. Keine Quellenangabe. Bei der Aufzählung in der Klammer im letzten Satz wird "Hippokampus" mit c geschrieben und die Reihenfolge umgestellt. |
| [37.] Mek/Fragment 045 05 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 045, Zeilen: 01-02, 05-12 |
Quelle: Droste 2003 Seite(n): 048-050, Zeilen: 048: 23-26: 049: 17-19; 050: 04-06, 09-14 |
|---|---|
| [Nach Präparation der Hypophyse wurden die Gehirne umgehend in verschiedene Areale (Hippocampus, Hypothalamus, Amygdala, frontaler Kortex,] Neokortex) dissektiert, welche sofort in flüssigem Stickstoff schockgefroren und anschließend bei -80°C aufbewahrt wurden.
[...] Die totale Bindung wurde mit [3H]-Dexamethason (spezifische Aktivität 85 Ci/mmol) oder mit [3H]- Aldosteron (spezifische Aktivität 83 Ci/mmol) bestimmt. Nach einer Inkubationszeit von 20-24 h bei 0-2°C wurden die gebundenen von den freien [3H]-Steroiden mittels Sephadex LH-20 (Pharmacia, Schweden) Gel-Filtration getrennt. Die Proteinkonzentrationen wurden mit BSA als Standards bestimmt. Die Maximalbindung (Bmax) und die relative Bindungsaffinität (Kd) wurden mittels Scatchard-Analyse ermittelt (Reul & de Kloet, 1985). Reul, J.M.H.M. & de Kloet, E.R. (1985) Two receptor systems for corticosterone in the rat brain: microdistribution and differential occupation. Endocrinology, 117, 2505-2512. |
[Seite 048]
Die Gehirne der Tiere wurden in verschiedene Areale (Hippokampus, Hypothalamus, frontaler Kortex, Amygdala und Neokortex) dissektiert, die sofort in flüssigem Stickstoff schockgefroren und anschließend bei -80°C aufbewahrt wurden. [Seite 049] Die totale Bindung wurde mit [3H]-Dexamethason (spez. Aktivität: 85 Ci/mmol; Amersham, Braunschweig, D.) oder mit [3H]-Aldosteron (spez. Aktivität: 82.3 Ci/mmol; NEN Du Pont, Dreieich, D.) bestimmt. [Seite 050] Nach einer Inkubationszeit von 20-24 h bei 0-2°C wurden die gebundenen [3H]-Steroide von den freien [3H]-Steroiden mittels Sephadex LH-20 (Pharmacia, Schweden) Gel-Filtration getrennt. [...] Die Proteinkonzentrationen wurden nach der Methode von Lowry et al. (1951) mit BSA (Albumin, Bovine) als Standards bestimmt. Die Daten der Bindungs-Assays sind in Femtomol pro Milligramm (fmol/mg) Protein angegeben. Die Maximalbindung (Bmax) und die relative Bindungsaffinität (Kd) wurden mittels Scatchard-Analyse (Scatchard et al., 1949) ermittelt. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ (1951) Protein measurement with the folin phenol reagent. 265-275. Scatchard G (1949) The attractions of proteins for small ions and molecules. Ann N Y Acad Sci 51. |
Kein Hinweis auf die eigentliche Quelle. |
| [38.] Mek/Fragment 045 24 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 045, Zeilen: 24-29 |
Quelle: Schindele 2003 Seite(n): 041, Zeilen: 19-25 |
|---|---|
| Die histologische Kontrolle diente dem Nachweis der korrekten Lage der Mikrodialyse-Sonde im entsprechenden Hirngebiet (Abb. 4). Die Beurteilung der Hirnschnitte erfolgte vor Kenntnis der Analytik der Mikrodialyse- und Plasmaproben. Im Anschluss an das jeweilige Experiment wurden die Ratten durch eine Überdosis Halothan getötet. Die Gehirne wurden aus der Kalotte präpariert, in vorgekühltem 2-Methylbutan (Carl Roth GmbH, Karlsruhe, Deutschland) auf Trockeneis [schockgefroren und bei -20 °C aufbewahrt.] | Die histologische Kontrolle dient dem Nachweis der korrekten Lage der Mikrodialyse-Sonde im PVN. Die Beurteilung der Hirnschnitte erfolgte demnach allein auf Grund der Histologie noch vor Kenntnis der Ergebnisse der Mikrodialyse- und Plasmaproben.
Am Tag nach dem Experiment wurden die Ratten durch eine Überdosis Halothan® getötet. Die Gehirne wurden vorsichtig aus der Schädelkalotte entnommen, in vorgekühltem 2-Methylbutan (Carl Roth GmbH, Karlsruhe, Deutschland) auf Trockeneis (-20 °C) schockgefroren und bei -20 °C aufbewahrt. |
Großteils wörtliche Übernahme ohne Quellennennung. |
| [39.] Mek/Fragment 046 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 046, Zeilen: 01-08, 11-17 |
Quelle: Schindele 2003 Seite(n): 042, 045, Zeilen: 042:01-09; 045:09-19 |
|---|---|
| Später wurden die Gehirne bei -20 °C am Kryostat (Microm, HM 500-0, Walldorf) in 25 µm dicke Frontalschnitte geschnitten und auf Objektträger aufgezogen, die mit 0,01 % Poly-L-Lysin-Hydrobromid (Sigma, Deisenhofen) beschichtet worden waren. Sie wurden für 1,5 Minuten mit 0,5 % Cresylechtviolett (Sigma) gefärbt und in einer aufsteigenden Alkoholreihe (20 Sekunden in 70 % Ethanol; 20 Sekunden in 96 % Ethanol) entwässert. Danach wurden sie 5 Minuten in Isopropanol (Carl Roth GmbH, Karlsruhe) und 10 Minuten in Rotihistol® (Carl Roth GmbH) überführt.
[...] [...] [...] Nach Freipräparation der Hypophysen männlicher Sprague-Dawley-Ratten wurden die Hinter- und Mittellappen entfernt und die Hypophysenvorderlappen in einer silikonisierten Petrischale mit einem Skalpell zerkleinert. Bei 37 °C wurden die Hypophysenfragmente enzymatisch dispergiert, wobei jeweils 1 ml Verdauungslösung (HDB-Puffer, 4 g/l BSA, 4 g/l Kollagenase (Kollagenaseaktivität 29 x 104 U/g), 10 mg/l DNAse II, 0,1 g/l Trypsininhibitor, 1 g/l Hyaluronidase II) pro Hypophyse eingesetzt wurde. Die Fragmente wurden ca. 2 [Stunden in einem auf 37 °C temperierten Schüttler inkubiert und mehrmals in einer silikonisierten Pipette aufgezogen um den Dispersionsprozess zu unterstützen.] |
[Seite 042]
Einige Tage später wurden die Gehirne bei -20 °C am Kryostaten (Microm, HM 500-0, Walldorf, Deutschland) in 25 µm dicke Hirnschnitte geschnitten. Diese Frontalschnitte des PVN wurden auf Objektträger aufgezogen, die mit 0,01 % Poly-L-Lysin-Hydrobromid (Sigma, Deisenhofen, Deutschland) beschichtet worden waren. Sie wurden für 1,5 Minuten mit 0,5 % Kresylviolett (Sigma, Deisenhofen, Deutschland) gefärbt und in einer aufsteigenden Alkoholreihe (20 Sekunden in 70 % Ethanol; 20 Sekunden in 96 % Ethanol) entwässert. Danach wurden sie 5 Minuten in Isopropanol (Carl Roth GmbH, Karlsruhe, Deutschland) und 10 Minuten in Rotihistol® (Carl Roth GmbH, Karlsruhe, Deutschland) überfuhrt. [Seite 045] Nach Freipräparation der Hypophysen wurden die Hinter- und Mittellappen entfernt und die Vorderlappen mehrmals in HDB-Puffer (137 mM NaCl, 5 mM KCl, 0,7 mM Na2HPO4, 10 mM D-Glucose, 15 mM HEPES14 (pH 7,3), 2,5 mg/l Amphotericin B, 10 5 U/l Penicillin/Streptomycin) gewaschen. Unter sterilen Bedingungen wurden anschließend die Hypophysenvorderlappen in einer silikonisierten Petrischale mit einem Skalpell zerkleinert. Bei 37 °C wurden die Hypophysenfragmente enzymatisch dispergiert, wobei jeweils 1 ml Verdauungslösung (HDB-Puffer, 4 g/l BSA15, 4 g/l Kollagenase (Kollagenaseaktivität 29 x 104 U/g), 10 mg/l DNAse II, 0,1 g/l Trypsininhibitor, 1 g/l Hyaluronidase II) pro Hypophyse eingesetzt wurde. Die Fragmente wurden ca. 2 Stunden in einem auf 37 °C temperierten Schüttler inkubiert und mehrmals in einer silikonisierten Pipette aufgezogen um den Dispersionsprozess zu unterstützen. 14 HEPES (= N-2-Hydroxyethylpiperazin-N'-2-Ethansulfonsäure) ist ein oft verwendeter Puffer, der pH-Werte im Bereich von 6,8 bis 8,2 stabilisiert. 15 BSA = Bovine Serum Albumine = Rinderserumalbumin |
Wörtliche Übernahme mit leichter Variation in den Schreibweisen von Fachbegriffen. Kein Hinweis auf die Quelle. |
| [40.] Mek/Fragment 046 10 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 046, Zeilen: 10-11 |
Quelle: Erhardt 2003 Seite(n): 030, Zeilen: 01-02 |
|---|---|

Abb. 4: Links: Korrekte, rechts: fehlerhafte Position der Mikrodialysesonden (Kreis) im Hippocampus und Striatum. |

Abbildung 2.6: Histologische Lage der Sondenspitze im Hippokampus, Striatum und Nucleus accumbens |
z.T. übernahme der Abbildungen ohne Angabe der Quelle. Drei der vier von Mek verwendeten Fotos (nicht das oben rechts) stammen vom selben Original wie die Fotos bei Erhardt. Die in die Bilder eingeschobenen Texte sind identisch und mit demselben Font, allerdings bei Mek ohne Rahmen und gegenüber Erhard etwas versetzt angebracht. Unter den hier dokumentierten Übernahmen eher eine kleinteilige. |
| [41.] Mek/Fragment 047 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 047, Zeilen: 01-17 |
Quelle: Schindele 2003 Seite(n): 045-046, Zeilen: 045:18-22; 046:01 ff. |
|---|---|
| [Die Fragmente wurden ca. 2] Stunden in einem auf 37 °C temperierten Schüttler inkubiert und mehrmals in einer silikonisierten Pipette aufgezogen [sic] um den Dispersionsprozess zu unterstützen. Anschließend wurden die Zellen bei 1200 rpm für 8 Minuten zentrifugiert und in Kulturmedium (DMEM (pH 7,3), 10 % FCS, 2,2 g/l NaHCO3, 10 mM HEPES, 2,2 g/l Glutamin, 10 ml/l nicht essentielle Aminosäuren, 10 ml/l MEM-Vitamine, 10 ml/l Amphotericin B, 105 U/l Penicillin/Streptomycin, 40 U/l Normalinsulin, 5 mg/l Transferrin, 20 µg/l Selenium, 30 pM Trijodtyroxin) resuspendiert. Das Anlegen der Zellkultur wurde unter sterilen Bedingungen durchgeführt. Die Platten wurden im Brutschrank bei 37°C, 95% Luftfeuchtigkeit und 5% CO2 Gehalt [sic] aufbewahrt. Am Versuchstag wurden die gut angewachsenen Zellen dreimal mit calciumreichem Stimulationsmedium (DMEM mit 0,5 g/l BSA, 2,2 g/l NaHCO3, 10 mM HEPES, 2,4 g/l Glutamin) gewaschen (Renner et al., 1995). Die Testsubstanzen (R121919, Alprazolam bzw. Temazepam allein oder in Verbindung mit einer Stimulation durch CRH oder AVP) wurden in kleinen Volumina (50 µl) zugegeben. Die Zellen (100000 Zellen pro well) wurden mit den jeweiligen Testsubstanzen 3 Stunden lang inkubiert bzw. stimuliert. Die Überstände wurden anschließend abpipettiert und bei –80 °C gelagert [sic] bis die radioimmunometrische Bestimmung der ACTH-Werte erfolgte.
Renner, U., Newton, C.J., Pagotto, U., Sauer, J., Stalla, G.K. & Arzt, E. (1995) Involvement of interleukin- 1 [sic] and interleukin-1 receptor antagonist in rat pituitary cell growth regulation. Endocrinology, 136, 3186-3193. |
[Seite 045]
Die Fragmente wurden ca. 2 Stunden in einem auf 37 °C temperierten Schüttler inkubiert und mehrmals in einer silikonisierten Pipette aufgezogen [sic] um den Dispersionsprozess zu unterstützen. Anschließend wurden die Zellen bei 1200 rpm für 8 Minuten zentrifugiert und in Kulturmedium (DMEM16 (pH 7,3), 10 % FCS17, 2,2 g/l NaHCO3, 10 mM HEPES, 2,2 g/l Glutamin, 10 ml/l nicht [Seite 046] essentielle Aminosäuren, 10 ml/l MEM-Vitamine18, 10 ml/l Amphotericin B, 105 U/l Penicillin/Streptomycin, 40 U/l Normalinsulin, 5 mg/l Transferrin, 20 µg/l Selenium, 30 pM Trijodtyroxin) resuspendiert. [...] Das Anlegen der Zellkultur wurde unter sterilen Bedingungen durchgeführt. Die Platten wurden im Brutschrank bei 37 °C, 95 % Luftfeuchtigkeit und 5 % CO2 Gehalt [sic] aufbewahrt. [...] Am Versuchstag wurden die gut angewachsenen Zellen dreimal mit calciumreichem Stimulationsmedium (DMEM mit 0,5 g/l BSA, 2,2 g/l NaHCO3, 10 mM HEPES, 2,4 g/l Glutamin) gewaschen. Die Testsubstanzen (Alprazolam bzw. Temazepam allein oder in Verbindung mit einer Stimulation durch CRH oder AVP) wurden in kleinen Volumina (50 µl) zugegeben. Die Zellen (100000 Zellen pro well) wurden mit den jeweiligen Testsubstanzen 3 Stunden lang inkubiert bzw. stimuliert. Die Überstände wurden anschließend abpipettiert und bei –80 °C gelagert [sic] bis die radioimmunometrische Bestimmung der ACTH Werte [sic] erfolgte. 16 DMEM = Dulbecco's Modified Eagle's Medium 17 FCS - Fetal Calf Serum 18 MEM-Vitamine = Minimal Essential Medium – Non essential amino acid supplement (eine Aminosäuremixtur) |
Nahezu wörtliche Übernahme ohne Nennung der eigentlichen Quelle. Wenn man konservativ nur den Satz "For ACTH, GH, and PRL secretion studies, attached rat pituitary cells (48 h after seeding) were washed with stimulation medium (DMEM, pH 7.3, supplemented with 2 mM glutamine, 1 g/liter BSA, and 30 mg/liter ascorbic acid) [...]." |
| [42.] Mek/Fragment 048 15 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 048, Zeilen: 15-18, 21-31 |
Quelle: Schindele 2003 Seite(n): 044, Zeilen: 02-25 |
|---|---|
| ACTH, Kortikosteron, Testosteron, Prolaktin und Laktat im Plasma bzw. Zellkulturüberstand (ACTH) wurden mit kommerziellen Kits (ICN Biomedicals Inc., DRG Instruments, Marburg) entsprechend den jeweiligen Anleitungen gemessen (Sensitivität: ACTH < 1,0 pg/ml, Kortikosteron < 2,0 ng/ml). [...]
Die Bestimmung der AVP- und Oxytozin-Konzentration im Plasma (nach Extraktion) und in den lyophilisierten Mikrodialysaten des PVN erfolgte mittels indirekten Radioimmunoassays (RIA) (Landgraf, 1995; Ebner et al., 1999). Die Antiseren gegen AVP sowie Oxytozin wiesen eine Kreuzreaktivität mit strukturell ähnlichen Peptiden von weniger als 0,7% auf. Die Nachweisgrenze des RIA lag bei 0,03 pg/Probe. Sowohl die Intra- als auch die Interassay-Variabilität betrug etwa 10%. Zur Extraktion wurden 200 µl Plasma mit 1 ml 0,01 N HCl versetzt, im Vortex geschüttelt und zentrifugiert (5 Minuten, 4000 rpm, 4 °C). Der Überstand (ca. 1 ml) wurde in ein neues Tube überführt und mit 20 mg Glaspulver (Silikatkügelchen, LiChroprep Si 60, Merck) versetzt, in dessen Poren (Durchmesser: 20 Å) sich Moleküle von der Größe der Nonapeptide sammeln können. Die mit Glaspulver versetzte Suspension wurde [im Vortex geschüttelt, in einen Rotationsmischer gegeben (30 Minuten, 4 °C) und zentrifugiert (2 Minuten, 4000 rpm, 4 °C).] Landgraf, R. (1995) Intracerebrally released vasopressin and oxytocin. Measurement, mechanisms and behavioural consequences. Journal of Neuroendocrinology, 7, 243-253. Ebner, K., Wotjak, C.T., Holsboer, F. , Landgraf, R. & Engelmann, M. (1999) Vasopressin released within the septal brain area during swim stress modulates the behavioural stressresponse in rats. European Journal of Neuroscience, 11, 997-1002. |
ACTH und Corticosteron im Plasma wurden mit kommerziellen Kits (ICN Biomedicals Inc., DRG Instruments, Marburg, Deutschland) entsprechend den jeweiligen Anleitungen gemessen (Sensitivität: ACTH < 1,0 pg/ml, Corticosteron < 2,0 ng/ml).
Die Bestimmung der AVP-Konzentration im Plasma (nach Extraktion) und in den lyophilisierten Mikrodialysaten des PVN erfolgte mittels indirektem Radioimmunoassay (RIA) (Ebner, 1999a; Landgraf, 1981; Landgraf et al., 1995c). Die Antiseren gegen AVP wiesen eine Kreuzreaktivität mit strukturell ähnlichen Peptiden von weniger als 0,7 % auf. Die Nachweisgrenze des RIA lag bei 0,03 pg/Probe. Sowohl die Intra- als auch die Interassay- Variabilität betrug etwa 10 %. Die Plasmaproben des AVP wurden extrahiert (Ebner, 1999a). Dazu wurde 200 µl Plasma mit 1 ml 0,01 N HCl versetzt, im Vortex geschüttelt und zentrifugiert (5 min, 4000 rpm, 4 °C). Der Überstand (ca. 1 ml) wurde in ein neues Tube überführt und mit 20 mg Glaspulver (Silikatkügelchen, LiChroprep Si 60, Merck, Deutschland) versetzt, in dessen Poren (Durchmesser: 20 Å) sich Moleküle von der Größe der Nonapeptide sammeln können. Die mit Glaspulver versetzte Suspension wurde im Vortex geschüttelt, in einen Rotationsmischer gegeben (30 min, 4 °C) und zentrifugiert (2 min, 4000 rpm, 4 °C). Der Überstand wurde abgesaugt, mit 0,5 ml Aqua bidestillata (4 °C) versetzt, geschüttelt und zentrifugiert (5 min, 4000 rpm, 4 °C). Dieser Vorgang wurde mit 0,5 ml 0,1 N HCl wiederholt, der Überstand erneut abgesaugt, mit 0,5 ml 60 % Aceton versetzt, geschüttelt, abermals in den Rotationsmischer gegeben (30 min, 4 °C) und zentrifugiert (10 min, 4000 rpm, 4 °C). Ebner K (1999a) Intrazerebral freigesetztes Vasopressin und Oxytocin beeinflussen stressinduziertes Verhalten, Emotionalität sowie Lernen und Gedächtnis bei Ratten (unveröffentlichte Dissertation), Wien. Landgraf R (1981) Simultaneous measurement of arginine vasopressin and oxytocin in plasma and neurohypophyses by radioimmunoassay, in: Endokrinologie 78: 191-204. Landgraf R, Kubota M, Holsboer F und Wotjak C T (1995c) Release of vasopressin and oxytocin within the brain and into blood. Microdialysis and antisense targeting, in: Saito T, Kurokawa K und Yoshida S (Hrsg.), Neurohypophysis. Recent Progress of Vasopressin and Oxytocin Research, Elsevier Science, Amsterdam: 243-256. |
Kein Hinweis auf die Quelle. |
| [43.] Mek/Fragment 049 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 049, Zeilen: 01-11 |
Quelle: Schindele 2003 Seite(n): 044, Zeilen: 15-25 |
|---|---|
| [Die mit Glaspulver versetzte Suspension wurde] im Vortex geschüttelt, in einen Rotationsmischer gegeben (30 Minuten, 4 °C) und zentrifugiert (2 Minuten, 4000 rpm, 4 °C). Der Überstand wurde abgesaugt, mit 0,5 ml Aqua bidestillata (4°C) versetzt, geschüttelt und zentrifugiert (5 Minuten, 4000 rpm, 4°C). Dieser Vorgang wurde mit 0,5 ml 0,1 N HCl wiederholt, der Überstand erneut abgesaugt, mit 0,5 ml 60 % Aceton versetzt, geschüttelt, abermals in den Rotationsmischer gegeben (30 Minuten, 4°C) und zentrifugiert (10 Minuten, 4000 rpm, 4°C). Abschließend wurde 0,5 ml Überstand abpipettiert, in ein neues Tube übernommen und über Nacht bei 4°C offen stehen gelassen. Am nächsten Tag erfolgte die Evaporisation in einer Vakuumzentrifuge für etwa 3 Stunden. Die extrahierten Proben wurden bis zur radioimmunologischen Analyse bei -20°C aufbewahrt. | Die mit Glaspulver versetzte Suspension wurde im Vortex geschüttelt, in einen Rotationsmischer gegeben (30 min, 4 °C) und zentrifugiert (2 min, 4000 rpm, 4 °C). Der Überstand wurde abgesaugt, mit 0,5 ml Aqua bidestillata (4 °C) versetzt, geschüttelt und zentrifugiert (5 min, 4000 rpm, 4 °C). Dieser Vorgang wurde mit 0,5 ml 0,1 N HCl wiederholt, der Überstand erneut abgesaugt, mit 0,5 ml 60 % Aceton versetzt, geschüttelt, abermals in den Rotationsmischer gegeben (30 min, 4 °C) und zentrifugiert (10 min, 4000 rpm, 4 °C). Abschließend wurde 0,5 ml Überstand abpipettiert, in ein neues Tube übernommen und über Nacht bei 4 °C offen stehengelassen. Am nächsten Tag erfolgte die Evaporisation in einer Vakuumzentrifuge für etwa 3 Stunden. Die extrahierten Proben wurden bis zur radioimmunologischen Analyse bei -20 °C aufbewahrt. |
Kein Hinweis auf die Quelle. |
| [44.] Mek/Fragment 049 15 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 049, Zeilen: 15-31 |
Quelle: Erhardt 2003 Seite(n): 033-034, Zeilen: 033:23-29; 034:01-06 |
|---|---|
| Das Substanzgemisch des Dialysates wurde mittels Umkehr-Ionenpaar-Chromatographie (reversed-phase ion- pair HPLC) in die einzelnen Bestandteile aufgetrennt. Hierzu wurde im Gegensatz zur Normal-Chromatographie eine Trennsäule benutzt, deren stationäre Phase unpolar (Octadecylsilan: polare Sinolgruppen, modifiziert mit Kohlenwasserstoff-Ketten mit 18 C-Atomen) ist. Die mobile Phase (Fließmittel) war polar. Das Separationsprinzip basiert auf unterschiedlich starken van-der-Waals Kräften zwischen der unpolaren stationären Phase und den unpolaren bis polaren Probesubstanzen. Die analysierten Proben enthalten sowohl kationische als auch anionische Komponenten. Das Auffangen der Ionen wird auf zwei Wegen bewerkstelligt: einerseits werden die Basen durch das Zufügen eines Gegenions (lonenpaar-Reagenz) in das Fließmittel maskiert, andererseits werden die Säuren durch den niedrigen pH-Wert (4,3) protoniert und neutralisiert. Die eingestellte Flussrate an der Pumpe des HPLC-Gerätes betrug vor Beginn der Messung 1,1 ml/Minute; entsprechend wurde das Fließmittel mit einem Druck von 150 bar durch die Säule transportiert. Das Dialysatvolumen umfasste 50pl und wurde ohne Vorreinigung in das HPLC-System injiziert. | [Seite 033]
Das Substanzgemisch des Dialysates wurde mittels Umkehr-Ionenpaar-Chromatographie (reversed-phase ion-pair HPLC) in einzelne Bestandteile aufgetrennt. Hierzu wurde im Gegensatz zur Normal-Chromatographie eine Trennsäule benützt, deren stationäre Phase unpolar (Octadecylsilan: polare Sinolgruppen, modifiziert mit Kohlenwasserstoff-Ketten mit 18 C-Atomen) ist. Die mobile Phase (Fließmittel) war polar. Das Separationsprinzip basiert auf unterschiedlich starken [Seite 034] van-der-Waals Kräften zwischen der unpolaren stationären Phase und den unpolaren bis polaren Probesubstanzen. Die analysierten Proben enthalten sowohl kationische als auch anionische Komponenten. Das Auffangen der Ionen wird auf zwei Wegen bewerkstelligt: einerseits werden die Basen durch das Zufügen eines Gegenions (lonenpaar-Reagenz) in das Fließmittel maskiert, andererseits werden die Säuren durch den niedrigen pH-Wert (4,3) protoniert und neutralisiert. Die eingestellte Flußrate an der Pumpe des HPLC-Gerätes betrug vor Beginn der Messung 1,1 ml/min; entsprechend wurde das Fließmittel mit einem Druck von 150 bar durch die Säule transportiert. Das Dialysatvolumen umfasste 50pl und wurde ohne Vorreinigung in das HPLC-System injiziert. |
Kopie ohne Quellenangabe. |
| [45.] Mek/Fragment 050 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 050, Zeilen: 01-15 |
Quelle: Erhardt 2003 Seite(n): 034-035, Zeilen: 034:12-22; 035:01-04 |
|---|---|
| Die quantitative Bestimmung der Substanzen Dopamin (DA) und 3,4- Dihydroxyphenylessigsäure (DOPAC) wurde durch einen elektrochemischen ANTEC-Detektor (Leiden, Niederlande) bewerkstelligt. Diese Messmethode basiert auf einer Oxidation oder Reduktion der Substanzen an einer Arbeitselektrode, die auf einem konstanten elektrischen Potential gegenüber der Referenzelektrode gehalten wird. Die Oxidationsspannung der Arbeitselektrode betrug +0,8 V im Vergleich zur Referenzelektrode; am ESA-Detektor fand eine Voroxidation mit der Spannung von +0,1V statt und einer Oxidationsspannung von +0,35 V. Die an der Arbeitselektrode entstehende Stromänderung wird als verstärktes Signal zum Schreiber bzw. Integrator weitergeleitet. Das untere Detektionslimit des Systems betrug für Dopamin ca. 0,01 pmol.
Die Peakauswertung erfolgte anhand eines 1) Integratorsystems sowie eines 2) XY- Schreibers. Die Substanzkonzentration ergab sich aus der Höhe des Peaks verrechnet mit der Peakhöhe der Standardsubstanz, deren Konzentration bekannt war (Sillaber et al., 1998). Sillaber, I., Montkowski, A., Landgraf, R., Barden, N., Holsboer, F. & Spanagel, R. (1998) Enhanced morphine-induced behavioural effects and dopamine release in the nucleus accumbens in a transgenic mouse model of impaired glucocorticoid (type II) receptor function: influence of long-term treatment with the antidepressant moclobemide. Neuroscience, 85, 415-425. |
[Seite 034]
Die quantitative Bestimmung der Substanzen Dopamin (DA) und 3,4,- Dihydroxyphenylessigsäure (DOPAC) wurde durch einen elektrochemischen ANTEC-Detektor (Leiden, Niederlande) bewerkstelligt. Diese Meßmethode basiert auf einer Oxidation oder Reduktion der Substanzen an einer Arbeitselektrode, die auf einem konstanten elektrischen Potential gegenüber der Referenzelektrode gehalten wird. Die Oxidationsspannung der Arbeitselektrode betrug +0,8 V im Vergleich zur Referenzelektrode; am ESA-Detektor fand eine Voroxidation mit der Spannung von +0,1V statt und einer Oxidationsspannung von +0,35 V. Die an der Arbeitselektrode entstehende Stromänderung wird als verstärktes Signal zum Schreiber bzw. Integrator weitergeleitet. Das untere Detektionslimit des Systems betrug für Dopamin -0,01 pmol. [Seite 035] Die Peakauswertung erfolgte anhand eines 1) Integratorsystems sowie eines 2) XY-Schreibers. Die Substanzkonzentration ergibt sich aus der Höhe des Peaks verrechnet mit der Peakhöhe der Standardsubstanz, deren Konzentration bekannt ist. |
Kopie ohne Angabe der Quelle. Wie bei Erhardt, so fehlt auch bei Mek bei "+0,1V" das Leerzeichen vor "V", das sich in beiden Texten unmittelbar davor und danach bei "+0,8 V" und "+0,35 V" findet. Das deutet auf eine Übernahme durch Copy & Paste hin. |
| [46.] Mek/Fragment 050 16 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 050, Zeilen: 16-21; 27-31 |
Quelle: Schindele 2003 Seite(n): 047, Zeilen: 01 ff. |
|---|---|
| 2.18 Statistik
Die statistische Auswertung der Daten erfolgte mit Hilfe der Statistik-Software GB-STAT (Version 6.0, Dynamic Microsystems Inc., Silver Springs, USA). Die Ergebnisse sind als Mittelwerte ± Standardfehler des Mittelwertes (SEM) dargestellt. Signifikanz wurde angenommen, wenn die statistische Irrtumswahrscheinlichkeit P<0,05 war. [...] Es wurden ein-, zwei- und dreifaktorielle Varianzanalysen (ANOVA) mit wiederholten Messungen durchgeführt. Post-hoc Tests (Scheffe-, Newman-Keul's- oder Fisher's LSD-Test; parametrische ANOVA) wurden durchgeführt, wenn vorher signifikante Haupt- und / oder Interaktionseffekte der Faktoren auftraten. Die Auswertung diskreter oder prozentualer Verhaltensdaten erfolgte mittels Kruskal-Wallis Einweg-[ANOVA (parameterfrei) gefolgt vom Mann-Whitney U-Test.] |
2.10 Statistik
Die statistische Auswertung der Daten erfolgte mit Hilfe der Statistik-Software GB-STAT (Version 6.0, Dynamic Microsystems Inc., Silver Springs, USA). Die Daten wurden mit Hilfe folgender Testverfahren analysiert: Zweifaktorielle Varianzanalyse (ANOVA) mit wiederholten Messungen. [...] Allerdings wurden diese post hoc Tests erst dann durchgeführt, wenn vorher signifikante Haupt- und / oder Interaktionseffekte der Faktoren auftraten. Die Auswertung diskreter oder prozentualer Verhaltensdaten erfolgte mittels Kruskal-Wallis Einweg-ANOVA gefolgt vom Mann-Whitney U-Test. [...] Die Ergebnisse sind als Mittelwerte ± Standardfehler des Mittelwertes (SEM) dargestellt. Signifikanz wurde angenommen, wenn die statistische Irrtumswahrscheinlichkeit p < 0,05 war(* bedeutet p < 0,05, **bedeutet p < 0,01 vs. andere Dosierungen;# bedeutet p < 0,05,## bedeutet p < 0,01 vs. Basalwerte innerhalb derselben Gruppe). |
Kein Hinweis auf die Quelle. |
| [47.] Mek/Fragment 067 09 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 067, Zeilen: 09-14 |
Quelle: Engelmann 2000 Seite(n): 060, Zeilen: 15-20 |
|---|---|
| Im Gegensatz zum SON, der ausschließlich aus magnozellulären, zur Neurohypophyse projizierenden Neuronen besteht, sind im PVN neben magno- auch parvozelluläre Neuronen morphologisch nachweisbar. Während der erstgenannte Zelltyp funktionell dem HNS zugeordnet wird, stellt die überwiegende Mehrheit der parvozellulären Neurone den zentralnervalen Anteil des HPA-Systems dar. | Im Gegensatz zum SON, der ausschließlich aus magnozellulären, zur Neurohypophyse ziehenden Neuronen besteht, sind im PVN neben magno- auch parvozelluläre Neuronen morphologisch nachweisbar (Armstrong, 1995, siehe Abb. 14). Während der erstgenannte Zelltyp funktionell dem HNS zugeordnet wird, stellt die überwiegende Mehrheit der parvozellulären Neuronen [sic] den zentralnervalen Anteil der HPA-Achse dar.
Armstrong, W. E. (1995). Hypothalamic supraoptic and paraventricular nuclei. In: Paxinos, G. (Hrsg.), The rat nervous system. Academic Press, New York, 377-390. |
Aus dem den Teil 3 abschließenden Diskussionskapitel (3.4). Kein Hinweis auf die Quelle, die in der gesamten Arbeit nirgends genannt ist. |
| [48.] Mek/Fragment 068 12 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 068, Zeilen: 12-20, 23-24 |
Quelle: Holsboer 1999 Seite(n): 295-297, Zeilen: 295: rechtes Spalte, 30-22, 296: linke Spalte, 01-02+62-69; rechte Spalte, 08 ff.; 297: linke Spalte, 29-33 |
|---|---|
| [...] (Modell et al., 1997): Bei Patienten mit Depression sind höhere Dexamethasondosen notwendig, um die bei konstant gehaltener CRH-Dosis induzierten Anstiege von ACTH und Kortisol zu unterdrücken. Es scheint, dass bei physiologischen Alterungsprozessen sowie bei der Depression die subsensitiven oder in ihrer Anzahl reduzierten Kortikosteroidrezeptoren nicht in der Lage sind, die Expression von CRH und AVP im PVN des Hypothalamus zu unterdrücken. Diese Konstellation, die genetisch bedingt zu sein scheint und durch exogene Einflüsse aggraviert werden kann, erhöht das Risiko, an einer Depression zu erkranken, [gleichermaßen wie die Rückfallwahrscheinlichkeit nach Remission (Holsboer et al., 1995; Coplan et al., 1996; Liu et al., 1997; Zobel et al., 1999).]
Die erhöhte zentrale Überaktivität von AVP und CRH wird nicht notwendigerweise durch eine erhöhte Stresshormonkonzentration im Plasma reflektiert, [bei alten Ratten ist dies zwar der Fall, bei depressiven Patienten jedoch nicht (Holsboer, 2000).] Modell, S., Yassouridis, A. , Huber, J. & Holsboer, F. (1997) Corticosteroid receptor function is decreased in depressed patients. Neuroendocrinology, 65, 216-222. Holsboer, F., Lauer, C.J., Schreiber, W. & Krieg, J.-C. (1995) Altered hypothalamicpituitary-adrenocortical regulation in healthy subjects at high familial risk for affective disorders. Neuroendocrinology, 62, 340-347. Coplan, J.D., Andrews, M.W ., Rosenblum , L.A., Owens, M.J., Friedman, S., Gorman, J.M. & Nemeroff, C.B. (1996) Persistent elevatians of cerebraspinal fluid concentrations of corticotropin-releasing factor in adult non-human primates exposed to early-life stressors: implications for the pathophysiology of mood and anxiety disorders. Proceedings of the National Academy of Sciences of the United States of America, 93, 1619-1623. Liu, D., Dioria, J., Tannenbaum, B., Caldji, C., Francis, D., Freedman, A., Sharma, S., Pearson, D., Plotsky, P.M. & Meaney, M.J. (1997) Maternal care, hippocampal glucocorticoid receptors, and the hypothalamic-pituitary-adrenal response to stress. Science, 277, 1659-1662. Zobel, A.W., Yassouridis, A., Frieboes, R-M. & Holsboer, F. (1999) Prediction of medium- term outcome by cortisol response to the combined Dexamethasone - CRH test in patients with remitted depression. American Journal of Psychiatry, 156, 949-951. Holsboer, F. (2000) The corticosteroid receptor hypothesis of depression. Neuropsychopharmacology, 23, 477-501 . |
[Seite 295]
Dabei fand sich, daß bei Patienten mit Depression höhere Dexamethasondosen nötig sind, um die bei konstant gehaltener [Seite 296] CRH-Dosis induzierten Anstiege von ACTH und Kortisol zu unterdrücken (Modell et al. 1997). [...] Aufgrund dieser Subsensitivität sind die Kortikosteroidrezeptoren nicht in der Lage, die Expression von CRH und AVP im PVN des Hypothalamus wirkungsvoll zu unterdrücken. Diese Konstellation, die genetisch bedingt zu sein scheint und durch exogene Einflüsse v.a. in der frühen Entwicklung noch aggraviert werden kann, erhöht das Erkrankungsrisiko. [Seite 297] Es ist aber auch wichtig zu beachten, daß eine zentrale Überaktivität der CRH-Neuronen nicht notwendigerweise durch eine erhöhte Streßhormonkonzentration im Plasma reflektiert wird. Modell S, Yassouridis A, Huber J, Holsboer F (1997) Corticosteroid receptor function is decreased in depressed patients. Neuroendocrinology 65: 216-222 |
Der Autor zitiert teilweise korrekt, verwendet allerdings die Übersetzung der Quelle, ohne diese zu nennen. Ebenfalls kommen Textübernahmen ohne Nennung einer Quelle vor. |
| [49.] Mek/Fragment 068 26 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 068, Zeilen: 26-33 |
Quelle: Engelmann 2000 Seite(n): 033, 050, Zeilen: 033: 03-06, 10-14; 050: 19-22 |
|---|---|
| Interessanterweise folgt die stressorinduzierte AVP- und Oxytozin-Freisetzung aus der Neurohypophyse und der Eminentia mediana keinem generalisierten Profil für alle Stressoren. sondern hängt in hohem Maße vom definierten Stimulus ab (Romero & Sapolsky, 1996) Die intranukleäre Freisetzung ist ebenfalls stressorabhängig, und die zentrale und periphere Freisetzung kann koordiniert oder, wie in der vorliegenden Studie, dissoziiert erfolgen (Wotjak et al., 1996; Engelmann et al., 1998). Die Dissoziation zwischen zentraler und peripherer Freisetzung basiert vermutlich auf der Tatsache, dass der somatodendritischen und axonalen Freisetzung verschiedene [Mechanismen zugrunde liegen: so benötigt nur die letztere die Generierung von Aktionspotentialen (Ludwig et al., 2002).]
Engelmann, M., Wotjak, C.T. & Landgraf, R. (1998) Differential central and peripheral release of vasopressin and oxytocin in response to swim stress in rats. [Review] [15 refs]. Advances in Experimental Medicine & Biology, 449, 175-177. Ludwig, M., Sabatier, N., Bull. P.M., Landgraf, R., Dayanithi, G. & Leng, G. (2002) Intracellular calcium stores regulate activity-dependent neuropeptide release from dendrites. Nature, 418, 85-89. Romero, L.M. & Sapolsky, R.M. (1996) Patterns of ACTH secretion in response to psychological stimuli. Journal of Neuroendocrinology, 8, 243-258. Wotjak, C.T., Kubota, M., Liebsch, G., Montkowski, A., Holsboer, F., Neumann, I. & Landgraf, R. (1996) Release of vasopressin within the rat paraventricular nucleus in response to emotional stress: a novel mechanism of regulating adrenocorticotropic hormone secretion? The Journal of Neuroscience, 16, 7725-7732. |
[Seite 33]
Interessanterweise folgt die stessorinduzierte [sic] AVP- und OXT-Freisetzung aus der Neurohypophyse und der Eminentia mediana keinem generalisierten Profil für alle Stressoren, sondern hängt in hohem Maße vom definierten Stimulus ab (Kasting, 1988; siehe auch Übersichtsartikel von Romero & Sapolsky, 1996). [...] Diese intranukleäre Freisetzung von AVP und OXT wird nicht nur unterschiedlich von emotionalem Streß beeinflußt (Wotjak et al., 1996b), sondern es konnte auch nachgewiesen werden, daß unter pharmakologischen Bedingungen die zentrale und periphere Freisetzung sowohl koordiniert als auch dissoziiert sein kann (Neumann et al., 1993). [Seite 50] Die Dissoziation zwischen zentraler und peripherer Freisetzung basiert mutmaßlich auf unterschiedlichen Mechanismen, die der somatodendritischen und axonalen Freisetzung zugrunde liegen; z. B. bedarf nur letztere der Generierung von Aktionspotentialen (Di Scala-Guenot, 1987; Ludwig et al., 1995). Di Scala-Guenot, D., Strosser, M.T., Richard, P. (1987). Electrical stimulations of perifused magnocellular nuclei in vitro elicit Ca2+-dependent, tetrodotoxin-insensitive release of oxytocin and vasopressin. Neurosci. Lett. 76, 209-214. Kasting, N.W. (1988). Simultaneous and independent release of vasopressin and oxytocin in the rat. Can. J. Physiol. Pharmacol. 66, 22-26. Ludwig, M., Callahan, M.F., Morris, M. (1995). Effects of tetrodotoxin on osmotically stimulated central and peripheral vasopressin and oxytocin release. Neuroendocrinology 62, 619-627. Neumann, I., Ludwig, M., Engelmann, M., Pittman, Q.J., Landgraf, R. (1993). Simultaneous microdialysis in blood and brain: oxytocin and vasopressin release in response to central and peripheral osmotic stimulation and suckling in the rat. Neuroendocrinology 58, 637-645. Romero, L.M., Sapolsky, R.M. (1996). Patterns of ACTH secretion in response to psychological stimuli. J. Neuroendocrinol. 8, 243-258. Wotjak, C.T., Kubota, M., Liebsch, G., Montkowski, A., Holsboer, F., Neumann, I., Landgraf, R. (1996b). Release of vasopressin within the rat paraventricular nucleus in response to emotional stress: a novel mechanism of regulating adrenocorticotropic hormone secretion? J. Neurosci. 16, 7725-7732. |
Kein Hinweis auf die eigentliche Quelle, die in der gesamten Arbeit nirgends genannt ist. Fortsetzung auf der nächsten Seite. |
| [50.] Mek/Fragment 069 02 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 069, Zeilen: 02-07, 11-16 |
Quelle: Engelmann 2000 Seite(n): 006, 007, 033, 051, Zeilen: 006: 08-12; 007: 01-03; 033: 14-21; 051: 13-16 |
|---|---|
| Hierbei kann AVP, auf verschiedenen Ebenen freigesetzt, die Aktivität der HPA-Achse unterschiedlich beeinflussen: Auf der Ebene des Hypothalamus hat es einen möglicherweise hemmenden Einfluss über die gabaerge Innervation des parvozellulären Teils des PVN (Wotjak et al., 1996), wohingegen AVP auf den Ebenen der Eminentia mediana und der Adenohypophyse die ACTH-Freisetzung stimuliert (Antoni, 1993a).
[...] In diesem Kontext ist es wichtig zu beachten, dass die magnozellulären Neurone AVP - über kurze Portalgefäße oder aus Axonen en passant in der Zona interna der Eminentia mediana - auch von der Neurohypophyse ins Portalblut sezernieren können, was auf eine direkte Einflussnahme des HNS auf die ACTH-Sekretion (HPA-Achse) hindeutet (Antoni, 1993b; Wotjak et al., 1996). Antoni, F.A. (1993) Vasopressinergic control of pituitary-adrenocorticotropin secretion comes of age. Frontiers in Neuroendocrinology, 14, 76-122. Wotjak, C.T., Kubota, M., Liebsch, G., Montkowski, A., Holsboer, F., Neumann, I. & Landgraf, R. (1996) Release of vasopressin within the rat paraventricular nucleus in response to emotional stress: a novel mechanism of regulating adrenocorticotropic hormone secretion? The Journal of Neuroscience, 16, 7725-7732. |
[Seite 33]
Ein Verständnis der Regulation der Freisetzung der Nonapeptide in die Kompartimente Gehirn und Blut innerhalb des HNS scheint insbesondere deshalb wichtig, weil AVP, auf verschiedenen Ebenen freigesetzt, die Aktivität der HPA-Achse unterschiedlich zu beeinflussen vermag: Auf der Ebene des Hypothalamus hat das Nonapeptid einen potentiell inhibitorischen Einfluß (Kalsbeek et al., 1996; Wotjak et al., 1996a), wohingegen AVP auf den Ebenen Eminentia mediana und Adenohypophyse die ACTH-Freisetzung stimuliert (Antoni, 1993). [Seite 51] Darüber hinaus scheint im PVN freigesetztes AVP einen inhibitorischen Einfluß auf die ACTH-Sekretion auszuüben (Wotjak et al., 1996b), mutmaßlich über eine GABAerge Innervation des parvozellulären Teils des PVN. [Seite 6] So könnten AVP und OXT über die kurzen Portalgefäße von der Neurohypophyse zur Adenohypophyse gelangen (Bergland & Page, 1978; Sawchenko et al., 1992). Zusätzlich gibt es Hinweise dafür, daß sowohl AVP als auch OXT aus Axonen magnozellulärer Neuronen [sic] des PVN und SON in der inneren Zone der Eminentia [Seite 7] mediana "en passant" freigesetzt werden (Holmes et al., 1986; Buma & Nieuwenhuys, 1987; Wotjak et al., 1996a), was auf eine direkte Einflußnahme des HNS auf die ACTH-Sekretion hindeutet. Antoni, F.A. (1993). Vasopressinergic control of pituitary adrenocorticotropin secretion comes of age. Front. Neuroendocrinol. 14, 76-122. Bergland, R.M., Page, R.B. (1978). Can the pituitary secrete directly to the brain? (Affirmative anatomical evidence). Endocrinology 102, 1325-1338. Buma, P., Nieuwenhuys, E. (1987). Ultrastructural demonstration of oxytocin and vasopressin release sites in the neural lobe and median eminence of rats by tannic acid and immunogold methods. Neurosci. Lett. 74, 151-157. Holmes, M.C., Antoni, F.A., Aguilera, G., Catt, K.J. (1986). Magnocellular axons in passage through the median eminence release vasopressin. Nature 319, 326-329. Kalsbeek, A., Heerikhuize, J.J., Wortel, J., Buijs, R.M. (1996). A diurnal rhythm of stimulatory input to the hypothalamo-pituitary-adrenal system as revealed by timed intrahypothalamic administration of the vasopressin V1 antagonist. J. Neurosci. 16, 5555-5565. Sawchenko, P.E., Cunningham, E.T., Bittencourt, J.C., Chan, R.K.W. (1992). Aminergic and peptidergic pathways subserving the stress response. In: Kvetnansky, R., McCarty, R., Axelrod, J. (Hrsg.), Stress: neuroendocrine and molecular approaches. Gordon and Breach Science Publishers, New York, 15-27. Wotjak, C.T., Kubota, M., Kohl, G., Landgraf, R. (1996a). Release of vasopressin from supraoptic neurons within the rat median eminence in vivo. A combined microdialysis and push-pull perfusion study in the rat. Brain Res 726, 237-241. Wotjak, C.T., Kubota, M., Liebsch, G., Montkowski, A., Holsboer, F., Neumann, I., Landgraf, R. (1996b). Release of vasopressin within the rat paraventricular nucleus in response to emotional stress: a novel mechanism of regulating adrenocorticotropic hormone secretion? J. Neurosci. 16, 7725-7732. |
Fortsetzung von der Vorseite. Kein Hinweis auf die eigentliche Quelle, die in der gesamten Arbeit nirgends genannt ist. Der Verfasser setzt seine Ausführungen aus verschiedenen Stellen der Quelle zusammen. Man beachte auch, dass er Wotjak et al. (1996) die Äußerung eines Sachverhalts („über die gabaerge Innervation des parvozellulären Teils des PVN“) zuschreibt, die gemäß der Quelle eine Mutmaßung von Engelmann (2000) zu sein scheint. Für Antoni wird im Literaturverzeichnis der untersuchten Arbeit nur ein einziger Titel ausgewiesen. |
| [51.] Mek/Fragment 070 08 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 070, Zeilen: 08-15 |
Quelle: Holsboer 1999 Seite(n): 299, Zeilen: rechte Spalte, 12ff |
|---|---|
| Das Ligandensignal wird nach Rezeptoraktivierung, Dimerisierung und nukleärer Translokation entweder über Transaktivierung nach Bindung an spezifische Response-Elemente in der Promotorregion eines Gens unter Miteinbeziehung anderer Transkriptionsfaktoren oder durch Protein-Protein-Wechselwirkung umgesetzt (Müller et al., 2002). Darüber hinaus hängt die Kortikosteroidrezeptorfunktion wesentlich von der Wechselwirkung mit Chaperonen ab, die das Steroidrezeptormolekül in eine bindungsaktive Konfiguration überführen (Hendrick & Hartl, 1993; Schmidt et al., 2003).
Müller, M.B., Holsboer, F. & Keck, M.E. (2002) Genetic modification of corticosteroid receptor signalling: Novel insights into pathophysiology and treatment strategies of human affective disorders [Review]. Neuropeptides, 36, 117-131. Hendrick, J.P. & Hartl, F.U. (1993) Molecular chaperone functions of heat-shock proteins. Annual Review of Biochemistry, 62, 349-384. Schmidt, U., Wochnik, G.M., Rosenhagen, M.C., Young, J.C., Hartl, F.U., Holsboer, F. & Rein, T. (2003) Essential role of the unusual DNA-binding motif of BAG-1 for inhibition of the glucocorticoid receptor. Journal of Biological Chemistry, 278, 4926-4931. |
Der Mechanismus, durch den Antidepressiva die Synthese von Kortikosteroidsteroidrezeptoren stimulieren bzw. die Steigerung der Effizienz erreichen, mit der das Hormonsignal nach Rezeptoraktivierung entweder über Transaktivierung nach Bindung an spezifische Response-Elemente in der Promotorregion eines Gens und Kooperation durch andere Transkriptionsfaktoren oder durch Protein-Protein-Wechselwirkung umgesetzt wird, ist derzeit noch nicht gut verstanden (s. Kapitel 2.4.5.4 „Normalisierung des HPA-Systems durch Antidepressiva“). Weiterhin muß bedacht werden, daß die Kortikosteroidrezeptorfunktion auch von der Wechselwirkung mit Chaperonen (z.B. Heat-shock-Proteinen) abhängt. Diese ubiquitären Proteine überführen das Steroidrezeptormolekül in eine bindungsaktive Konfiguration. |
Der Autor verwendet Textfragmente aus der Vorlage und verknüpft diese mit Publikationen, die erst nach Holsboer (1999) erschienen sind (Müller et al. 2002; Schmidt et al., 2003). |
| [52.] Mek/Fragment 070 21 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 070, Zeilen: 21-30 |
Quelle: Engelmann 2000 Seite(n): 089, 094, Zeilen: 089: 04-10; 094: 08-15 |
|---|---|
| Intraseptal freigesetztes AVP ist in die Verhaltensregulation von Säugern involviert und moduliert nicht nur Gedächtnis- und Lernprozesse, sondern spielt zudem eine zentrale Rolle bei der Verarbeitung von Informationen, die in engem Kontext zur Emotionalität stehen (Engelmann et al., 1996). Aufgrund der Tatsache, dass stets Interaktionen zwischen verschiedenen Neurotransmitter-/Neuromodulator-Systemen an der Regulation komplexer Verhaltensweisen beteiligt sind, ist CRH ein möglicher Interaktionspartner von septalem AVP, da im Septum Terminalen CRH-haltiger Fasern und spezifische Bindungsstellen für CRH beschrieben wurden (Chalmers et al., 1995; Lovenberg et al., 1995a).
Chalmers, D.T., Lovenberg, T.W. & De Souza, E.B. (1995) Localization of novel corticotropin-releasing factor receptor (CRF2) mRNA expression to specific subcortical nuclei in rat brain: comparison with CRF1 receptor mRNA expression. J Neuroscience, 15, 6340-6350. Engelmann, M., Wotjak, C.T., Neumann, I., Ludwig, M. & Landgraf, R. (1996) Behavioral consequences of intracerebral Vasopressin and Oxytocin: focus on learning and memory. Neuroscience and Biobehavioral Reviews, 20, 341-358. Lovenberg, T.W., Chalmers, D.T., Liu, C. & De Souza, E.B. (1995a) CRF2 alpha and CRF2 beta receptor mRNAs are differentially distributed between the rat central nervous system and peripheral tissues. Endocrinology, 136, 4139-4142. |
[Seite 89]
Verschiedene Befunde deuten darauf hin, daß - obwohl kein generelles lern- und gedächtnisverbesserndes Peptid - intraseptal freigesetztes AVP kritisch in die Verhaltensregulation von Säugern involviert ist (siehe Übersichtsartikel von Engelmann et al., 1996b). Zusätzlich zu der postulierten Bedeutung für Lern- und Gedächtnisprozesse gibt es Hinweise darauf, daß das Septum eine zentrale Rolle bei der Verarbeitung von Informationen spielt, die in engem Kontext zur Emotionalität von Nagetieren stehen: [...] [Seite 94] Die zunehmende Erkenntnis, daß Interaktionen zwischen verschiedenen Neurotransmitter-/Neuromodulator-Systemen an der Verhaltensregulation beteiligt sind, provoziert die Frage nach möglichen anderen Substanzen, die als Signale in der interneuronelen [sic] Kommunikation wirken und mit denen intraseptal freigesetztes AVP interagieren könnte. Das CRH ist einer der Kandidaten, der gemeinsam mit AVP die Verhaltensreaktion der Tiere bestimmen könnte (Elkabir et al., 1990). So wurden im Septum Terminalen von CRH-haltigen Fasern (Sakanaka et al., 1988) und spezifische Bindungsstellen für CRH beschrieben (Liebsch et al., 1995). Elkabir D.R., Wyatt M.E., Vellucci S.V., Herbert J. (1990). The effects of separate or combined infusions of corticotropin-releasing factor and vasopressin either intraventricularly or into the amygdala on aggressive and investigative behavior in the rat. Regul. Peptides 28, 199-214. Engelmann, M., Wotjak, C.T., Neumann, I., Ludwig, M., Landgraf, R. (1996). Behavioral consequences of intracerebral vasopressin and oxytocin: focus on learning and memory. Neurosci. Biobehav. Rev. 20, 341-358. Liebsch, G., Landgraf, R., Gerstberger, R., Probst, J.C., Wotjak, C.T., Engelmann, M., Holsboer, F., Montkowski, A. (1995). Chronic infusion of a CRH1 receptor antisense oligodeoxynucleotide into the central nucleus of the amygdala reduced anxiety-related behavior in socially defeated rats. Regul. Peptides 59, 229-239. Sakanaka, M., Magari, S., Shibasaki, T., Lederis, K. (1988). Corticotropin-releasing factor-containing [sic] afferents to the lateral septum of the rat brain. J. Comp. Neurol. 270, 404-415. |
Mit diesem Fragment endet das den Teil 3 beschließende Diskussionskapitel (3.4) der Arbeit. Kein Hinweis auf die eigentliche Quelle, die in der gesamten Arbeit nirgends genannt ist. |
| [53.] Mek/Fragment 071 05 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 071, Zeilen: 05-16 |
Quelle: Holsboer 1999 Seite(n): 303, Zeilen: li. Sp. 21 ff., re. Sp. 1 ff. |
|---|---|
| Untersuchungen an Patienten mit erhöhter HPA-Aktivität im Rahmen einer Depression konnten nachweisen, dass Antidepressiva mit völlig unterschiedlichem pharmakologischem Wirkprofil die HPA-Aktivität normalisieren können (Barden et al., 1995; Künzel et al., 2003a; Nickel et al., 2003). Worauf dieser Effekt beruht, ist derzeit noch nicht vollständig geklärt. Der Einfluss der Antidepressiva ist mit deren Wirkung auf die zentralen Kortikosteroidrezeptoren erklärt worden (Reul et al., 1993a, 1994), wobei durch antidepressiv wirksame Pharmaka die Synthese und Signalfunktion der subsensitiven Rezeptoren erhöht und dadurch deren negative Rückkopplung auf CRH- und AVP-exprimierende Neuronen verstärkt werden soll (Holsboer, 2000). Da eine erhöhte CRH- und AVP-Sekretion nicht nur die HPA-Achse aktiviert, sondern zudem depressionstypische Symptome verursachen kann, erscheint diese Hypothese plausibel.
Barden, N., Reul, J.M. & Holsboer, F. (1995) Do antidepressants stabilize mood through actions on the hypothalamic-pituitary-adrenocortical system?. [sic] [Review] [53 refs]. Trends in Neurosciences, 18, 6-11. Holsboer, F. (2000) The corticosteroid receptor hypothesis of depression. Neuropsychopharmacology, 23, 477-501. Künzel, H.E., Binder, E.B., Nickel, T., Ising, M., Fuchs, B., Majer, M., Pfennig, A., Ernst, G., Kern , N., Schmid, D.A., Uhr, M., Holsboer, F. & Modell, S. (2003a) Pharmacological and nonpharmacological factors influencing hypothalamicpituitary-adrenocortical axis reactivity in acutely depressed psychiatric inpatients, measured by the Dex-CRH test. Neuropsychopharmacology, in press. Nickel, T., Sonntag, A., Schill, J., Zobel, A.W., Ackl, N., Brunnauer, A., Murck, H., Ising, M., Yassouridis, A., Steiger, A., Zihl, J. & Holsboer, F. (2003) Clinical and neurobiological effects of tianeptine and paroxetine in major depression. Journal of Clincal [sic] Psychopharmacology, 23, 155-168. Reul, J.M.H.M. , Stec, I., Söder, M. & Holsboer, F. (1993) Chronic treatment of rats with the antidepressant amitriptyline attenuates the activity of the hypothalamic-piutuitary-adrenocortical system. Endocrinology, 133, 312-320. Reul, J.M.H.M., Labeur, M.S., Grigoriadis, D.E., De Souza, E.B. & Holsboer, F. (1994) Hypothalamic-pituitary-adrenocortical axis changes in the rat after long-term treatment with reversible monoamine oxidase-A inhibitor moclobemide. Neuroendocrinology, 60, 509-519. |
Untersuchungen an Patienten mit erhöhter HPA-Aktivität im Rahmen einer Depression haben gezeigt, daß Antidepressiva mit ganz unterschiedlichem pharmakologischem Wirkprofil die HPA-Aktivität zu normalisieren vermögen. Dieser neuroendokrine Effekt eilt zeitlich fast immer der psychopathologischen Wirkung voraus (Abb. 2.4.16). Ähnlich fand sich auch bei Ratten oder Mäusen, deren HPA-Aktivität durch DNA-Rekombination oder selektives Züchten genetisch bedingt erhöht war, nach längerer Antidepressivabehandlung ein deutlich HPA-suppressiver Effekt. Der Einfluß der Antidepressiva ist mit deren Wirkung auf die zentralen Kortikosteroidrezeptoren (MR und GR) erklärt worden (Übersicht: Holsboer und Barden 1996). Dabei sollen durch Antidepressiva die Synthese der Steroidrezeptoren und/oder deren Signalfunktion und hierdurch u.a. die negative Rückkopplung auf CRH- und AVP-exprimierende Neuronen gesteigert werden. Da eine erhöhte CRH-Sekretion nicht nur die HPA-Achse überaktiviert, sondern auch eine Reihe depressionstypischer Symptome zu verursachen scheint, liegt es nahe, in der Verbesserung der negativen Rückkopplung auf die CRH-Synthese und Sekretion durch Kortikosteroidrezeptoren einen Wirkmechanismus der Antidepressiva zu vermuten.
Holsboer F, Barden N (1996) Antidepressants and HPA regulation. Endocr Rev 17: 187–205 |
Zwar wird der übernommene Inhalt teilweise modifiziert und werden Referenzen hinzugefügt, doch unterbleibt der Hinweis auf die eigentliche (deutschsprachige) Quelle. Man beachte außerdem, dass bei Holsboer (2000) – im Gegensatz zur Quelle Holsboer (1999) – an keiner Stelle von subsensitiven Rezeptoren die Rede ist. |
| [54.] Mek/Fragment 080 03 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 080, Zeilen: 03-10 |
Quelle: Holsboer 1999 Seite(n): 274, Zeilen: re. Sp. 03 ff. |
|---|---|
| Die Entdeckung der antidepressiven Wirkung von Imipramin und Monoaminooxidasehemmern sowie die stimmungsverschlechternde Wirkung von Reserpin, welches Katecholaminvesikel entspeichert, führten zur Entwicklung der Monoaminmangel-Hypothesen. Diese basieren auf der Annahme einer reduzierten präsynaptischen Freisetzung und postsynaptischen Verfügbarkeit biogener Amine und dominierten lange Zeit sowohl die Forschungsanstrengungen zu Ätiologie und Pathogenese der Depression als auch die Weiterentwicklung von Antidepressiva (Holsboer, 1999a; Ressler & Nemeroff, 2000).
Holsboer, F. (1999a) The rationale for corticotropin-releasing hormone receptor (CRH-R) antagonists to treat depression and anxiety. [Review] [163 refs]. Journal of Psychiatric Research, 33, 181-214. Ressler, K.J. & Nemeroff, C.B. (2000) Role of serotonergic and noradrenergic systems in the pathophysiology of depression and anxiety disorders. Depression and Anxiety, 12, 2-19. |
Die Entdeckung der antidepressiven Wirkung von Imipramin und Monoaminoxidasehemmern sowie die stimmungsverschlechternde Wirkung von Reserpin, das die Katecholaminvesikel entspeichert, führten zu Depressionshypothesen, die auf der Annahme einer verminderten präsynaptischen Freisetzung und postsynaptischen Verfügbarkeit biogener Amine basierten. Diese Hypothesen wurden in den letzten 10 Jahren erheblich – unter Einbeziehung veränderter Rezeptorfunktion und nachgeschalteter zellulärer Vorgänge – erweitert. In ihrer hierdurch modifizierten Form sind die Monoaminmangelhypothesen“ [sic] heute noch der wichtigste Ausgangspunkt für die Entwicklung neuer Generationen von Antidepressiva. |
Referenziert wird zwar u.a. ein (englischsprachiger) Artikel von Holsboer, übernommen wird jedoch mit leichten Modifikationen aber erkennbar aus einem deutschen Text desselben Autors. Dieser Text wird hier wiederholt verwendet – vgl. Fragment 020 01. Zudem findet sich bei Holsboer (1999a) keine Aussage über eine „Annahme einer reduzierten präsynaptischen Freisetzung und postsynaptischen Verfügbarkeit biogener Amine“ (der Aufsatz von Ressler & Nemeroff (2000) wurde diesbzgl. nicht überprüft). |
| [55.] Mek/Fragment 085 03 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 085, Zeilen: 03-18 |
Quelle: Schindele 2003 Seite(n): 011; 026, Zeilen: 011:03-07,13-21; 026:02-07 |
|---|---|
| Benzodiazepine gehören zu den am häufigsten verordneten Arzneimitteln. Auf Grund ihrer anxiolytischen und entspannenden Wirkung werden sie bevorzugt bei Angst als Leitsymptom verschiedener Angsterkrankungen und affektiver Störungen sowie bei Erregungs- und Anspannungszuständen eingesetzt. Ein klassischer Vertreter dieser Stoffgruppe ist Temazepam, das beim Abbau von Diazepam in einem Nebenstoffwechselweg entsteht. Eine gewisse Sonderstellung nimmt Alprazolam ein, das auf Grund des Triazolringes als Triazolobenzodiazepin bezeichnet wird: Dieser Substanz wurde von verschiedenen Autoren (Dawson et al., 1984; Birkenhäger et al., 1995) eine antidepressive, d.h. stimmungsaufhellende und antriebssteigernde, Wirkung zugeschrieben. Deshalb wird Alprazolam teilweise auch in der Therapie der Depression eingesetzt, v.a. bei depressiven Episoden, welche mit ausgeprägten Angstsymptomen verbunden sind oder eine Komorbidität mit Angsterkrankungen aufweisen. In der vorliegenden Studie wurde auf verschiedenen neuroendokrinen Ebenen der Einfluss des Triazolobenzodiazepins Alprazolam und des Benzodiazepins Temazepam auf die durch den Verhaltensstressor des Forced Swimming verursachte Aktivierung der HPA-Achse untersucht.
Dawson, G.W. , Jue, S.G. & Brogden, R.N. (1984) Alprazolam: a review of its pharmacodynamic properties and efficacy in the treatment of anxiety and depression. Drugs, 27, 132-147. Birkenhäger, T.K., Moleman, P. & Nolen, W.A. (1995) Benzodiazepines for depression? A review of the literature. International Clinical Psychopharmacology, 10, 181-195. |
[Seite 011]
Die Benzodiazepine besitzen ein weites Feld der Indikationen (Forth et al., 1998) in der Psychiatrie, der Neurologie, der Anästhesie und der Inneren Medizin. Sie gehören deshalb zu den am häufigsten verordneten Arzneimitteln. Auf Grund ihrer anxiolytischen und entspannenden Wirkung werden sie bevorzugt bei Angst als Leitsymptom verschiedener Angsterkrankungen und affektiver Störungen sowie bei Erregungs- und Anspannungszuständen eingesetzt. [...] Ein klassischer Vertreter dieser Stoffgruppe ist Temazepam, das beim Abbau von Diazepam in einem Nebenstoffwechselweg entsteht. Eine gewisse Sonderstellung nimmt Alprazolam ein, das auf Grund des Triazolringes ein sog. Triazolobenzodiazepin1 ist: Dieser Substanz wurde von verschiedenen Autoren (Birkenhäger et al., 1995; Dawson et al., 1984; O'Connor et al., 1985; Von Voigtlander & Straw, 1985) eine antidepressive, d.h. stimmungsaufhellende und antriebssteigernde Wirkung zugeschrieben. Deshalb wird es bei Depressionen eingesetzt, v. a. bei depressiven Episoden, welche mit ausgeprägten Angstsymptomen verbunden sind oder eine Komorbidität mit Angsterkrankungen aufweisen. [Seite 026] Die beschriebenen Sachverhalte bilden den Hintergrund für die Aufgabenstellung der vorliegenden Arbeit: Sie untersucht auf verschiedenen neuroendokrinen Ebenen den Einfluss des Triazolobenzodiazepins Alprazolam, dem von verschiedenen Autoren eine antidepressive Wirkung zugeschrieben wird (Birkenhäger et al., 1995; Dawson et al., 1984; O'Connor et al., 1985; Von Voigtlander & Straw, 1985), und des Benzodiazepins Temazepam auf die durch den Verhaltensstressor des „Forced swimming“ verursachte Aktivierung der HPA-Achse. 1 Die Strukturformeln der beiden Benzodiazepine finden sich im Kapitel 2.4 „Verwendete Substanzen". Forth W, Henschler D, Rummel W und Starke K (Hrsg.) (1998) Allgemeine und spezielle Pharmakologie und Toxikologie, Spektrum Akademischer Verlag, 7. Auflage, Heidelberg, Berlin, Oxford. Birkenhäger T K, Moleman P und Nolen W A (1995) Benzodiazepines for depression? A review of the literature, in: International Clinical Psychopharmacology 10: 181-195. Dawson G W, Jue S G und Brogden RN (1984) Alprazolam. A review of its pharmacodynamic properties and efficacy in the treatment of anxiety and depression, in: Drugs 27: 132-147. O'Connor W T, Earley B und Leonard B E (1985) Antidepmssant properties of the triazolobenzodiazepines alprazolam and adinazolam. Studies on the olfactory bulbectomized rat model of depression, in: British Journal of Clinical Pharmacology 19: 45-56. Von Voigtlander P F und Straw R N (1985) Alprazolam. Review of pharmacological, pharmacokinetic, and clinical data, in: Drug Development Research 6:1-12. |
Anfang (und größter Teil) des Kapitels "4.2.1 Ausgangspunkt und Fragestellung". Kein Hinweis auf die eigentliche Quelle. |
| [56.] Mek/Fragment 086 05 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 86, Zeilen: 05-17 |
Quelle: Schindele 2003 Seite(n): 040-041, Zeilen: 040: Abbildung; 041:01-13 |
|---|---|

BE : 1. Blutentnahme 45 Minuten nach Versuchsbeginn (Basalwert): BE 2: 2. Blutentnahme 105 Minuten nach Versuchsbeginn (Basalwert): BE 3: 3. Blutentnahme 5 Minuten nach dem Forced Swimming: BE 4: 4. Blutentnahme 15 Minuten nach dem Forced Swimming: BE 5: 5. Blutentnahme 50 Minuten nach dem Forced Swimming: A/T/V: Gabe von Alprazolam (A), Temazepam (T) oder Vehikel (V) nach dem Wechsel des zweiten Sammelröhrchens Forced Swimming: 5 Minuten bei 23 °C nach dem Wechsel des vierten Sammelröhrchens |
[Seite 040]
[Seite 041] BE 1: 1. Blutentnahme 45 Minuten nach Versuchsbeginn (Basalwert) BE 2: 2. Blutentnahme 105 Minuten nach Versuchsbeginn (Basalwert) BE 3: 3. Blutentnahme 5 Minuten nach dem „Forced swimming“ BE 4: 4. Blutentnahme 15 Minuten nach dem „Forced swimming“ BE 5: 5. Blutentnahme 50 Minuten nach dem „Forced swimming“ A/T/V: Gabe von Alprazolam (A), Temazepam (T) oder Vehikel (V) nach dem Wechsel des 2. Tube „Forced swimming“: 5 Minuten bei 23 °C nach dem Wechsel des 4. Tube |
Gleicher Inhalt bei teilweise anderer Bezeichnung. |
| [57.] Mek/Fragment 087 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 087, Zeilen: 01-12 |
Quelle: Schindele 2003 Seite(n): 049-050, Zeilen: 049:02-03, 06-07; 050:01-04, 07-08, 11; 051:01 |
|---|---|
| 4.2.3 Verhaltenscharakterisierung: Wirkung von Alprazolam und Temazepam auf das Schwimmverhalten
Abbildung 16 zeigt die prozentualen Anteile der verschiedenen Verhaltensstrategien (Floating, Swimming, Struggling) während der fünfminütigen Exposition. Ein Vergleich der prozentualen Anteile unter den verschiedenen Dosierungen (Kruskal-Wallis) ergab nur für den Parameter Struggling signifikante Unterschiede unter den verschiedenen Dosierungen für Alprazolam (Mann-Whitney Test, P<0,05). Im Vergleich zur Vehikelbedingung findet sich für keine der verabreichten Konzentrationen von Alprazolam ein signifikanter Unterschied. Floating zeigte unter Alprazolam keine signifikanten Veränderungen. Temazepam hatte ebenfalls keinen signifikanten Einfluss auf das Schwimmverhalten. |
[Seite 049]
3.1 Verhaltenscharakterisierung: Wirkung von Alprazolam und Temazepam auf das Schwimmverhalten [...] Abbildung 3.1 zeigt die prozentualen Anteile der verschiedenen Verhaltensstrategien („Floating“, „Swimming“, „Struggling“) während der 5-minütigen Exposition: [Abb. 3.1]
Ein Vergleich der prozentualen Anteile unter den verschiedenen Dosierungen (Kruskal-Wallis Einweg-ANOVA) ergab nur bei „Struggling“ signifikante Unterschiede und zwar nur unter Alprazolam. Die Unterschiede waren signifikant zwischen der Dosierung 0,5 mg/kg und jeder der zwei anderen (Mann-Whitney U-Test, p < 0,05). [...] Im Vergleich zur Vehikelbedingung findet sich in keiner der verabreichten Konzentrationen von Alprazolam ein signifikanter Unterschied. [...] Das „Floating“ zeigt unter Alprazolam keine signifikanten Veränderungen. Temazepam hat [Seite 051] ebenfalls keinen signifikanten Einfluss auf das Schwimmverhalten: [...] |
Text und Abbildung ohne Quellenangabe übernommen. Geringfügige Umformulierungen bei gleichenm Inhalt. |
| [58.] Mek/Fragment 088 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 088, Zeilen: 01 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 051-054, Zeilen: 051:07-13; 052:13-20; 053:13-20; 054:07-08 |
|---|---|
| 4.2.4 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von AVP im PVN und im Plasma
In den Abbildungen 17 und 18 sowie den Abbildungen 19, 20 und 21 sind die unterschiedlichen zentralen und peripheren Freisetzungsprofile von AVP auf den Verhaltensstressor des Forced Swimming nach Gabe von Alprazolam, Temazepam oder Vehikel dargestellt. PVN: Alprazolam erhöhte signifikant (Kontrasttests in ANOVA mit post hoc-Scheffe Test) in allen drei getesteten Konzentrationen die zentrale, stressorinduzierte Freisetzung von AVP im PVN in ähnlicher Weise: Bei einer Dosierung von 0,5 mg/kg war bei Dialysat 5 und 6 P<0,05 vs. Basalwerte und bei Dialysat 5 und 6 P<0,05 vs. Vehikel; bei einer Dosierung von 1,0 mg/kg war bei Dialysat 5 und 6 p < 0,01 vs. Basalwerte und bei Dialysat 5 und 6 P<0,01 vs. Vehikel; sowie bei einer Dosierung von 3,0 mg/kg war bei Dialysat 5 P<0,05 vs. Basalwerte und bei Dialysat 5 P<0,05 vs.Vehikel. Die Erhöhung der AVP-Konzentration unter Vehikel während und nach dem Forced Swimming erreichte keine statistische Signifikanz. Temazepam erhöht dosisabhängig die zentrale, stressorinduzierte Freisetzung von AVP im PVN: Nur bei den Konzentrationen von 1,0 mg/kg und 3,0 mg/kg zeigte der AVP-Anstieg eine statistische Signifikanz im Vergleich zu 0,5 mg/kg und Vehikel (Kontrasttests in ANOVA): Bei einer Dosierung von 1,0 mg/kg war bei Dialysat 5 P<0,01 vs. Basalwerte und bei Dialysat 5 P<0,01 vs. Vehikel; sowie bei einer Dosierung von 3,0 mg/kg war bei Dialysat 5 und 6 P<0,01 vs. Basalwerte, bei Dialysat 5 P<0,01 vs. Vehikel und bei Dialysat 6 P<0,05 vs. Vehikel. Bei einer Konzentration von 0,5 mg/kg kam es im Vergleich zu Vehikel zu keiner signifikanten Änderung. Plasmakonzentrationen von AVP: Weder nach Gabe von Alprazolam oder Temazepam kam es nach Forced Swimming zu signifikanten Veränderungen der AVP-Plasmakonzentrationen. |
[Seite 51]
3.2 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von AVP im PVN und im Plasma In den Abbildungen 3.3 und 3.4 sowie den Abbildungen 3.5 und 3.6 sind die unterschiedlichen zentralen und peripheren Freisetzungsprofile von AVP auf den Verhaltensstressor des „Forced swimming“ nach der Gabe von Alprazolam, Temazepam oder Vehikel dargestellt. [Seite 52] Alprazolam erhöht demnach signifikant (Kontrasttests in ANOVA) in allen drei getesteten Konzentrationen die zentrale, stressorinduzierte Freisetzung von AVP im PVN in ähnlicher Weise: Bei einer Dosierung von 0,5 mg/kg ist bei Dialysat 5 und 6 p < 0,05 vs. Basalwerte (#) und bei Dialysat 5 und 6 p < 0,05 vs. Vehikel (*); bei einer Dosierung von 1,0 mg/kg ist bei Dialysat 5 und 6 p < 0,01 vs. Basalwerte (##) und bei Dialysat 5 und 6 p < 0,01 vs. Vehikel (**); sowie bei einer Dosierung von 3,0 mg/kg ist bei Dialysat 5 p < 0,05 vs. Basalwerte (#) und bei Dialysat 5 p < 0,05 vs. Vehikel (*). Die Erhöhung der AVP-Konzentration unter Vehikel während und nach dem „Forced swimming“ erreicht keine statistische Signifikanz. [Seite 53] Temazepam erhöht dosisabhängig die zentrale, stressorinduzierte Freisetzung von AVP im PVN: Nur bei den Konzentrationen von 1,0 mg/kg und 3,0 mg/kg zeigt der AVP-Anstieg eine statistische Signifikanz im Vergleich zu 0,5 mg/kg und Vehikel (Kontrasttests in ANOVA); Bei einer Dosierung 1,0 mg/kg ist bei Dialysat 5 p < 0,01 vs. Basalwerte (##) und bei Dialysat 5 p < 0,01 vs. Vehikel (**); sowie bei einer Dosierung von 3,0 mg/kg ist bei Dialysat 5 und 6 p < 0,01 vs. Basalwerte (##), bei Dialysat 5 p < 0,01 vs. Vehikel (**) und bei Dialysat 6 p < 0,05 vs. Vehikel (*). Bei einer Konzentration von 0,5 mg/kg kommt es im Vergleich zum Vehikel zu keiner signifikanten Änderung. [Seite 54] Weder nach der Gabe von Alprazolam noch nach dem „Forced swimming“ kommt es zu signifikanten Veränderungen der AVP-Konzentration. |
Großteils wörtliche Übernahme aus dem Ergebnisteil ohne Quellenangabe. Gleiche Zahlenwerte, lediglich ohne Leerzeichen in den Gleichungen. |
| [59.] Mek/Fragment 089 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 089, Zeilen: 01-08 |
Quelle: Schindele 2003 Seite(n): 052, Zeilen: 03-10 |
|---|---|

Abb. 17: Einfluss von Alprazolam i.v. (Pfeil) in den Dosierungen 0,5 mg/kg (n=6), 1,0 mg/kg (n=5), 3,0 mg/kg (n=9) Körpergewicht oder Vehikel (n=6) auf die AVP-Konzentration (in pg) in aufeinanderfolgenden 30-minütigen Dialysaten, die im PVN freibeweglicher Tiere vor (Dialysate 1 - 4), während (Dialysat 5: 5 Minuten Forced Swimming und 25 Minuten unmittelbar danach) und nach (Dialysate 6 - 8) 5 Minuten Forced Swimming (Balken) gesammelt wurden. Die Gabe von Alprazolam bzw. Vehikel erfolgte sofort nach dem Wechsel des zweiten Sammelröhrchens, Forced Swimming nach dem Wechsel des vierten Sammelröhrchens. *P<0,05, ** P<0,01 vs. andere Dosierungen; # P<0,05, ## P<0,01 vs. Basalwerte innerhalb derselben Gruppe. |

Abb. 3.3: Einfluss von Alprazolam i.v. (Pfeil) in den Dosierungen von 0,5 mg/kg (n = 6), 1,0 mg/kg (n = 5) oder 3,0 mg/kg (n = 9) Körpergewicht oder Vehikel (n = 6) auf die AVP-Konzentration (in pg) in aufeinanderfolgenden 30-minütigen Dialysaten, die im PVN freibeweglicher Tiere vor (Dialysate 1 - 4), während (Dialysat 5: 5 min „Forced swimming“ und 25 min unmittelbar danach) und nach (Dialysate 6 - 8) 5 Minuten „Forced swimming“ (Balken) gesammelt wurden. Die Gabe von Alprazolam bzw. Vehikel erfolgte sofort nach dem Wechsel des 2. Tube, „Forced swimming“ nach dem Wechsel des 4. Tube. * bedeutet Signifikanz bei p < 0,05, ** bedeutet Signifikanz bei p < 0,01 vs. andere Dosierungen; # bedeutet Signifikanz bei p < 0,05, ## bedeutet Signifikanz bei p < 0,01 vs. Basalwerte innerhalb derselben Gruppe. |
Identische Beschreibung einer Abbildung aus dem Ergebnisteil. |
| [60.] Mek/Fragment 090 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 090, Zeilen: 01-08 |
Quelle: Schindele 2003 Seite(n): 053, Zeilen: 03-12 |
|---|---|

Abb. 18: Einfluss von Temazepam i.v. (Pfeil) 0,5 mg/kg (n=8), 1,0 mg/kg (n=6), 3,0 mg/kg (n=12) Körpergewicht oder Vehikel (n=6) auf die AVP-Konzentration (in pg) in aufeinanderfolgenden 30-minütigen Dialysaten, die im PVN frei beweglicher Tiere vor (Dialysate 1 - 4), während (Dialysat 5: 5 Minuten Forced Swimming und 25 Minuten unmittelbar danach) und nach (Dialysate 6 - 8) 5 Minuten Forced Swimming (Balken) gesammelt wurden. Die Gabe von Temazepam bzw. Vehikel erfolgte sofort nach dem Wechsel des zweiten Sammelröhrchens, Forced Swimming nach dem Wechsel des vierten Sammelröhrchens. * P<0,05, ** P<0,01 vs. andere Dosierungen; # P<0,05, ## P<0,01 vs. Basalwerte innerhalb derselben Gruppe. |

Abb. 3.4: Einfluss von Temazepam i.v. (Pfeil) in den Dosierungen von 0,5 mg/kg (n = 8), 1,0 mg/kg (n = 6) oder 3,0 mg/kg (n = 12) Körpergewicht oder Vehikel (n = 6) auf die AVP- Konzentration (in pg) in aufeinanderfolgenden 30-minütigen Dialysaten, die im PVN freibeweglicher Tiere vor (Dialysate 1 - 4), während (Dialysat 5: 5 min „Forced swimming“ und 25 min unmittelbar danach) und nach (Dialysate 6 - 8) 5 Minuten „Forced swimming“ (Balken) gesammelt wurden. Die Gabe von Temazepam bzw. Vehikel erfolgte sofort nach dem Wechsel des 2. Tube, „Forced swimming“ nach dem Wechsel des 4. Tube. * bedeutet Signifikanz bei p < 0,05, ** bedeutet Signifikanz bei p < 0,01 vs. andere Dosierungen; # bedeutet Signifikanz bei p < 0,05, ## bedeutet Signifikanz bei p < 0,01 vs. Basalwerte innerhalb derselben Gruppe. |
Übernahme von Text und Daten aus dem Ergebnisteil ohne Quellennennung. |
| [61.] Mek/Fragment 091 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 091, Zeilen: 01-06 |
Quelle: Schindele 2003 Seite(n): 054-055, Zeilen: 054:06-11; 055: Abbildung 3.6 |
|---|---|
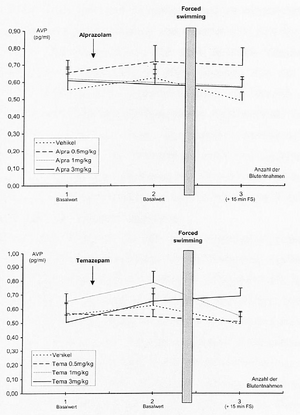
Abb. 19: Einfluss von Alprazolam (Alpra, oben) und Temazepam (Tema, unten) i.v. (Pfeil) 0,5 mg/kg (n=10), 1,0 mg/kg (n=14) oder 3,0 mg/kg (n=14) Körpergewicht oder Vehikel (n=15) auf die AVP Konzentration (in pg/ml) im peripheren Plasma: Basalwert 1: 45 Minuten nach Versuchsbeginn; Basalwert 2: 45 Minuten nach Gabe von Alprazolam/Temazepam bzw. Vehikel; Wert 3: 15 Minuten nach Forced Swimming (Balken). Die Gabe von Alprazolam/Temazepam bzw. Vehikel erfolgte 15 Minuten nach der ersten Blutentnahme (Basalwert 1). |
[Seite 054]
Abb. 3.5: Einfluss von Alprazolam i.v. (Pfeil) in den Dosierungen von 0,5 mg/kg (n = 9), 1,0 mg/kg (n = 14) oder 3,0 mg/kg (n = 14) Körpergewicht oder Vehikel (n = 9) auf die AVP- Konzentration (in pg/ml) im peripheren Plasma: Basalwert 1: 45 Minuten nach Versuchsbeginn; Basalwert 2: 45 Minuten nach Gabe von Alprazolam bzw. Vehikel; Wert 3: 15 Minuten nach dem „Forced swimming“ (Balken). Die Gabe von Alprazolam bzw. Vehikel erfolgte 15 Minuten nach der 1. Blutentnahme (Basalwert 1). [Seite 055] |
Diese Beschriftung fasst die Beschriftungen bei Schindele (Abb. 3.5 und Abb. 3.6 auf den Seiten 54 und Seite 55) zusammen - die beiden Abbildungen fusioniert der Autor zu einer, die jedoch die identischen Graphen enthält. Die beiden Beschriftungen sind nahezu identisch. Es gibt jedoch Abweichungen bei den Stichprobengrößen: 10, 14, 14 und 15 bei Mek gegenüber 9, 14, 14 und 9 bei Schindele, für jeweils identische eingetragene Werte bei der AVP-Konzentration.
|
| [62.] Mek/Fragment 092 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 092, Zeilen: 1 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 056-058, Zeilen: 056:01-17; 057:01-20; 058:01-09 |
|---|---|
| Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von ACTH im Plasma
Die Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von ACTH aus der Adenohypophyse in das Plasma ist in den Abbildungen 20 und 21 dargestellt. Beide Benzodiazepine rufen eine ähnliche Veränderung der ACTH-Konzentration hervor. Alprazolam: In allen Gruppen war der Schwimmstressor-induzierte ACTH-Anstieg zum Zeitpunkt 5 bzw. 15 Minuten nach dem Forced Swimming signifikant höher als die Basalwerte (Kontrasttests in ANOVA, P<0,01 ). Alprazolam führt jedoch zu einer signifikanten Hemmung des durch den Schwimmstressor bedingten ACTH-Anstiegs (post hoc Scheffe Test): Bei einer Dosierung von 1,0 mg/kg und 3,0 mg/kg war P < 0,01 vs. Vehikel zum Zeitpunkt 5 bzw. 15 Minuten nach Forced Swimming; bei 0,5 mg/kg war P < 0,05 vs. Vehikel zum Zeitpunkt 5 Minuten nach Forced Swimming. Temazepam: In allen Gruppen war der Schwimmstressor-induzierte ACTH-Anstieg zum Zeitpunkt 5 bzw. 15 Minuten nach Forced Swimming signifikant höher als die Basalwerte (Kontrasttests in ANOVA): Zeitpunkt 5 Minuten nach Forced Swimming in allen Dosierungen P < 0,01; Zeitpunkt 15 Minuten nach Forced Swimming bei Vehikel und einer Dosierung von 0,5 mg/kg P < 0,01; bei einer Dosierung von 1,0 mg/kg und 3,0 mg/kg P < 0,05. Temazepam hemmte den stressorinduzierten ACTH-Anstieg in signifikanter Weise (post hoc Scheffé Test). Bei einer Dosierung von 3,0 mg/kg war P < 0,01 vs. Vehikel und vs. 0,5 mg/kg zum Zeitpunkt 5 Minuten nach Forced Swimming, sowie P < 0,01 vs. Vehikel zum Zeitpunkt 15 Minuten nach Forced Swimming; bei einer Dosierung von 1,0 mg/kg war P < 0,01 vs. Vehikel zum Zeitpunkt 5 Minuten nach Forced Swimming und P < 0.05 vs. Vehikel zum Zeitpunkt 15 Minuten nach Forced Swimming; sowie bei einer Dosierung von 0,5 mg/kg war P < 0,01 vs. Vehikel zum Zeitpunkt 5 Minuten nach Forced Swimming. |
[Seite 056]
Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von ACTH im Plasma Die Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von ACTH aus der Adenohypophyse in das Blut ist in den beiden folgenden Abbildungen 3.7 und 3.8 dargestellt. Beide Benzodiazepine rufen eine ähnliche Veränderung der ACTH-Konzentration hervor. [...] In allen Gruppen war der Schwimmstressor-induzierte ACTH-Anstieg zum Zeitpunkt 5 bzw. 15 Minuten nach dem "Forced swimming" signifikant höher als die Basalwerte (Kontrasttests [Seite 57] in ANOVA, p < 0,01, ##). Alprazolam führt jedoch zu einer signifikanten Hemmung des durch den Schwimmstressor bedingten ACTH-Anstiegs (Post-hoc Scheffe' Test): Bei einer Dosierung von 1,0 mg/kg und 3,0 mg/kg ist p < 0,01 vs. Vehikel zum Zeitpunkt 5 bzw. 15 Minuten nach dem "Forced swimming" (4* vs. 1 ,3); bei 0,5 mg/kg ist p < 0,05 vs. Vehikel zum Zeitpunkt 5 Minuten nach dem "Forced swimming" (* vs. V eh.). [...] Abbildung 3.8. zeigt die Wirkung von Temazepam auf die ACTH-Konzentration im Plasma: [...] In allen Gruppen war der Schwimmstressor-induzierte ACTH-Anstieg zum Zeitpunkt 5 bzw. 15 Minuten nach dem "Forced swimming" signifikant höher als die Basalwerte (Kontrasttests in ANOVA): Zeitpunkt 5 Minuten nach dem "Forced swimming" in allen Dosierungen: p < 0,01 (##), Zeitpunkt 15 Minuten nach dem "Forced swimming" bei Vehikel und einer Dosierung von 0,5 mg/kg p < 0,01 (##),bei einer Dosierung von 1,0 mg/kg und 3,0 mg/kg p < 0,05 (#). Ähnlich wie Alprazolam hemmt auch Temazepam den stressorinduzierten ACTH- [Seite 58] Anstieg in signifikanter Weise (Post-hoc Scheffe' Test): Je höher die Dosierung von Temazepam, um so flacher ist der Verlauf der Kurve der ACTH-Konzentration. Bei einer Dosierung von 3,0 mg/kg ist p < 0,01 vs. Vehikel und vs. 0,5 mg/kg zum Zeitpunkt 5 Minuten nach dem "Forced swimming" (** vs. 0,5, Veh.), sowie p < 0,01 vs. Vehikel zum Zeitpunkt 15 Minuten nach dem "Forced swimming" (** vs. 3); bei einer Dosierung von 1,0 mg/kg ist p < 0,01 vs. Vehikel zum Zeitpunkt 5 Minuten nach dem "Forced swimming" (** vs. Veh.) und p < 0.05 vs. Vehikel zum Zeitpunkt 15 Minuten nach dem "Forced swimming" (* vs. 1); sowie bei einer Dosierung von 0,5 mg/kg ist p < 0,01 vs. 3,0 mg/kg zum Zeitpunkt 5 Minuten nach dem "Forced swimming" (** vs. 3). |
Die Quelle ist nicht angegeben. "Blut" wurde durch "Plasma" ersetzt. |
| [63.] Mek/Fragment 093 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 093, Zeilen: 01 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 056, 058-060, Zeilen: 056:08-14; 058:12-13; 059:09-15; 060:09-12 |
|---|---|

Abb. 20: Einfluss von Alprazolam i.v. (Pfeil) 0,5 mg/kg (n=11), 1,0 mg/kg (n=14), 3,0 mg/kg (n=16) oder Vehikel (Veh, n=11) auf die ACTH-Konzentration) im Blutplasma: Basalwerte 1 und 2: 45 bzw. 105 Minuten nach Versuchsbeginn, Basalwert 2: 45 Minuten nach Gabe von Alprazolam bzw. Vehikel; Werte 3, 4 und 5: 5, 15 und 50 Minuten nach Forced Swimming (FS, Balken). *P<0,05, **P<0,01 vs. andere Dosierungen; # P<0,05, ## P<0,01 vs. Basalwerte innerhalb derselben Gruppe. 4.2.6 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von Kortikosteron im Plasma Alprazolam: In allen Gruppen war der Schwimmstressor-induzierte Kortikosteron- Anstieg zum Zeitpunkt 5 bzw. 15 bzw. 50 Minuten nach dem „Forced Swimming“ signifikant höher als die Basalwerte (Kontrasttests in ANOVA, P<0,01). Die Gabe von Alprazolam in den verschiedenen Dosierungen veränderte den durch Forced Swimming hervorgerufenen Anstieg von Kortikosteron nicht signifikant. In allen Gruppen war der Schwimmstressor-induzierte Kortikosteron-Anstieg zum Zeitpunkt 5 bzw. 15 bzw. 50 Minuten nach Forced Swimming signifikant höher als die Basalwerte (Kontrasttests in ANOVA, P<0,01). Temazepam bewirkte ebenfalls keine signifikante Änderung des Kortikosteron-Verlaufes. |
[Seite 056]
Abb. 3.7: Einfluss von Alprazolam i.v. (Pfeil) in den Dosierungen von 0,5 mg/kg (n = 11), 1,0 mg/kg (n = 14) oder 3,0 mg/kg (n = 16) oder Vehikel (n = 11) auf die ACTH- Konzentration (in pg/ml) im Blutplasma: Basalwerte 1 und 2: 45 bzw. 105 Minuten nach Versuchsbeginn, Basalwert 2: 45 Minuten nach Gabe von Alprazolam bzw. Vehikel; Werte 3, 4 und 5: 5 bzw. 15 bzw. 50 Minuten nach dem „Forced swimming“ (Balken). * bedeutet Signifikanz bei p < 0,05, ** bedeutet Signifikanz bei p < 0,01 vs. andere Dosierungen; # bedeutet Signifikanz bei p < 0,05, ## bedeutet Signifikanz bei p < 0,01 vs. Basalwerte innerhalb derselben Gruppe. [Seite 058] 3.4 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von Corticosteron im Plasma [Seite 059] In allen Gruppen war der Schwimmstressor-induzierte Corticosteron-Anstieg zum Zeitpunkt 5 bzw. 15 bzw. 50 Minuten nach dem „Forced swimming“ signifikant höher als die Basalwerte (Kontrasttests in ANOVA, p < 0,01, ##). Die Gabe von Alprazolam in den verschiedenen Dosierungen verändert den durch das „Forced swimming“ hervorgerufenen Anstieg von Corticosteron (CORT) nicht in signifikanter Weise: In allen Dosierungen ist p < 0,01 vs. Basalwerte zum Zeitpunkt 5, 15 bzw. 50 Minuten nach dem „Forced swimming“ (Kontrasttests in ANOVA, p < 0,01, ##). [Seite 060] In allen Gruppen war der Schwimmstressor-induzierte Corticosteron-Anstieg zum Zeitpunkt 5 bzw. 15 bzw. 50 Minuten nach dem „Forced swimming“ signifikant höher als die Basalwerte (Kontrasttests in ANOVA, p < 0,01, ##). Temazepam bewirkt ebenfalls keine signifikante Änderung des CORT-Verlaufes: |
Die Abbildungen sind identisch, die Daten der Beschriftung ebenfalls. Kopie aus dem Ergebnisteil ohne Quellenangabe. Bevorzugt wird die deutsche Schreibweise, z.B. von "Kortikosteon" anstelle von "Corticosteron". |
| [64.] Mek/Fragment 094 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 094, Zeilen: 01 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 057, 062, Zeilen: 057:07-14; 062:01-12 |
|---|---|
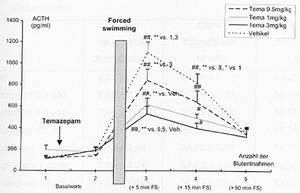
Abb. 21: Einfluss von Temazepam i.v. (Pfeil) 0,5 mg/kg (n=13), 1,0 mg/kg (n=14), 3,0 mg/kg (n=21) oder Vehikel (Veh, n=11) auf die ACTH-Konzentration (in pg/ml) im Blutplasma: Basalwerte 1 und 2: 45 bzw. 105 Minuten nach Versuchsbeginn, Basalwert 2: 45 Minuten nach Gabe von Temazepam bzw. Vehikel; Werte 3, 4 und 5: 5, 15 und 50 Minuten nach Forced Swimming (FS, Balken). *P<0,05, **P<0,01 vs. andere Dosierungen: # P<0,05, ## P<0,01 vs. Basalwerte innerhalb derselben Gruppe. 4.2.7 Wirkung von Alprazolam und Temazepam auf die ACTH-Sekretion in Rattenhypophysenzellkulturen Die höchste verwendete Benzodiazepin-Konzentration von 10 µM entsprach der im Idealfall nach Applikation von 3,0 mg/kg Körpergewicht der Ratte im Tier erreichten; 1,0 µM lagen etwas unterhalb von 0,5 mg/kg. Bei der Auswahl der Konzentrationen erfolgte eine Orientierung an Publikationen anderer Autoren (Kalogeras et al., 1990). Um unspezifische Effekte des Benzodiazepin-Lösungsmittels Propylenglycol (= 1,2-Propanediol) auszuschließen, wurden die Zellen mit der höchsten verwendeten Konzentration von 0,1 % im Medium stimuliert. Kalogeras, K.T., Calogero, A.E. , Kuribayashi, T. , Khan, I., Gallucci, W.T. , Kling, M.A., Chrousos, G.P. & Gold, P.W. (1990) In vitro andin vivo effects of the triazolobenzodiazepine alprazolam on hypothalamic- pituitary- adrenal function: pharmacological and clinical implications. Journal of Clinical Endocrinology and Metabolism, 20, 1462-1471. |
[Seite 057]
Abb. 3.8: Einfluss von Temazepam i.v. (Pfeil) in den Dosierungen von 0,5 mg/kg (n = 13), 1,0 mg/kg (n = 14) oder 3,0 mg/kg (n = 21) oder Vehikel (n = 11) auf die ACTH- Konzentration (in pg/ml) im Blutplasma: Basalwerte 1 und 2: 45 bzw. 105 Minuten nach Versuchsbeginn, Basalwert 2: 45 Minuten nach Gabe von Temazepam bzw. Vehikel; Werte 3, 4 und 5: 5 bzw. 15 bzw. 50 Minuten nach dem „Forced swimming“ (Balken). * bedeutet Signifikanz bei p < 0,05, ** bedeutet Signifikanz bei p < 0,01 vs. andere Dosierungen; # bedeutet Signifikanz bei p < 0,05, ## bedeutet Signifikanz bei p < 0,01 vs. Basalwerte innerhalb derselben Gruppe. [Seite 062] 3.5 Wirkung von Alprazolam und Temazepam auf die ACTH-Sekretion in Rattenhypophysenzellkulturen Nachfolgend sind die Ergebnisse der Wirkung von Alprazolam und Temazepam auf die ACTH-Sekretion in primären Rattenhypophysenzellkulturen dargestellt. Die höchste Benzodiazepin-Konzentration von 10 µM entspricht derjenigen, die im Idealfall nach Applikation von 3,0 mg/kg Körpergewicht der Ratte im Tier erreicht wurde; 1,0 µM liegt etwas unterhalb von 0,5 mg/kg. Bei der Auswahl der Konzentrationen erfolgte eine Orientierung an Publikationen anderer Autoren (Kunert-Radek et al., 1994; Kalogeras et al., 1990). Um unspezifische Effekte des Benzodiazepin-Lösungsmittels Propylenglycol (= 1,2- Propanediol) auszuschließen, wurden die Zellen mit der höchsten auftretenden Konzentration von 0,1 % im Medium stimuliert. Kunert-Radek J, Stepien H und Pawlikowski M (1994) Inhibition of rat pituitary tumor cell proliferation by benzodiazepines in vitro, in: Neuroendocrinology 59: 92-96. Kalogeras K T, Calogero A E, Kuribayiashi T, Khan I, Gallucci W T, Kling M A, Chrousos G P und Gold P W (1990) In vitro andin vivo effects of the triazolobenzodtazepme alprilzolam on hypothalarnic-pimitary-adrenal function. Pharmacological and clinical implications, in: Journal of Clinical Endocrinology and Metabolism 70: 1462-1471. |
Identische Abbildung und Daten. Keine Nennung der Quelle. |
| [65.] Mek/Fragment 095 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 095, Zeilen: 01 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 062-063, Zeilen: 062:Tab. 3.1; 063:01-06 |
|---|---|

Die Varianzanalyse ergab keine signifikanten Veränderungen zwischen Basalwerten und nach Behandlung mit Alprazolam oder Temazepam, d.h, in der Rattenhypophysenzellkultur beeinflussen die beiden Benzodiazepine die basale und durch CRH oder AVP stimulierte ACTH-Sekretion nicht. Die Behandlung der Hypophysenzellen mit der höchsten Propylenglycol-Konzentration hatte während der Stimulationszeit von drei Stunden keinen Effekt auf die basale oder stimulierte Sekretion von ACTH. |
[Seite 062]
[Seite 063] Die Varianzanalyse ergab keine signifikanten Veränderungen zwischen den jeweiligen Basiswerten und den entsprechenden nach Behandlung mit Alprazolam oder Temazepam, d.h. in der Rattenhypophysenzellkultur beeinflussen die beiden Benzodiazepine die basale und durch CRH oder AVP stimulierte ACTH-Sekretion nicht. Die Behandlung der Hypophysenzellen mit der höchsten Propylenglycol-Konzentration hatte während der Stimulationszeit von drei Stunden keinen Effekt auf die basale oder stimulierte Sekretion von ACTH. |
Aus dem Ergebnisteil. Keine Quellenangabe. |
| [66.] Mek/Fragment 096 04 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 096, Zeilen: 04-10, 13-26, 28-29 |
Quelle: Schindele 2003 Seite(n): 065, 066, 076, Zeilen: 065: 02-09, 16-22; 066: 01-02; 076: 05-12 |
|---|---|
| In der vorliegenden Studie wurden die Auswirkungen des Triazolobenzodiazepins Alprazolam, dem klinisch von einigen Autoren eine antidepressive Wirkung zugeschrieben wurde (Dawson et al., 1984; O'Connor et al., 1985; Birkenhäger et al., 1995), und des Benzodiazepins Temazepam auf die Regulation der HPA-Achse untersucht. Insbesondere wurde die Wirkung der beiden anxiolytischen Medikamente auf die Freisetzungsprofile von AVP im PVN und von AVP, ACTH und Kortikosteron im Plasma unter dem Stressor des Forced Swimming charakterisiert.
[4.2.8.1 Unterschiedliche Effekte von Triazolobenzodiazepinen und Benzodiazepinen?] Ausgangspunkt dieser Überlegung ist die von einigen Autoren beschriebene unterschiedliche klinische Wirksamkeit der beiden Benzodiazepine: Alprazolam soll neben anxiolytischen antidepressive Effekte aufweisen und wird deshalb auch im Rahmen der pharmakologischen Therapie der Depression eingesetzt (Dawson et al., 1984; Birkenhäger et al., 1995). Temazepam dagegen besitzt keine bekannte antidepressive Wirkung und wird dementsprechend als "klassisches" Benzodiazepin, das in der Psychiatrie bevorzugt bei Angsterkrankungen sowie Erregungs- und Spannungszuständen verwendet wird, eingesetzt. Das Forced Swimming als kombiniert emotional/physischer Stressor (Porsolt et al., 1978; Cryan et al., 2002) ist einerseits geeignet, Veränderungen der HPA-Achse unter der Gabe der beiden Benzodiazepine im Sinne von Konzentrationsveränderungen von AVP, ACTH und Kortikosteron im Plasma hervorzurufen. Andererseits dient es mit einigen Modifikationen als Verhaltenstest zur Untersuchung der klinischen Wirksamkeit antidepressiver Substanzen, [wenngleich es ursprünglich für trizyklische Antidepressiva entwickelt und validiert wurde (Cryan et al., 2002).] Temazepam, von dem klinisch kein antidepressiver Effekt beschrieben wurde, zeigte in der vorliegenden Studie, wie bereits von anderen Autoren berichtet (Flugy et al., [1992), keinen gegenüber der Vehikel-Gabe signifikanten Einfluss auf das Schwimmverhalten der Tiere.] Dawson, G .W., Jue, S.G. & Brogden, R.N. (1984) Alprazolam: a review of its pharmacodynamic properties and efficacy in the treatment of anxiety and depression. Drugs, 27, 132-147. O·Connor, W.T., Earley, B. & Leonard, B.E. (1985) Antidepressant properties of the triazolobenzodiazepines alprazolam and adinazolam: studies on the olfactory bulbectomized rat model of depression. British Journal of Clinical Pharmacology, 19, 45-56. Birkenhäger, T.K., Moleman, P. & Nolen, W.A. (1995) Benzodiazepines for depression? A review of the literature. International Clinical Psychopharmacology, 10, 181-195. Porsolt, R.D., Anton, G., Blavet, N. & Jalfre, M. (1978) Behavioural dispair in rats: a new model sensitive to antidepressant treatments. European Journal of Pharmacology, 47, 379-391. [Cryan, J.F., Markou, A. & Lucki , I. (2002) Assessing antidepressant activity in rodents: recent developments and future needs. Trends in pharmacological sciences, 23, 238-245.] Flugy, A. , Gagliano, M., Cannizzaro, C., Novara, V. & Cannizzaro, G . (1992) Antidepressant and anxiolytic effects of alprazolam versus the conventional antidepressant deaipramine and the anxiolytic diazepam in the forced swim test. European Journal of Pharmacology, 214, 233-238. |
[Seite 065]
Die vorliegende Dissertation untersuchte den Einfluss des Triazolobenzodiazepins Alprazolam, dem klinisch von einigen Autoren eine antidepressive Wirkung zugeschrieben wurde (Birkenhäger et al., 1995; Dawson et al., 1984; O'Connor et al., 1985; Von Voigtlander & Straw, 1985), und des Benzodiazepins Temazepam auf die Regulation der Hypothalamus-Hypophysen-Nebennierenrinden-Achse (HPA-Achse). Insbesondere wollte sie Aufschluss über die Wirkung der beiden anxiolytischen Medikamente auf die Freisetzungsprofile von AVP im PVN und von AVP, ACTH und Corticosteron im Plasma unter dem Verhaltensstressor des "Forced swimming" geben. [Seite 076] Ausgangspunkt dieser Überlegungen ist die von einigen Autoren beschriebene unterschiedliche klinische Wirksamkeit der beiden Benzodiazepine: Alprazolam soll neben anxiolytischen Effekten auch antidepressiv wirken und wird deshalb ebenfalls im Rahmen der pharmakologischen Therapie von Depressionen eingesetzt (Birkenhäger et al., 1995; Dawson et al., 1984; O'Connor et al., 1985; Von Voigtlander & Straw, 1985). Temazepam dagegen besitzt keine bekannten antidepressiven Effekte und verfügt über eine Indikation als klassisches Benzodiazepin, das bevorzugt bei Angststörungen, sowie Erregungs- und Spannungszuständen verwendet wird. [Seite 065] Das „Forced swimming“ als kombiniert emotional/physischer Stressor (Abel, 1994; West, 1990; Wotjak, 1995) ist einerseits besonders geeignet deutlichere Veränderungen der HPA-Stressachse unter der Gabe der beiden Benzodiazepine im Sinne von Konzentrationsveränderungen von AVP, ACTH und Corticosteron hervorzurufen. Andererseits dient es mit einigen Modifikationen als Tiermodell zur Untersuchung der klinischen Wirksamkeit antidepressiver Substanzen (Borsini & Meli, 1988; Keck et al., 2001b; Lucki, 1997; Porsolt et al., 1977; West, 1990). [Seite 066] Temazepam, vom dem klinisch kein antidepressiver Effekt beschrieben wurde, zeigte in der vorliegenden Studie wie bereits von anderen Autoren berichtet (Flugy et al., 1992) keinen gegenüber der Vehikel-Gabe signifikanten Einfluss auf das Schwimmverhalten der Tiere. Birkenhäger T K, Moleman P und Nolen W A (1995) Benzodiazepines for depression? A review of the literature, in: International Clinical Psychopharmacology 10: 181-195. Dawson G W, Jue S G und Brogden RN (1984) Alprazolam. A review of its pharmacodynamic properties and efficacy in the treatment of anxiety and depression, in: Drugs 27: 132-147. O'Connor W T, Earley B und Leonard B E (1985) Antidepressant properties of the triazolobenzodiazepines alprazolam and adinazolam. Studies on the olfactory bulbectomized rat model of depression, in: British Journal of Clinical Pharmacology 19: 45-56. Von Voigtlander P F und Straw R N (1985) Alprazolam. Review of pharmacological, pharmacokinetic, and clinical data, in: Drug Development Research 6:1-12. Abel E L (1994) A further analysis of physiological changes in rats in the forced swim test, in: Physiology & Behavior 56: 795-800. West A P (1990) Neurobehavioral studies of forced swimming. The rofe of learning and memory in the forced swim test, in: Progress in Neuro-Psychopharmacology & Biological Psychiatry 14: 863-877. Wotjak C T (1995) Untersuchungen zur Vasopressin-Freisetzung in ausgewählten Kerngebieten des Rattengehirns unter besonderer Berücksichtigung des parvozellulären vasopressinergen Systems (unveröffentlichte Dissertation), München. Borsini F und Meli A (1988) Is the forced swimmning test a suitable model for revealing antidepressant activity?, in: Psychopharmacology 94: 147-160. Keck M E, Welt T, Post A, Müller M B, Toschi N, Wigger A Landgraf R, Holsboer F und Engelmann M (2001b) Neuroendocrine and behavioral effects of repetitive transcranial magnetic stimulation in a psychopathological animal model are suggestive of antidepressant-like effects, in: Neuropsychopharmacology 24: 337-349. Lucki I (1997) The forced swimming test as a model for core and component behavioral effects of antidepressant drugs, in: Behavioural Pharmacology 8. 523-532. Porsolt R D, Le Pichon M und Jalfre M (1977) Depression. A new animal model sensitive to antidepressant treatments, in: Nature 266: 730-732. Flugy A, Gagliano M, Cannizzaro C, Novara V und Cannizzaro G (1992) Antidepressant and anxiolytic effects of alprazolam versus the conventional antidepressant desipramine and the anxiolytic diazepam in the forced swim test in rats, in: European Journal of Pharmacology 214: 233-238. |
Die einzige inhaltliche Eigenleistung ist die Ergänzung eines Halbsatzes (am Ende des vorletzten Absatzes), der daher – wie auch die nicht übernommene Zwischenüberschrift – nicht mit in die Zeilenzählung eingeht. Der Autor verwendet die Schreibweise "Kortikosteron" anstelle von "Corticosteron" – deutsche versus englische Schreibweise. |
| [67.] Mek/Fragment 097 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 097, Zeilen: 01-16, 19-29 |
Quelle: Schindele 2003 Seite(n): 066-069, 076, Zeilen: 066: 01-08; 067: 03-09; 068: 05-08; 069: 04-08; 076: 16-20, 26-28 |
|---|---|
| [Temazepam, von dem klinisch kein antidepressiver Effekt beschrieben wurde, zeigte in der vorliegenden Studie, wie bereits von anderen Autoren berichtet (Flugy et al.,] 1992), keinen gegenüber der Vehikel-Gabe signifikanten Einfluss auf das Schwimmverhalten der Tiere. Das als antidepressiv wirksam beschriebene Alprazolam veränderte ebenfalls das Schwimmverhalten der Tiere nicht signifikant im Vergleich zur Vehikelbedingung. So konnte bei beiden Substanzen die von Porsolt erstmalig beschriebene Wirkung der klinisch effektiven Antidepressiva, nämlich die Abnahme des passiven Bewältigungsverhaltens des Floating (Porsolt et al., 1978), nicht beobachtet werden.
Der einzige Unterschied in der Wirkung der beiden Benzodiazepine auf die Freisetzungsprofile von AVP, ACTH und Kortikosteron war in der Intra-PVN-Freisetzung von AVP zu finden: Alprazolam erhöhte die AVP-Freisetzung in allen drei getesteten Konzentrationen, während Temazepam denselben Effekt dosisabhängig erst in einer Konzentration von 1,0 mg/kg zeigte. Zusammenfassend lässt sich somit feststellen, dass sich der von einigen Autoren beschriebene Unterschied in der klinischen Wirksamkeit nicht mit den im Tiermodell festgestellten Veränderungen der HPA-Achsenregulation oder den hier beobachteten Verhaltenseffekten erklären lässt. [4.2.8.2 Beeinflussung der intrahypothalamischen Freisetzungsmuster von AVP durch Benzodiazepine] In der vorliegenden Studie wurde erstmalig die Wirkung zweier Benzodiazepine auf die mittels Mikrodialysetechnik gemessene Freisetzung von AVP aus den magnozellulären Neuronen des PVN untersucht. In der aktuell verfügbaren Literatur über Alprazolam und Temazepam wurden ACTH und Kortikosteron lediglich im Plasma gemessen und entsprechend auf die Synthese und Sekretion von CRH und AVP in den Neuronen des PVN nur indirekt zurückgeschlossen (Kalogeras et al., 1990; Torpy et al., 1994; Korbonits et al., 1995; Arvat et al., 1999). Alprazolam erhöhte signifikant in allen drei getesteten Konzentrationen die stressorinduzierte Intra-PVN-Freisetzung von AVP, welches vermutlich hauptsächlich aus den Dendriten und Somata magnozellulärer Neurone stammt (Pow & Morris, 1989; Wotjak et al., 2001; Ludwig et al., 2002; Wotjak et al., 2002). Flugy, A. , Gagliano, M., Cannizzaro, C., Novara, V. & Cannizzaro, G . (1992) Antidepressant and anxiolytic effects of alprazolam versus the conventional antidepressant deaipramine and the anxiolytic diazepam in the forced swim test. European Journal of Pharmacology, 214, 233-238. Porsolt, R.D., Anton, G., Blavet, N. & Jalfre, M. (1978) Behavioural dispair in rats: a new model sensitive to antidepressant treatments. European Journal of Pharmacology, 47, 379-391. Kalogeras, K.T., Calogero, A.E., Kuribayashi, T., Khan, I., Gallucci, W.T., Kling, M.A., Chrousos, G.P. & Gold, P.W. (1990) In vitro and in vivo effects of the triazolobenzodiazepine alprazolam on hypothalamic- pituitary- adrenal function: pharmacological and clinical implications. Journal of Clinical Endocrinology and Metabolism, 20, 1462-1471. Torpy, D.J., Grice, J.E., Hockings, G.I., Walters, M.M., Crosbie, G.V. & Jackson, R.V. (1994) Alprazolam attenuates vasopressin- stimulated adrenocorticotropin and cortisol release: Evidence for synergy between vasopressin and CRH in humans. Journal of Clinical Endocrinology and Metabolism, 79, 140-144. Korbonits, M., Trainer, P.J., Edwards, R., Besser, G.M. & Grossman, AB. (1995) Benzodiazepines attenuate the pituitary- adrenal responses to CRH in healthy volunteers, but not in patients with Cushing's syndrome. Clinical Endocrinology, 43, 29-35. Arvat, E., Maccagno, B. , Ramunni, J., Di Vito, L. , Giordano, R., Gianotti, L., Broglio, F., Camanni, F. & Ghigo, E. (1999) The inhibitory effect of alprazolam, a benzodiazepine, overrides the stimulatory effect of metapyrone- induced lack of negative cortisol feedback on corticotroph secretion in humans. Journal of Clinical Endocrinology and Metabolism, 84, 2611-2615. Pow, D.V. & Morris, J.F. (1989) Dendrites of hypothalamic magnocellular neurons release neurohypophysial peptides by exocytosis. Neuroscience, 32, 435-439. Wotjak, C.T., Naruo, T., Muraoka, S., Simchen, R., Landgraf, R. & Engelmann, M. (2001) Forced swimming stimulates the expression of vasopressin and oxytocin in magnocellular neurons of the rat hypothalamic paraventricular nucleus. European Journal of Neuroscience, 13, 2273-2281. Ludwig, M., Sabatier, N., Bull, P.M., Landgraf, R., Dayanithi, G. & Leng, G. (2002) Intracellular calcium stores regulate activity-dependent neuropeptide release from dendrites. Nature, 418, 85-89. Wotjak, C.T., Ludwig, M., Ebner, K., Russell, J.A., Singewald, N., Landgraf, R. & Engelmann, M. (2002) Vasopressin from hypothalamic magnocellular neurons has opposite actions at the adenohypophysis and in the supraoptic nucleus on ACTH secretion. European Journal of Neuroscience, 16, 477-485. |
[Seite 066]
Temazepam, von dem klinisch kein antidepressiver Effekt beschrieben wurde, zeigte in der vorliegenden Studie wie bereits von anderen Autoren berichtet (Flugy et al., 1992) keinen gegenüber der Vehikel-Gabe signifikanten Einfluss auf das Schwimmverhalten der Tiere. Das als antidepressiv wirksam beschriebene Alprazolam veränderte ebenfalls das Schwimmverhalten der Tiere nicht signifikant im Vergleich zur Vehikelbedingung. So konnte die von Porsolt erstmalig beschriebene Wirkung der klinisch effektiven Antidepressiva, nämlich die Abnahme des passiven Bewältigungsverhaltens des "Floating" (Borsini & Meli, 1988; Porsolt et al., 1977) nicht beobachtet werden. [Seite 076] Der einzige Unterschied in der Wirkung der beiden Benzodiazepine auf die Freisetzungsprofile von AVP, ACTH und CORT war in der Intra-PVN-Freisetzung von AVP zu finden: Alprazolam erhöhte die AVP-Freisetzung in allen drei getesten Medikamenten-konzentrationen, während Temazepam den selben Effekt dosisabhängig erst in einer Konzentration von 1,0 mg/kg zeigte. [...] Zusammenfassend läßt sich sagen, dass sich der von einigen Autoren beschriebene Unterschied in der Klinik nicht mit den festgestellten Veränderungen der HPA-Achse oder den beobachteten Verhaltenseffekten erklären lässt. [Seite 067] In der vorliegenden Doktorarbeit wurde erstmalig die Wirkung zweier Benzodiazepine auf die mittels Mikrodialysetechnik gemessene Freisetzung von AVP aus den magnozellulären Neuronen (Wotjak et al., 2001) des Nucleus paraventricularis des Hypothalamus (PVN) untersucht: Alprazolam erhöhte signifikant in allen drei getesteten Konzentrationen (0,5/1,0/3,0 mg/kg) die intranukleäre Freisetzung von AVP im PVN (Abb. 3.3) nach einem 5-minütigen „Forced swimming“ in 23 °C warmen Wasser. [Seite 068] Alprazolam erhöht die stressorinduzierte Intra-PVN-Freisetzung von AVP, welches vermutlich hauptsächlich aus den Dendriten und dem Soma magnozellulärer Neurone stammt (Wotjak et al., 2001 und 2002), in allen getesteten Konzentrationen; [Seite 069] In der verfügbaren Literatur über Alprazolam und Temazepam (Arvat et al., 1999; Kalogeras et al., 1990; Korbonits et al., 1995; Torpy et al., 1994; siehe Kap. 1.6) wird ACTH und CORT im Plasma gemessen und auf die Ausschüttung von CRH und AVP in den parvozellulären Neuronen des PVN lediglich zurückgeschlossen. Flugy A, Gagliano M, Cannizzaro C, Novara V und Cannizzaro G (1992) Antidepressant and anxiolytic effects of alprazolam versus the conventional antidepressant desipramine and the anxiolytic diazepam in the forced swim test in rats, in: European Journal of Pharmacology 214: 233-238. Borsini F und Meli A (1988) Is the forced swimming test a suitable model for revealing antidepressant activity?, in: Psychopharmacology 94: 147-160. Porsolt R D, Le Pichon M und Jalfre M (1977) Depression. A new animal model sensitive to antidepressant treatments, in: Nature 266: 730-732. Wotjak C T, Naruo T, Muraoka S, Sirneben R., LandgrafRund Engelmann M (2001) Forced swimming stimulates the expression of vasopressin and oxytocin in magnocellular neurons of the rat hypothalamic paraventricular nucleus., in: European Journal of Neuroscience 13: 2273-2281. Wotjak C T, Ludwig M, Ebner K, Russen J A, Singewald N, Landgraf R und Engelmann M (2002) Vasopressin from hypothalamic magnocellular neurons has opposite actions at the adenohypophysis and in the supraoptic nucleus on ACTH secretion, in: European Journal of Neuroscience 16:477-485. Arvat E, Maccagno B, Ramunni J, Di Vito L, Giordano R, Gimnotti L, Broglio F, Camanni F und Ghigo E (1999) The inhibitory effect of alprazolam, a benzodiazepine, overrides the stimulatory effect of metyrapone-induced lack of negative cortisol feedback on corticotroph secretion in humans, in: Journal of Clinical Endocrinology & Metabolism 84: 2611-2615. Kalogeras K T, Calogero A E, Kuribayiashi T, Khan I, Gallucci W T, Kling M A, Chrousos G P und Gold P W (1990) In vitro andin vivo effects of the triazolobenzodtazepme alpralzolam on hypothalamic-pituitary-adrenal function. Pharmacological and clinical implications, in: Journal of Clinical Endocrinology and Metabolism 70: 1462-1471. Korbonits M, Trainer P J, Edwards R, Besser G M und Grossman AB (1995) Benzodiazepines attenuate the pituitary-adrenal responses to corticotrophin-releasing hormone in healthy volunteers, but not in patients with Cushing's syndrome, in:Clinical Endocrinology 43: 29-35. Torpy D J, Grice J E, Hockings G I, Walters M M, Crosbie G V und Jackson R V (1994) Alprazolam attenuates vasopressin-stimulated adrenocorticotropin and cortisol release. Evidence for synergy between vasopressin and corticotropin-releasing hormone in humans, in: Journal of Clinical Endocrinology and Metabolism 79: 140-144. |
Kopie von Text aus der Diskussion – ohne Quellenangabe. Der Autor gibt Inhalte aus Porsolt et al. (1978) mit identischen Worten wieder, wie sie die Quelle bzgl. Borsini & Meli (1988) und Porsolt et al. (1977) verwendet. Dass „erstmalig die Wirkung zweier Benzodiazepine auf die mittels Mikrodialysetechnik gemessene Freisetzung von AVP aus den magnozellulären Neuronen des PVN untersucht“ worden sei, reklamieren sowohl der Verfasser der untersuchten Habilitationsschrift wie auch Schindele (2003) in seiner Dissertation jeweils für sich. |
| [68.] Mek/Fragment 098 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 098, Zeilen: 01 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 067-069, Zeilen: 067:09-18; 068:01-04; 069:09-12, 15-22 |
|---|---|
| [Temazepam] hingegen steigerte die stressorinduzierte Intra-PVN-Freisetzung von AVP dosisabhängig: In Konzentrationen von 1,0 mg/kg und 3,0 mg/kg zeigte der AVP-Anstieg statistische Signifikanz; bei einer Konzentration von 0,5 mg/kg kam es im Vergleich zu Vehikel zu keiner signifikanten Änderung.
Im Gegensatz zu anderen Studien aus unserem Labor (Wotjak et al., 1998) erreichte die Erhöhung der AVP-Konzentration unter Vehikelbedingungen keine statistische Signifikanz. Allerdings war das Schwimmverhalten der Tiere in der vorliegenden Untersuchung auf Grund abweichender Versuchsbedingungen wie Schwimmdauer und Wassertemperatur unterschiedlich, wodurch die differierende intrahypothalamische AVP-Ausschüttung plausibel erklärbar wird. Benzodiazepine fördern und verstärken über den GABAA-Rezeptor die inhibitorische Wirkung von GABA. Über den Effekt von GABA, GABA-Agonisten oder -Antagonisten auf die Intra-PVN-Freisetzung von AVP aus magnozellulären Neuronen gibt es jedoch keine verfügbaren Studien. Allerdings sind GABAA-Rezeptoren auf den magnozellulären Neuronen nachgewiesen (Magnusson & Meyerson, 1993; Fenelon et al., 1995). Paradox wirkt zunächst, dass die untersuchten Benzodiazepine über den inhibitorisch wirkenden GABAA-Rezeptor auf magnozellulären Neuronen eine Steigerung der Freisetzung von AVP bewirken. Es liegt jedoch nahe zu vermuten, dass der beobachtete Effekt über inhibitorische, perinukleäre gabaerge Interneurone vermittelt wird. Über einen GABAA-Autorezeptor mit Benzodiazepin-Bindungsstelle wird das hemmende gabaerge Interneuron gehemmt, d.h. letztlich wird das magnozelluläre AVP-Neuron des PVN enthemmt. Wotjak, C.T., Ganster, J., Kohl, G., Holsboer, F., Landgraf, R. & Engelmann, M. (1998) Dissociated central and peripheral release of vasopressin, but not oxytocin, in response to repeated swim stress: new insights into the secretory capacities of peptidergic neurons. Neuroscience, 85, 1209- 1222. Magnusson, A.M. & Meyerson, B.J. (1993) GABAa antagonist muscimol inhibits stimulated vasopressin release in the posterior pituitary of Sprague- Dawley, Wistar, Wistar- Kyoto and spontaneously hypertensive rats. Neuroendocrinology, 58, 519-524. Fenelon, V.S., Sieghart, W. & Herbison, A.E. (1995) Cellular localization and differential distribution of GABAa receptor subunit proteins and messenger RNAs within hypothalamic magnocellular neurons. Neuroscience, 64, 1129-1143. |
[Seite 067]
Temazepam steigerte die stressorinduzierte Intra-PVN-Freisetzung von AVP dosisabhängig (Abb. 3.4): Bei den Konzentrationen von 1,0 mg/kg und 3,0 mg/kg zeigte der AVP-Anstieg statistische Signifikanz; bei einer Konzentration von 0,5 mg/kg kam es im Vergleich zu Vehikel zu keiner signifikanten Änderung. Im Gegensatz zu anderen Studien (Wotjak et al., 1996b und 1998) aus dem Max-Planck-Institut für Psychiatrie erreichte die Erhöhung der AVP-Konzentration unter Vehikelbedingungen (vgl. Abbildungen 3.3 und 3.4) keine statistische Signifikanz. Allerdings war das Schwimmverhalten der Tiere in der vorliegenden Dissertation auf Grund anderer Versuchsbedingungen wie Schwimmdauer und Wassertemperatur signifikant unterschiedlich, wie aus der nachstehenden Abbildung 4.1 hervorgeht. [Seite 068] Auf Grund des signifikant unterschiedlichen Schwimmverhaltens der Tiere (insbesondere „Struggling“) in der vorliegenden Studie (5 min, 23 °C) und in der Studie von Wotjak et al. (10 min, 20 °C) (Wotjak et al., 1998) ist die differierende intrahypothalamische AVP- Ausschüttung plausibel zu erklären. [Seite 069] Benzodiazepine wirken über den GABAA-Rezeptor: Sie fördern und verstärken die inhibitorische Wirkung von GABA. Über den Effekt von GABA, GABA-Agonisten oder GABA-Antagonisten auf die Intra-PVN-Freisetzung von AVP aus magnozellulären Neuronen gibt es ebenfalls keine verfügbaren Studien. [...] Allerdings sind GABAA-Rezeptoren auf den magnozellulären Neuronen nachgewiesen (Fenelon et al., 1995a; Magnusson & Meyerson, 1993). Die beiden Benzodiazepine Alprazolam und Temazepam bewirken über einen inhibitorisch wirkenden GABAA-Rezeptor auf dem magnozellulären AVP-Neuron eine Steigerung der Freisetzung von AVP. Dafür bietet sich folgende Erklärung an: Der beobachtete Effekt ist über inhibitorische perinukleäre GABAerge-Interneurone vermittelt. Über einen GABAA-Autorezeptor mit Benzodiazepin-Bindungsstelle wird das hemmende GABAerge-Interneuron gehemmt, d. h. letztlich wird das magnozelluläre AVP-Neuron des PVN enthemmt. Wotjak C T, Kubota M, Liebsch G, Montkowski A, Holsboer F, Neumann I und Landgraf R (1996b) Release ofvasopressin within the rat paraventriicular nucleus in response to emotional stress. A novel mechanism of regulating adre:nocorticotropic hormone secretion?, in: Journal of Neuroscience 16: 7725-7732. Wotjak C T, Ganster J, Kohl G, Holsboer F, Landgraf R und Engelmann M (1998) Dissociated central and peripheral release of vasopressin, but not oxytocin, in response to repeated swim stress. New insights into the secretory capacities of peptidergic neurons, in: Neuroscience 85: 1209-1222. Magnusson A M und Meyerson B J (1993) GABA-A agonist muscimol Inhibits stimulated vasopressin release in the posterior pituitary of sprague-dawley, wistar, wistar-Kyoto and spontaneously hypertensive rats, in: Neuroendocrinology 58. 519-524. Fenelon V S, Sieghart W und Herbison A E (1995a) Cellular localization and differential distribution of GABAA receptor subunit proteins and messenger RNAs within hypothalamic magnocellular neurons, in: Neuroscience 64: 1129-1143. |
Kein Hinweis auf die Quelle. |
| [69.] Mek/Fragment 099 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 099, Zeilen: 01 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 070-071, Zeilen: 070:01 ff.; 071:01-11 |
|---|---|
| 4.2.8.2.1 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von AVP im Plasma
In der vorliegenden Studie konnten sowohl vor und nach Forced Swimming wie auch nach Gabe der beiden Benzodiazepine keinerlei signifikante Veränderungen der peripheren AVP-Konzentration festgestellt werden, was die Befunde früherer Untersuchungen bestätigt (Wotjak et al., 1998; Keck et al., 2000b). Das im peripheren Plasma detektierbare AVP stammt, wie das zentral intra-PVN freigesetzte AVP, aus den magnozellulären Neuronen des PVN und SON und bildet einen Teil des HNS (Hatton & Li, 1998). In anderen Studien konnte eine Hemmung der neurohypophysären Ausschüttung von AVP aus den magnozellulären Axonterminalen durch GABA (Tierstudien: Wible et al., 1985a; b; Magnusson & Meyerson, 1993; Humanstudien: Chiodera et al., 1989) und den GABA-Agonisten Muscimol (Tierstudien: Wible et al., 1985b; Magnusson & Meyerson, 1993) bzw. eine Förderung der Ausschüttung durch den GABA-Antagonisten Bicucullin (Tierstudien: Wible et al., 1985a; b) erzielt werden. Obwohl die Benzodiazepine am GABAA-Rezeptor die Affinität für GABA erhöhen und deshalb als Agonisten die Ausschüttung von AVP aus der Neurohypophyse hemmen sollten, sind in der vorliegenden Studie die peripheren Konzentrationen von AVP unverändert. Allerdings verändert sich die Konzentration von AVP im Plasma auch in Humanstudien durch die Gabe von Alprazolam nicht (i.v.: Risby et al., 1989; oral: Torpy et al., 1994). Wible et al. berichteten jedoch über eine Hemmung der Freisetzung von AVP aus der Neurohypophyse nach Verabreichung von Chlordiazepoxid (Wible et al., 1985b). Es ist daher von einer modulatorischen Wirkung der Benzodiazepine an ihrer Bindungsstelle am GABAA-Rezeptor auszugehen. Zusammengefasst zeigt die Veränderung der AVP-Freisetzung nach der Gabe von Benzodiazepinen zentral und peripher einen unterschiedlichen Verlauf: Im PVN kommt es zu einem Anstieg von AVP im extrazellulären Raum, im peripheren Blut findet keine signifikante Veränderung der AVP-Konzentration statt. Diese differentielle Freisetzung von AVP aus magnozellulären Neuronen ist von anderen [Autoren bereits beschrieben worden (Wotjak et al., 1998):] Wotjak, C.T., Ganster, J., Kohl, G., Holsboer, F., Landgraf, R. & Engelmann, M. (1998) Dissodated central and peripheral release of vasopressin, but not oxytocin, in response to repeated swim stress: new insights into the secretory capacities of peptidergic neurons. Neuroscience, 85, 1209- 1222. Keck, M.E., Hatzinger, M., Wotjak, C., Landgraf, R., Holsboer, F. & Neumann, I.D. (2000b) Ageing alters intrahypothalamic release patterns of Vasopressin and oxytocin in rats. European Journal of Neuroscience, 12, 1487-1494. Hatton, G.I. & Li, Z.H. (1998) Neurophysiology of magnocellular neuroendocrine cells: recent advances. [Review] [130 refs]. Progress in Brain Research, 119, 77-99. Wible, J.H., Zerbe, R.L. & Dimicco, J.A. (1985a) Stimulation of vasopressin release by GABA antagonists in spinal cord transected rats. The Journal of Pharmacology and Experimental Therapeutics, 234, 378-385. Magnusson, AM . & Meyerson, B.J. (1993) GABAa antagonist muscimol inhibits stimulated vasopressin release in the posterior pituitary of Sprague- Dawley, Wistar, Wistar- Kyoto and spontaneously hypertensive rats. Neuroendocrinology, 58, 519-524. Chiodera, P., Gnudi, A., Volpi, R., Marchesi, C., Marchesi, M., Davoli, D., Capretti, L. & Coiro, V. (1989) Effects of the GABAergie agent sodium valproate on the arginine vasopressin responses to hypertonic Stimulation and upright posture in man. Clinical Endocrinology, 30, 389-395. Wible, J.H., Zerbe, R.L. & Dimicco, J.A. (1985b) Benzodiazepine receptors modulate circulating plasma vasopressin concentration. Brain Research, 359, 368-370. Risby, E.D., Hsiao, J.K., Golden, R.N. & Potter, W.Z. (1989) Intravenous alprazolam challenge in normal subjects. Biochemical, cardiovascular, and behavioral effects. Psychopharmacology, 99, 508-514. Torpy, D.J., Grice, J.E., Hockings, G.I., Walters, M.M., Crosbie, G.V. & Jackson, R.V. (1994) Alprazolam attenuates vasopressin- stimulated adrenocorticotropin and cortisol release: Evidence for synergy between vasopressin and CRH in humans. Journal of Clinical Endocrinology and Metabolism, 79, 140-144. |
[Seite 070]
4.3 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von AVP im Plasma (HNS-System) In der vorliegenden Studie konnten vor und nach dem „Forced swimming“, auch nach der Gabe der beiden Benzodiazepine keinerlei signifikante Veränderungen der peripheren AVP-Konzentration festgestellt werden, d. h. der Konzentration von AVP im Blutplasma nach seiner Freisetzung aus der Neurohypophyse. Das AVP stammt, wie das zentral intra-PVN freigesetzte AVP, aus den magnozellulären Neuronen des PVN sowie des Nucleus supraopticus (SON) und bildet einen Teil des Hypothalamo-Neurohypophysären-Systems (HNS-Systems) (Hatton, 1990). [...] Diese Beobachtung bestätigt die Ergebnisse anderer Studien: Wotjak et al. und Engelmann et al. stellten unter „Forced swimming“ keine signifikante Veränderung der peripheren AVP- Konzentration im Plasma fest (Engelmann et al., 2000; Wotjak et al., 1998). Es gibt jedoch Literatur über die Hemmung der Ausschüttung von AVP in der Neurohypophyse aus den magnozellulären Neuronen durch GABA (Tierstudien: Bisset & Chowdrey, 1980; Chowdrey & Bisset, 1988; Knepel et al., 1980; Magnusson & Meyerson, 1993; Unger et al., 1983; Wible et al., 1985a und b; Humanstudien: Chiodera et al., 1989) und durch den GABA-Agonisten Muscimol (Tierstudien: Iovino et al., 1982 und 1983; Magnusson & Meyerson, 1993; Roberts & Robinson, 1991; Wible et al., 1985a) bzw. die Förderung der Ausschüttung durch den GABA-Antagonisten Bicucullin (Tierstudien: Wible et al., 1985a und b). Obwohl die Benzodiazepine am GABAA-Rezeptor die Affinität für GABA erhöhen und deshalb als Agonisten die Ausschüttung von AVP in der Neurohypophyse hemmen sollten, sind in der vorliegenden Studie die peripheren Konzentrationen von AVP unverändert. Allerdings berichten auch Risby et al. und Torpy et al. in Humanstudien, dass sich die periphere Konzentration von AVP im Plasma durch die Gabe von Alprazolam nicht signifikant verändert (i.v.: Risby et al., 1989; oral. Torpy et al., 1994). Wible beschreibt allerdings eine Hemmung der Freisetzung von AVP aus der Neurohypophyse durch die Gabe [Seite 071] des ältesten Benzodiazepins Chlordiazepoxid (Wible et al., 1985a). Die Wirkung der Benzodiazepine an ihrer Bindungsstelle am GABAA-Rezeptor ist somit nicht mit einer rein agonistischen Wirkung gleichzusetzen, sondern ist vielmehr von modulatorischer Art (Forth et al., 1998). Die Veränderung der Konzentration von AVP zeigt demnach nach der Gabe von Benzodiazepinen zentral und peripher einen unterschiedlichen Verlauf: Zentral im PVN kommt es zu einem Anstieg von AVP im extrazellulären Raum, peripher im Blut findet keine signifikante Veränderung der AVP-Konzentration statt. Und dies obwohl in beiden Fällen AVP aus magnozellulären Neuronen stammt. Diese differentielle Freisetzung von AVP ist von anderen Autoren bereits beschrieben worden (Engelmann et al., 2000; Wotjak et al., 1998): Hatton G I (1990) Emerging concepts of structure-function dynamics in adult brain. The hypothalamo-neurohypophysial system, in: Progress in Neurobiology 34: 437-504. Engelmann M, Wotjak C T, Ebner K und Landgraf R (2000) Behavioural impact of intraseptally released vasopressin and oxytocin in rats, in: Experimental Physiology 858: 125-130. Wotjak C T, Ganster J, Kohl G, Holsboer F, Landgraf R und Engelmann M (1998) Dissociated central and peripheral release of vasopressin, but not oxytocin, in response to repeated swim stress. New insights into the secretory capacities of peptidergic neurons, in: Neuroscience 85: 1209-1222. Bisset G W und Chowdrey H S (1980) Central inhibition by GABA ofthe release of vasopressin by carbachol in the rat, in: British Journal of Pharmacology 70: 78P. Chowdrey H S und Bisset G W (1988) Central inhibition by y-aminobutyric acid of the release of vasopressin by carbachol in the rat, in: British Journal of Pharmacology 93: 349-356. Knepel W, Nutto D und Hertting G (1980) Evidence for the involvement of a GABA-mediated inhibition in the hypovolaemia-induced vasopressin release, in: Pflügers Archiv. European Journal of Physiology 388: 177-183. Magnusson A M und Meyerson B J (1993) GABA-A agonist muscimol Inhibits stimulated vasopressin release in the posterior pituitary of sprague-dawley, wistar, wistar-Kyoto and spontaneously hypertensive rats, in: Neuroendocrinology 58. 519-524. Roberts M M und Robinson AG (1991) The GABA agonist muscimol reduces vasopressin synthesis and release, in: Society for Neuroscience. Abstracts 17 (472.5): 1187. Unger T, Bles F Ganten D, Lang R E, Rettig R und Schwab N A (1983) GABAergic stimulation inhibits central actions of angiotensin II. Pressor responses, drinking and release of vasopressin, in: European Journal of Pharmacology 90: 1-9. Wible, Jr. J H, Zerbe R L und DiMicco J A (1985a) Benzodiazepine receptors modulate circulating plasma vasopressin concentration, in: Brain Research 359: 368-370. Wible J H, Zerbe R L und DiMicco J A (1985b) Stimulation of vasopressin release by y-aminobutyric acid antagonists in spinal cord transected rats, in: Journal of Pharmacology and Experimental Therapeutics 234: 378-385. Chiodera P, Gnudi A, Volpi R, Marchesi C, Marchesi M, Davoli D, Capretti L und Coiro V (1989) Effects ofthe GABAergic agent sodium valproate on the arginine vasopressin responses to hypertonic stimulation and upright posture in man, in: Clinical Endocrinology 30: 389-395. Iovino M, Steardo L und Poenaru S ( 1982) Inhibitory effect of centrally administered muscimol on increased plasma ADH concentration to angiotensin II, in: Neuroendocrinology Letters 4: 342-347. Iovino M, de Caro G, Massi M, Steardo L und Poenaru S (1983) Muscimol inhibits ADH release induced by hypertonic sodium chloride in rats, in: Pharmacology Biochemistry & Behavior 19: 335-338. Risby E D, Hsiao J K, Golden R N und Potter W Z (1989) Intravenous alprazolam challenge in normal subjects. Biochemical, cardiovascular, and behavioral effects, in: Psychopharmacology 99: 508-514. Torpy D J, Grice J E, Hockings G I, Walters M M, Crosbie G V und Jackson R V (1994) Alprazolam attenuates vasopressin-stimulated adrenocorticotropin and cortisol release. Evidence for synergy between vasopressin and corticotropin-releasing hormone in humans, in: Journal of Clinical Endocrinology and Metabolism 79: 140-144. Forth W, Heuschier D, Rummel W und Starke K (Hrsg.) (1998) Allgemeine und spezielle Pharmakologie und Toxikologie, Spektrum Akademischer Verlag, 7. Auflage, Heidelberg, Berlin, Oxford. |
Kein Hinweis auf die Quelle. |
| [70.] Mek/Fragment 100 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 100, Zeilen: 01 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 071-073, Zeilen: 071:9-17; 072:01ff.; 073:01-10 |
|---|---|
| [Diese differentielle Freisetzung von AVP aus magnozellulären Neuronen ist von anderen] Autoren bereits beschrieben worden (Wotjak et al., 1998): Magnozelluläre Neurone des PVN und des SON können von den Dendriten und Zellsomata AVP freisetzen, während die Sekretion von AVP an den Axonterminalen in der Neurohypophyse blockiert ist. Neurone sind somit in der Lage, unter Stress die Sekretion von Peptiden von den Dendriten/Somata und den Axonen in voneinander unabhängiger Weise zu regulieren (Engelmann et al., 1998; Wotjak et al., 1998). Die zugrunde liegenden Mechanismen sind bislang nur ungenügend verstanden.
4.2.8.2.2 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von ACTH und Kortikosteron im Plasma (HPA-Achse) Alprazolam und Temazepam hemmten beide dosisabhängig den durch den Schwimmstressor bedingten ACTH-Anstieg. Der Anstieg der Kortikosteron-Konzentration veränderte sich allerdings nicht in signifikanter Weise. Die Bestimmung von ACTH und Kortikosteron erlaubt den Rückschluss auf die Aktivität zentraler Neuronenpopulationen der HPA-Achse, genauer gesagt auf das Verhalten der parvozellulären Neurone des PVN des Hypothalamus, die über Portalgefäße in der Eminentia mediana CRH und AVP zur Adenohypophyse sezernieren, um dort synergistisch die ACTH-Sekretion zu stimulieren (Gillies et al., 1982; Rivier et al., 1984; Whitnall, 1993; Aguilera & Rabadan-Diehl, 2000; Aguilera et al., 2001). Die von uns beobachtete signifikante Hemmung des stressorinduzierten ACTH-Anstiegs durch die beiden Benzodiazepine bestätigt die bestehende Erkenntnislage (Schuckit et al., 1992; Arvat et al., 1999; Skelton et al., 2000). Die Frage einer differentiellen und Benzodiazepin-spezifischen Regulation der Synthese und Sekretion von CRH und AVP kann jedoch im Rahmen der vorliegenden Arbeit nicht beantwortet werden, da CRH und AVP nicht im Portalblut der Hypophyse gemessen wurden. Bislang vorliegende Studien geben lediglich indirekte Hinweise darauf, dass Alprazolam die Synthese und Sekretion von CRH hemmt (Owens et al., 1989; Kalogeras et al., 1990; Owens et al., 1993; Arvat et al., 1999; Skelton et al., 2000b), wohingegen Temazepam eher auf vasopressinerge Neurone wirken soll (Korbonits et al., 1995). Allerdings weisen diese Untersuchungen ein methodisches Problem auf: ACTH und Kortikosteron wurden im peripheren Blut bestimmt, und es wurde lediglich [indirekt auf die zentrale Aktivität von CRH und AVP geschlossen.] Wotjak, C.T., Ganster, J., Kohl, G., Holsboer, F., Landgraf, R. & Engelmann, M. (1998) Dissociated central and peripheral release of vasopressin, but not oxytocin, in response to repeated swim stress: new insights into the secretory capacities of peptidergic neurons. Neuroscience, 85, 1209- 1222. Engelmann, M ., Wotjak, C.T. & Landgraf, R (1998) Differential central and peripheral release of vasopressin and oxytocin in response to swim stress in rats. [Review] [15 refs]. Advances in Experimental Medicine & Biology, 449, 175-177. Gillies, G.E., Linton, E.A. & Lowry, P.J. (1982) Corticotropin releasing activity of the new CRF is potentiated several times by vasopressin. Nature, 299, 355-357. Rivier, C., Rivier, J ., Mormede, P. & Vale, W. (1984) Studies ofthe nature of the interaction between vasopressin and corticotropin-releasing factor on adrenocorticotropin release in the rat. Endocrinology, 115, 882-886. Whitnall, M.H. (1993) Regulation of the hypothalamic corticotropin-releasing hormone neurosecretory system. Prog Neurobiol, 40, 573-629. Aguilera, G. & Rabadan-Diehl, C. (2000) Vasopressinergic regulation of the hypothalamic-pituitary-adrenal axis: implications for stress adaptation. Regulatory Peptides, 96, 23-29. Aguilera, G., Rabadan-Diehl, C. & Nikodemova, M. (2001) Regulation of pituitary corticotropin releasing hormone receptors. Peptides, 22, 769-774. Schuckit, M.A., Hauger, R.L. & Klein, J.L. (1992) Adrenocorticotropin Hormone Response to diazepam in healthy young men. Biological Psychiatry, 31, 661-669. Arvat, E., Maccagno, B. , Ramunni, J., Di Vito, L. , Giordano, R., Gianotti, L., Broglio, F., Camanni, F. & Ghigo, E. (1999) The inhibitory effect of alprazolam, a benzodiazepine, overrides the stimulatory effect of metapyrone- induced lack of negative cortisol feedback on corticotroph secretion in humans. Journal of Clinical Endocrinology and Metabolism, 84, 2611-2615. Skelton, K.H., Nemeroft, C.B., Knight, D.L. & Owens, M.J. (2000) Chronic administration of the triazolobenzodiazepine alprazolam produces opposite effects on corticotropin-releasing factor and urocortin neuronal systems. The Journal of Neuroscience, 20, 1240-1248. Owens, M.J., Bissette, G. & Nemeroff, C.B. (1989) Acute effects of alprazolam and adinazolam on the concentrations of CRF in the rat brain. Synapse, 4, 196-202. Kalogeras, K.T., Calogero, A.E. , Kuribayashi, T. , Khan, 1., Gallucci, W.T. , Kling, M.A., Chrousos, G.P. & Gold, P.W. (1990) In vitro andin vivo effects of the triazolobenzodiazepine alprazolam on hypothalamic- pituitary- adrenal function: pharmacological and clinical implications. Journal of Clinical Endocrinology and Metabolism, 20, 1462-1471. Owens, M.J., Vargas, M.A. & Nemeroff, C.B. (1993) The effects of alprazolam on CRF neurons in the rat brain: implications for a role for CRF in the pathogenesis of anxiety disorders. Journal of Psychiatrie Research, 27, 209-220. Skelton, K.H., Nemeroff, C.B. & Owens, M.J. (2000c) A comparison of plasma alprazolam concentrations folowing different routes of chronic administration in the Sprague- Dawley rat: implications for psychotropic drug research. Psychopharmaclogy, 151, 76. Korbonits, M., Trainer, P.J., Edwards, R., Besser, G.M. & Grossman, AB. (1995) Benzodiazepines attenuate the pituitary- adrenal responses to CRH in healthy volunteers, but not in patients with Cushing's syndrome. Clinical Endocrinology, 43, 29-35. |
[Seite 071]
Diese differentielle Freisetzung von AVP ist von anderen Autoren bereits beschrieben worden (Engelmann et al., 2000; Wotjak et al., 1998): Magnozelluläre Neurone des PVN und des SON können von den Dendriten und den Zellsomata AVP freisetzen (Ludwig & Leng, 1998; Morris et al., 2000; Nordmann & Dayanithi, 1988; Pow & Morris, 1989), während die Sekretion von AVP am Axonterminal in der Neurohypophyse blockiert ist (Wotjak et al., 1998). Neurone sind somit in der Lage, unter Stress die Sekretion von Peptiden von den Dendriten/Somata und den Axonen in voneinander unabhängiger Weise zu regulieren. Die zugrundeliegenden Mechanismen sind bislang nur ungenügend verstanden (Wotjak et al., 1998). [Seite 072] 4.4 Wirkung von Alprazolam und Temazepam auf die stressorinduzierte Freisetzung von ACTH und Corticosteron im Plasma (HPA-Achse) In der vorliegenden Dissertation konnten folgende Effekte der beiden Benzodiazepine auf die stressorinduzierte Steigerung der Freisetzung von ACTH und CORT festgestellt werden: Alprazolam und Temazepam hemmten beide dosisabhängig den durch den Schwimmstressor bedingten ACTH-Anstieg (Abb. 3.7 und Abb. 3.8). Der Anstieg der CORT-Konzentration, der durch den Verhaltensstressor des "Forced swimming“ bervorgerufen wurde, veränderte sich allerdings nicht in signifikanter Weise (Abb. 3.9 und Abb. 3.10). [...] [...] Die Bestimmung von ACTH und CORT erlaubt den Rückschluß auf die Aktivität zentraler Neuronenpopulationen der HPA-Achse, genauer gesagt auf das Verhalten der parvozellulären Neurone des PVN des Hypothalamus, die über Portalgefäße in der Eminentia mediana CRH und AVP zur Adenohypophyse sezernieren um dort synergistisch die ACTH-Sekretion zu stimulieren (Aguilera & Rabadan-Diehl, 2000b; Aguilera et al., 2001; Antoni, 1993; Gillies et al., 1982; Plotsky, 1987b und 1991; Rivier & Vale, 1983a; Rivier et al., 1984; Sawchenko & Swanson, 1985; Swanson & Sawchenko, 1983; Torpy et al., 1994; Vale et al., 1981; Whitnall, 1989 und 1993; Yates et al., 1971). [...] Die in dieser Dissertation beobachtete signifikante Hemmung des stressorinduzierten ACTH-Anstiegs durch die beiden Benzodiazepine bestätigt die bestehende Erkenntislage (Arvat et al., 1998 und 1999; Breier et al., 1991 und 1992; Bruni et al., 1980; Kalogeras et al., 1990; Korbonits et al., 1995; Owens et al., 1989 und 1993; Pericic et al., 1984; Rohrer et al., 1994; Schuckit et al., 1992; Schürmeyer et al., 1988; Skelton et al., 2000a; Torpy et al., 1993 und 1994). Ob diese Wirkung auf dem Effekt von CRH oder AVP oder CRH / AVP gemeinsam beruht, kann in dieser Dissertation aus methodischen Gründen nicht entschieden werden, da CRH und AVP nicht im Portalblut der Hypophyse gemessen wurden. Dies wäre [Seite 073] versuchstechnisch im Ablauf des Experiments nicht möglich gewesen. Somit kann die Frage einer differentiellen und Benzodiazepin-spezifischen Regulation der Synthese und Sekretion von CRH und AVP im Rahmen der vorliegenden Arbeit nicht beantwortet werden. Bislang vorliegende Studien geben lediglich indirekte Hinweise darauf, dass Alprazolam die Sekretion von CRH hemmt (Arvat et al., 1998 und 1999; Kalogeras et al., 1990; Owens et al., 1989 und 1993; Rohrer et al., 1994; Skelton et al., 2000a; Torpy et al., 1993 und 1994), wohingegen Temazepam eher die Sekretion von AVP mindern soll (Korbonits et al., 1995) (siehe Abb. 1.6). Allerdings weisen diese Untersuchungen ein methodisches Problem auf: Sie bestimmen ACTH und CORT im peripheren Blut und schließen lediglich indirekt auf die zentrale Aktivität von CRH und AVP zurück. Engelmann M, Wotjak C T, Ebner K und Landgraf R (2000) Behavioural impact of intraseptally released vasopressin and oxytocin in rats, in: Experimental Physiology 858: 125-130. Wotjak C T, Ganster J, Kohl G, Holsboer F, Landgraf R und Engelmann M (1998) Dissociated central and peripheral release of vasopressin, but not oxytocin, in response to repeated swim stress. New insights into the secretory capacities of peptidergic neurons, in: Neuroscience 85: 1209-1222. Ludwig M und Leng G (1998) Intrahypothalamic vasopressin release. An inhibitor of systemic vasopressin secretion?, in: Advances in Experimental Medicine and Biology 449: 163-173. Morris J F, Christian H, Ma Dan und Wang Hui (2000) Dendritic secretion of peptides from hypothalamic magnocellular neurosecretory neurones. A local dynamic control system and its functions, in: Experimental Physiology 85S: 131S-138S. Nordmaun J J und Dayanithi G (1988) Release of neuropeptides does not only occur at nerve terminals, in: Bioscience Reports 8: 471-483. Pow D V und Morris J F (1989) Dendrites of hypothalamic magnocellular neurons release neurohypophysial peptides by exocytosis, in: Neuroscience 32: 435-439. Aguilera G und Rabadan-Diehl C (2000b) Vasopressinergic regulation of the hypothalamicpituitary-adrenal axis. Implications for stress adaptation, in: Regulatory Peptides 96: 23-29. Aguilera G, Rabadan-Diehl C und Nikodemova M (2001) Regulation of pituitary corticotropin releasing hormone receptors, in: Peptides 22: 769-774. Antoni FA (1993) Vasopressinergic control of pituitary adrenocorticotropin secretion comes of age, in: Frontiers in Neuroendocrinology 14: 76-122. Gillies GE, Linton E A und Lowry P J (1982) Corticotropin releasing activity of the new CRF is potentiated several times by vasopressin, in: Nature 299: 355-357. Plotsky P M (1987b) Regulation of hypophysiotropic factors mediating ACTH secretion, in:Annals New York Academy of Sciences 512: 205-217. Plotsky P M (1991) Pathways to the secretion of adrenocorticotropin. A view from the portal, in: Journal of Neuroendocrinology 3: 1-9. Rivier C und Vale W (1983a) Interaction of corticotropin-releasing factor and arginine vasopressin on adrenocorticotropin secretion in vivo, in: Endocrinology 113: 939-942. Rivier C, Rivier J, Mormede P und Vale W (1984) Studies of the nature of the interaction between vasopressin and corticotropin-releasing factor on adrenocorticotropin release in the rat, in: Endocrinology 115: 882-886. Sawchenko P E und Swanson L W (1985) Localization, colocalisation, and plasticity of corticotropin-releasing factor immunoreactivity in rat brain, in: Federation Proceedings 44: 221-227. Swanson L W und Sawchenko P E (1983) Hypothalamic integration. Organization of the paraventricular and supraoptic nuclei, in: Annual Review of Neuroscience 6: 269-324. Torpy D J, Grice J E, Hockings G I, Walters M M, Crosbie G V und Jackson R V (1994) Alprazolam attenuates vasopressin-stimulated adrenocorticotropin and cortisol release. Evidence for synergy between vasopressin and corticotropin-releasing hormone in humans, in: Journal of Clinical Endocrinology and Metabolism 79: 140-144. Vale W, Spiess J, Rivier C und Rivier J (1981) Characterization of a 41-residue ovine hypothalamic peptide that stimulates secretion of corticotropin and ß-endorphin, in: Science 213: 1394-1397. Whitnall M H (1989) Stress selectively activates the vasopressin-containing subset of corticotropin-releasing hormone neurons, in: Neuroendocrinology 50: 702-707. Whitnall M H (1993) Regulation of the hypothalamic corticotropin-releasing hormone neurosecretory system, in: Progress in Neurobiology 40: 573-629. Yates F E Russell S M, Dallman M F, Hedge G A, McCann S M und Dhariwal A P S (1971) Potentiation by vasopressin of corticotropin release induced by corticotropin-releasing factor, in: Endocrinology 88: 3-15. Arvat E, Maccagno B, Ramunni J, Di Vito L, Gianotti L, Broglio F, Benso A, Deghenghi R, Camanni R und Ghigo E (1998) Effects of dexamethasone and alprazolam, a benzodiazepine, on the stimulatory effect of hexarelin, a synthetic GHRP, on ACTH, cortisol and GH secretion in humans, in: Neuroendocrinology 67: 310-316. Arvat E, Maccagno B, Ramunni J, Di Vito L, Giordano R, Gianotti L, Broglio F, Camanni F und Ghigo E (1999) The inhibitory effect of alprazolam, a benzodiazepine, overrides the stimulatory effect of metyrapone-induced lack of negative cortisol feedback on corticotroph secretion in humans, in: Journal of Clinical Endocrinology & Metabolism 84: 2611-2615. Breier A, Davis O R und Buchanan R W (1991) Alprazolam attenuates metabolic stressinduced neuroendocrine and behavioral effects in humans, in: Psychopharmacology 104: 479-484. Breier A, Davis O, Buchanan R, Listwak S J, Holmes C, Piekar D und Goldstein D S (1992) Effects of alprazolam on pituitary-adrenal and catecholaminergic responses to metabolic stress in humans, in: Biological Psychiatry 32: 880-890. Bruni G, Dal Pra P, Dotti M T und Segre G (1980) Plasma ACTH and cortisol levels in benzodiazepine treated rats, in: Pharmacological Research Communications 12: 163-175. Kalogeras K T, Calogero A E, Kuribayiashi T, Khan I, Gallucci W T, Kling M A Chrousos G P und Gold P W (1990) In vitro and in vivo effects of the triazolobenzodtazepine alprazolam on hypothalarnic-pimitary-adrenal function. Pharmacological and clinical implications, in: Journal of Clinical Endocrinology and Metabolism 70: 1462-1471. Korbonits M, Trainer P J, Edwards R, Besser G M und Grossman A B (1995) Benzodiazepines attenuate the pituitary-adrenal responses to corticotrophine-releasing hormone in healthy volunteers, but not in patients with Cushing's syndrom, in: Clinical Endocrinology 43: 29-35. Owens M J, Bissette G und Nemeroff C B (1989) Acute effects of alprazolam and adinazolam on the concentrations of corticotropin-releasing factor in the rat brain, in: Synapse 4: 196-202. Owens M J, Vargas M A und Nemeroff C B (1993) The effects of alprazolam on corticotropin-releasing factor neurons in the rat brain. Implications foraroJe for CRF in the pathogenesis ofanxiety disorders, in: Journal of Psychiatric Research 27: 209-220. Pericic D, Lakic N und Manev H (1984) Effect of diazepam on plasma corticosterone levels, in: Psychopharmacology 83: 79-81 . Rohrer T, von Richthofen V, Schulz C, Beyer J und Lehnert H (1994) The stress-, but not corticotropin-releasing hormone-induced activation of the pituitary-adremal axis in man is blocked by alprazolam, in: Hormone and Metabolic Research 26. 200-206. Schuckit M A, Hauger R und Klein J L (1992) Adrenocorticotropin hormone response to diazepam in healthy young men, in: Biological Psychiatry 31: 661-669. Schürmeyer T H, Tomai T P, Steinbach H, von zur Mühlen A und Gold P W (1988) Pituitary and adrenal responses to insulin induced hypoglycenua and to CRH are modulated by anxiolytic pretreatment in man, in: D' Agata R und Chrousos G P (Hrsg.), Recent advances in adrenal regulation and function, Raven Press, New York: 285-291. Skelton K H, Nemeroff C B, Knight D L und Owens M J (2000a) Chronic administration of the triazolobenzodiazepine alprazolam produces opposite effects on corticotropin-releasing factor and urocortin neuronal systems, in: Journal of Neuroscience 20: 1240-1248. Torpy D J, Grice J E, Hockings G I, Walters M M, Crosbie G V und Jackson R V (1993) Alprazolam blocks the naloxone-stimulated hypothalamo-pituitary-adrenal axis in man, in: Journal of Clinical Endocrinology and Metabolism 76: 388-391. |
Kein Hinweis auf die Quelle. Der Autor verwendet durchgäng die deutsche Schreibweise von z.B. Kortikosteron. Die Literatur ist hier und da etwas umgestellt. |
| [71.] Mek/Fragment 101 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 101, Zeilen: 01 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 073, 074, Zeilen: 073:09-33, 074:01 + 05-08 + 13-21 |
|---|---|
| [Allerdings weisen diese Untersuchungen ein methodisches Problem auf: ACTH und Kortikosteron wurden im peripheren Blut bestimmt, und es wurde lediglich] indirekt auf die zentrale Aktivität von CRH und AVP geschlossen. Manche Studien provozieren die Sekretion mit AVP (Torpy et al., 1994) oder CRH (Korbonits et al., 1995) und folgern dann auf die Wirkung des jeweils anderen Neuropeptids zurück: Torpy et al. stellten bei gesunden Probanden eine Hemmung der AVP-stimulierten Freisetzung von ACTH und Kortisol fest und schlossen auf eine Suppression der hypothalamischen Freisetzung von CRH und eine daraus folgende Schwächung der Synergie zwischen CRH und AVP durch Alprazolam. Korbonits et al. beobachteten an gesunden Probanden, dass Temazepam die CRH-induzierte Sekretion von ACTH und Kortisol inhibiert. Hieraus folgerten sie, dass Temazepam über die Hemmung der hypothalamischen AVP-Freisetzung wirkt.
Benzodiazepine wirken über GABAA-Rezeptoren, die auf den parvozellulären Neuronen des PVN lokalisiert sind: GABA hemmt dort die Ausschüttung von CRH (in vitro: Calogero et al., 1988; Tsagarakis et al., 1990; in vivo: Plotsky et al., 1987) und AVP (in vitro: Hillhouse & Milton, 1989). Muscimol inhibiert ebenfalls parvozelluläre CRH-Neurone mit nachfolgender Sekretionshemmung von ACTH (Tsagarakis et al., 1990; Morin et al., 2001); Bicucullin fördert die Genexpression von CRH und AVP in den parvozellulären Neuronen des PVN mit hieraus resultierender vermehrter Sekretion von ACTH und Kortikosteron (Cole & Sawchenko, 2002). Hierbei muss jedoch berücksichtigt werden, dass die im vorliegenden Experiment gemessenen Akuteffekte nicht mit Veränderungen der Genexpression erklärt werden können, da diese zeitlich verzögert auftreten. In der vorliegenden Studie wurde der bekannte stressorinduzierte Anstieg der Kortikosteron-Konzentration nicht, wie eigentlich erwartet, signifikant durch die beiden Benzodiazepine reduziert. Bruni et al. stellten in einer tierexperimentellen Arbeit mit Ratten diesen Effekt jedoch ebenfalls nur bei wiederholter Gabe von Benzodiazepinen fest (Bruni et al., 1980). Dieser Befund legt nahe, dass die Kortikosteron-Freisetzung an der Nebenniererinde möglicherweise erst nach mehrmaliger Benzodiazepin-Applikation im Rahmen adaptiver Mechanismen gehemmt werden kann. Auch andere Untersuchungen zeigten ein im Vergleich zu ACTH geringeres Ansprechen von Kortikosteron auf die Gabe von Alprazolam bei Rhesusaffen (Kalogeras et al., 1990). Daneben wird die Sekretion von Kortikosteron aus der Nebennierenrinde nicht nur durch ACTH, sondern wesentlich auch durch die Aktivität des sympathoadrenalen Systems gesteuert (Breier et al., 1992; Whitnall, [1993).] Torpy, D.J., Grice, J.E., Hockings, G.I., Walters, M.M., Crosbie, G.V. & Jackson, R.V. (1994) Alprazolam attenuates vasopressin- stimulated adrenocorticotropin and cortisol release: Evidence for synergy between vasopressin and CRH in humans. Journal of Clinical Endocrinology and Metabolism, 79, 140-144. Korbonits, M., Trainer, P.J., Edwards, R., Besser, G.M. & Grossman, AB. (1995) Benzodiazepines attenuate the pituitary- adrenal responses to CRH in healthy volunteers, but not in patients with Cushing's syndrome. Clinical Endocrinology, 43, 29-35. Calogero, A.E., Gallucci, W.T., Chrousos, G.P. & Gold, P.W. (1988) Interaction between GABAergic neurotransmission and rat hypothalamic CRH secretion in vitro. Brain Research, 463, 28-36. Tsagarakis, S., Rees, L.H ., Besser, G.M. & Grossman, A.B. (1990) GABA modulation of CRF-41 secretion from the rat hypothalamus in vitro. Journal of Neuroendocrinology, 2, 221-224. Plotsky, P.M., Otto, S. & Sutton, S. (1987) Neurotransmitter modulation of CRF secretion into the hypophysial- portal circulation. Life Sciences, 41 , 1311-1317. Hillhouse, E.W. & Milton, N.G.N. (1989) Effects of noradrenaline and GABA on the secretion of CRF 41 and arginine vasopressine from the rat hypothalamus in vitro. Journal of Endocrinology, 122, 719-723. Marin, S.M., Stotz-Potter, E.H. & Dimicco, J.A. (2001) Injection of muscimol in dorsomedial hypothalamus and stress- induced fos expression in paraventricular nucleus. American Journal of Physiology, 280, 276-284. Cole, R.L. & Sawchenko, P.E. (2002) Neurotransmitter regulation of cellular activation and neuropeptide gene expression in the paraventricular nucleus of the hypothalamus. The Journal of Neuroscience, 22, 959-969. Bruni, G., Dotti, M.T. & Segre, G. (1980) Plasma ACTH and cortisol levels in benzodiazepine treated rats. Pharmacological Research, 12, 163-175. Kalogeras, K.T., Calogero, A.E., Kuribayashi, T., Khan, I., Gallucci, W.T., Kling, M.A., Chrousos, G.P. & Gold, P.W. (1990) In vitro and in vivo effects of the triazolobenzodiazepine alprazolam on hypothalamic- pituitary- adrenal function: pharmacological and clinical implications. Journal of Clinical Endocrinology and Metabolism, 20, 1462-1471. Breier, A., Davis, O., Buchanan, R., Listwak, S.J., Holmes, C., Pickar, D. & Goldstein, D.S. (1992) Effects of alprazolam on pituitariy- adrenal and catecholaminergic responses to metabolic stress in humans. Biological Psychiatry, 32, 880-890. Whitnall, M.H. (1993) Regulation of the hypothalamic corticotropin-releasing hormone neurosecretory system. Prog Neurobiol, 40, 573-629. |
[Seite 73]
Allerdings weisen diese Untersuchungen ein methodisches Problem auf: Sie bestimmen ACTH und CORT im peripheren Blut und schließen lediglich indirekt auf die zentrale Aktivität von CRH und AVP zurück. Manche Studien provozieren die Sekretion mit AVP (Torpy et al., 1994) oder CRH (Korbonits et al., 1995) und folgern dann auf die Wirkung des jeweils anderen Neuropeptids zurück Torpy et al. stellten in einer Humanstudie mit 8 gesunden Probanden fest, dass Alprazolam (2 mg, oral) die AVP-stimulierte Freisetzung von ACTH und Cortisol mindert. Dafür machten sie die Suppression der hypothalamischen Freisetzung von CRH und daraus folgender Schwächung der Synergie zwischen CRH und AVP durch Alprazolam verantwortlich (Torpy et al., 1994). Korbonits et al. beobachteten in einer Humanstudie mit 12 gesunden Probanden, dass Temazepam (20 mg, oral) die CRH-induzierte Sekretion von ACTH und Cortisol inhibiert. Hieraus folgerten sie, dass Temazepam über die Hemmung der hypothalamischen AVP-Freisetzung wirkt (Korbonits et al., 1995). Die Benzodiazepine wirken über GABAA-Rezeptoren, die auf den parvozellulären Neuronen des PVN vorhanden sind: GABA hemmt dort die Ausschüttung von CRH (in vitro: Calogero et al., 1988b; Meister et al., 1988; Olschowka, 1987; Tsagarakis et al., 1990; in vivo: Plotsky et al., 1987a) und AVP (in vitro: Hillhouse & Milton, 1989). Muscimol inhibiert ebenfalls parvozelluläre CRH-Neurone mit nachfolgender Sekretionshemmung von ACTH (Stotz-Potter et al., 1996; Tsagarakis et al., 1990); Bicucullin fördert die Genexpression von CRH und AVP (Cole & Sawchenko, 2002) in den parvozellulären Neuronen des PVN mit hieraus resultierender vermehrter Sekretion von ACTH (Makara & Stark, 1974; Tsagarakis et al., 1990) und CORT (Cole & Sawchenkp, 2002). Hierbei muss jedoch berücksichtigt werden, dass die im vorliegenden Experiment gemessenen Akuteffekte nicht mit Veränderungen der Genexpression erklärt werden können, da diese zeitlich verzögert auftreten. In der vorliegenden Studie wurde der bekannte stressorinduzierte Anstieg der CORT-Konzentration nicht, wie eigentlich erwartet, signifikant durch die beiden Benzodiazepine [Seite 74] reduziert [...]. [...] Bruni et al. stellten in einer tierexperimentellen Arbeit mit Ratten diesen Effekt jedoch nur bei wiederholter Gabe von Benzodiazepinen [...] fest. [...] Dieser Befund legt nahe, dass die CORT-Freisetzung an der Nebenniererinde erst nach mehrmaliger Benzodiazepin-Applikation im Rahmen adaptiver Mechanismen gehemmt werden kann. Auch Kalogeras et al. berichten von einem im Vergleich zu ACTH weniger deutlicherem Ansprechen von CORT auf die Gabe von intravenös in einer Dosis von 0,01/0,03/0,1 mg/kg (wiederholt in 3 bis 4 tägigen Intervallen) verabreichtem Alprazolam bei Rhesusaffen (Kalogeras et al., 1990). Daneben wird die Sekretion von CORT aus der Nebennierenrinde nicht nur durch ACTH, sondern wesentlich auch durch die Aktivität des sympathoadrenalen Systems (Breier et al., 1992; Holsboer, 2000; Whitnall, 1993) gesteuert. Torpy D J, Grice J E, Hockings G I, Walters M M, Crosbie G V und Jackson R V (1994) Alprazolam attenuates vasopressin-stimulated adrenocorticotropin and cortisol release. Evidence for synergy between vasopressin and corticotropin-releasing hormone in humans, in: Journal of Clinical Endocrinology and Metabolism 79: 140-144. Korbonits M, Trainer P J, Edwards R, Besser G M und Grossman A B (1995) Benzodiazepines attenuate the pituitary-adrenal responses to corticotrophine-releasing hormone in healthy volunteers, but not in patients with Cushing's syndrom, in: Clinical Endocrinology 43: 29-35. Calogero A E, Gallucci W T, Chrousos G P und Gold P W (1988b) Interaction between GABAergic neurotransmission and rat hypothalamic corticotropin-releasing hormone secretion in vitro, in: Brain Research 463: 28-36. Meister B, Hökfelt T, Geffard M und Oertel W (1988) Glutamic acid decarboxylase- and y-aminobutyric acid-like immunoreactivities in corticotropin-releasing factor-containing parvocellular neurons of the hypothalamic paraventrtcular nucleus, in: Neuroendocrinology 48: 516-526. Olschowka JA (1987) GABAergic innervation of corticotropin releasing factor neurons in the rat paraventricular nucleus. An electron microscopic immunocytochemical study, in: Society for Neuroscience. Abstracts 13 (460.15): 1656. Tsagarakis S, Rees L H, Besser G M und Grossman A (1990) Gamma-aminobutyric acid modulation of corticotrophin-releasing factor-41 secretion from the rat hypothalamus in vitro, in: Journal of Neuroendocrinology 2: 221-224. Plotsky P M, Otto S und Sutton S (1987a) Neurotransmiter modulation of co~icotropin releasing factor secretion into the hypophysial-portal circulation, in: Life Sciences 41: 1311-1317. Hillhouse E W und Milton N G N (1989) Effect of noradrenaline and y-aminobutyric acid on the secretion of corticotrophin-releasing factor-41 and arginine vasopressin from the rat hypothalamus in vitro, in: Journal of Endocrinology 122: 719-723. Stotz-Potter E H, Morin S M und DiMicco J A (1996) Effect of microinjection of muscimol into the dorsomedial or paraventricular hypothalamic nucleus on air stress-induced neuroendocrine and cardiovascular changes in rats, in: Brain Research 742:219-224. Cole R L und Sawchenko P E (2002) Neurotransmitter regulation of cellular activation and neuropeptide gene expression in the paraventricular nucleus of the hypothalamus, in: Journal of Neuroscience 22: 959-969. Makara G Bund Stark E (1974) Effect of gamma-aminobutyric acid (GABA) and GABA antagonist drugs on ACTH release, in: Neuroendocrinology 16: 178-190. Kalogeras K T, Calogero A E, Kuribayiashi T, Khan I, Gallucci W T, Kling M A, Chrousos G P und Gold P W (1990) In vitro and in vivo effects of the triazolobenzodiazepine alprazolam on hypothalamic-pituitary-adrenal function. Pharmacological and clinical implications, in: Journal of Clinical Endocrinology and Metabolism 70: 1462-1471. Breier A, Davis O, Buchanan R, Listwak S J, Holmes C, Piekar D und Goldstein D S (1992) Effects of alprazolam on pituitary-adrenal and catecholaminergic responses to metabolic stress in humans, in: Biological Psychiatry 32: 880-890. Holsboer F (2000) The corticosteroid receptor hypothesis of depression, in: Neuropsychopharmacology 23:477-501. Whitnall M H (1993) Regulation of the hypothalamic corticotropin-releasing hormone neurosecretory system, in: Progress in Neurobiology 40: 573-629. |
Kein Hinweis auf die Quelle. |
| [72.] Mek/Fragment 102 03 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 102, Zeilen: 03-28 |
Quelle: Schindele 2003 Seite(n): 075, 077, Zeilen: 075:01ff.; 077:01-05 |
|---|---|
| 4.2.8.2.3 Keine direkte Wirkung von Alprazolam und Temazepam auf die ACTH-Sekretion der Adenohypophyse
Die hemmende Wirkung von Benzodiazepinen auf den stressorinduzierten ACTH Anstieg wird allgemein auf die Hemmung der zentralen Sekretion von CRH und / oder AVP zurückgeführt. Eine alternative Erklärung bietet jedoch die Möglichkeit einer lokalen gabaergen Hemmung der ACTH-Freisetzung an der Adenohypophyse. Deshalb wurde im Rahmen dieser Studie ein separates Experiment zur Wirkung der beiden Benzodiazepine auf die ACTH-Sekretion in primären Rattenhypophysenzellkulturen durchgeführt. Nach Behandlung der Zellkulturen mit Alprazolam oder Temazepam konnten jedoch keine signifikanten Veränderungen gegenüber den jeweiligen Basalwerten festgestellt werden. Auch unter Stimulation der Zellkulturen mit CRH oder AVP zeigten die beiden Benzodiazepine keinen signifikanten Einfluss. Diese Ergebnisse legen nahe, dass die in vivo beobachtete Hemmung der ACTH-Sekretion an der Adenohypophyse nicht auf eine lokale Wirkung von Alprazolam oder Temazepam zurückzuführen ist und bestätigen frühere Untersuchungen mit Alprazolam, die bezüglich der CRH-induzierten Sekretion von ACTH zu demselben Ergebnis gekommen waren (Kalogeras et al., 1990). Aus diesem Grund sind die beobachteten Veränderungen der ACTH-Sekretion auf der Ebene des intrahypothalamischen Anteils der HPA-Achse zu interpretieren: Eine verminderte Sekretion von CRH und / oder AVP aus den parvozellulären Neuronen des PVN resultiert in einer verminderten hypophysären Ausschüttung von ACTH. 4.2.8.2.4 Versuch eines erklärenden Gesamtmodells der Wirkung von Alprazolam und Temazepam im PVN Die vorliegende Untersuchung erbrachte zwei wesentliche Ergebnisse über die Wirkung der Benzodiazepine Alprazolam und Temazepam auf die stressorinduzierte Aktivität der HPA-Achse: Kalogeras, K.T., Calogero, A.E., Kuribayashi, T., Khan, I., Gallucci, W.T., Kling, M.A., Chrousos, G.P. & Gold, P.W. (1990) In vitro and in vivo effects of the triazolobenzodiazepine alprazolam on hypothalamic- pituitary- adrenal function: pharmacological and clinical implications. Journal of Clinical Endocrinology and Metabolism, 20, 1462-1471. |
[Seite 075]
4.5 Direkte Wirkung von Alprazolam und Temazepam auf die ACTH-Sekretion der Adenohypophyse [...] Diese Wirkung wird allgemein auf die Hemmung der zentralen Sekretion von CRH und / oder AVP zurückgeführt, die im Rahmen der Regulation der HPA-Achse die Ausschüttung von ACTH an der Adenohypophyse im Sinne eines Regelkreises inhibieren. Es gibt dazu eine alternative Erklärungsmöglichkeit: Alprazolam und Temazepam könnten lokal, direkt an den Zellen der Adenohypophyse über GABAA-Rezeptoren die Sekretion von ACTH hemmen. Deshalb wurde im Rahmen dieser Dissertation ein separater Versuch über die Wirkung der beiden Benzodiazepine auf die ACTH-Sekretion in primären Rattenhypophysenzellkulturen mit Hilfe der Zellkulturtechnik unternommen mit eindeutigen Ergebnissen: Weder nach der Behandlung der Zellkulturen mit Alprazolam, noch mit Temazepam, konnten signifikante Veränderungen gegenüber den jeweiligen Basiswerten festgestellt werden. Auch unter einer Stimulation der Zellkulturen mit CRH oder AVP zeigten die beiden Benzodiazepine keinen signifikanten Einfluss. Dies bedeutet, dass die Hemmung der ACTH- Sekretion an der Adenohypophyse nicht auf eine direkte Wirkung von Alprazolam bzw. Temazepam zurückzuführen ist. Dies bestätigt eine frühere Untersuchung von Kalogeras et al., die bezüglich der Freisetzung von CRH zu demselben Ergebnis gekommen ist (Kalogeras et al., 1990): Alprazolam hemmte die basale und CRH-induzierte Sekretion von ACTH in einer Rattenadenohypophysenzellkultur nicht. Deshalb sind die beobachteten Veränderungen der ACTH-Sekretion auf der Ebene des intrahypothalamischen Anteils der HPA-Achse zu interpretieren: Eine verminderte Sekretion von CRH und / oder AVP aus den parvozellulären Neuronen des PVN verursacht eine reduzierte hypophysäre Ausschüttung von ACTH. [Seite 077] 4.7 Versuch eines erklärenden Gesamtmodells der Wirkung von Alprazolam und Temazepam im PVN Die vorliegende Untersuchung erbrachte zwei wesentliche Ergebnisse über die Wirkung der Benzodiazepine Alprazolam und Temazepam auf die stressorinduzierte Aktivität der HPA-Achse: Kalogeras K T, Calogero A E, Kuribayiashi T, Khan I, Gallucci W T, Kling M A, Chrousos G P und Gold P W (1990) In vitro and in vivo effects of the triazolobenzodiazepine alprazolam on hypothalamic-pituitary-adrenal function. Pharmacological and clinical implications, in: Journal of Clinical Endocrinology and Metabolism 70: 1462-1471. |
Kein Hinweis auf die Quelle. |
| [73.] Mek/Fragment 103 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 103, Zeilen: 01-25, 29-31 |
Quelle: Schindele 2003 Seite(n): 077-078, Zeilen: 077: 06-30; 078: 01-02 |
|---|---|
| 1. Steigerung der intra-PVN-Freisetzung von AVP bei gleichbleibender Freisetzung von AVP an der Neurohypophyse im Sinne der bekannten dissoziierten zentralen und peripheren Freisetzung von AVP (Wotjak et al., 1998). AVP stammt dabei vermutlich größtenteils aus den magnozellulären Neuronen des PVN (Pow & Morris, 1989; Wotjak et al., 2001; Ludwig et al., 2002), eine parvozelluläre Beteiligung kann jedoch aus methodischen Gründen im vorliegenden Experiment nicht ausgeschlossen werden.
2. Hemmung der ACTH-Sekretion an der Adenohypophyse. Die ACTH-Freisetzung wird im Rahmen der HPA-Achse über die Sekretion von CRH und AVP aus den Axonen parvozellulärer Neurone des PVN reguliert, d. h. eine Hemmung der ACTH-Sekretion bedeutet eine Hemmung der Sekretion von CRH und / oder AVP. Ein Gesamtmodell der Wirkung von Alprazolam und Temazepam muss daher die Steigerung der Intra-PVN-Freisetzung von AVP aus den magnozellulären Neuronen mit der Hemmung der Freisetzung von AVP aus den parvozellulären Neuronen des PVN verbinden. Beide Phänomene sollten darüber hinaus mit der Wirkung der Benzodiazepine über GABAA-Rezeptoren erklärt werden können. AVP wird aus den Dendriten und den Somata magnozellulärer Neurone freigesetzt (Wotjak et al., 2001, 2002). Als biologisch aktives Peptid erreicht es im extrazellulären Raum gabaerge Neurone (Engelmann et al., 1998) in der Umgebung des PVN, die V1a-Rezeptoren besitzen (Ostrowski et al., 1994). Diese perinukleären Neurone projizieren über Axone zurück zum PVN (Herman et al., 1996), wo sie über GABAA-Rezeptoren die parvozellulären Neurone des PVN hemmen (Hermes et al., 1996a, 2000; Cole & Sawchenko, 2002), welche für die Synthese und Sekretion von CRH und / oder AVP verantwortlich sind. [...] Eine Steigerung der Sekretion von AVP in den magnozellulären Neuronen kann nach diesem Modell zu einer Inhibition der Freisetzung von AVP aus den parvozellulären Neuronen führen. Wotjak, C.T., Ganster, J., Kohl, G., Holsboer, F., Landgraf, R. & Engelmann, M. (1998) Dissociated central and peripheral release of vasopressin, but not oxytocin, in response to repeated swim stress: new insights into the secretory capacities of peptidergic neurons. Neuroscience, 85, 1209- 1222. Pow, D.V. & Morris, J.F. (1989) Dendrites of hypothalamic magnocellular neurons release neurohypophysial peptides by exocytosis. Neuroscience, 32, 435-439. Wotjak, C.T. , Naruo, T., Muraoka, S., Simchen, R., Landgraf, R. & Engelmann, M. (2001) Forced swimming stimulates the expression of vasopressin and oxytocin in magnocellular neurons of the rat hypothalamic paraventricular nucleus. European Journal of Neuroscience, 13, 2273-2281. Ludwig , M., Sabatier, N., Bull, P.M., Landgraf, R., Dayanithi, G. & Leng, G. (2002) Intracellular calcium stores regulate activity-dependent neuropeptide release from dendrites. Nature, 418, 85-89. Wotjak, C.T., Ludwig, M., Ebner, K., Russell, J.A., Singewald, N., Landgraf, R. & Engelmann, M. (2002) Vasopressin from hypothalamic magnocellular neurons has opposite actions at the adenohypophysis and in the supraoptic nucleus on ACTH secretion. European Journal of Neuroscience, 16, 477-485. Engelmann, M ., Wotjak, C.T. & Landgraf, R (1998) Differential central and peripheral release of vasopressin and oxytocin in response to swim stress in rats. [Review] [15 refs]. Advances in Experimental Medicine & Biology, 449, 175-177. Ostrowski, N.L., Lolait, S.J. & Young III, W.S. (1994) Cellular localization of vasopressin V 1a receptor messenger ribonucleic acid in adult male rat brain, pineal, and brain vasculature. Endocrinology, 135, 1511-1528. Herman, J.P., Prewitt, C.M. & Cullinan, W.E. (1996) Neuronal circuit regulation of the hypothalamo-pituitary-adrenocortical stress axis. [Review] [206 refs]. Critical Reviews in Neurobiology, 10, 371-394. Hermes, M.L.H.J., Coderre, E.M. & Renaud, L.P. (1996a) GABA and glutamate rapid neurotransmission from suprachiasmatic nucleus to hypothalamic paraventricular nucleus in rat. Journal of Physiology, 496, 749-757. Hermes, M.L.H.J. , Ruijter, J.M., Buijs, R.M. & Renaud, L.P. (2000) Vasopressin increases GABAergic inhibition of rat hypothalamic paraventricular nucleus neurons in vitro. Journal of Neurophysiology, 83, 705-711. Cole, R.L. & Sawchenko, P.E. (2002) Neurotransmitter regulation of cellular activation and neuropeptide gene expression in the paraventricular nucleus of the hypothalamus. The Journal of Neuroscience, 22, 959-969. Hermes, M.L.H.J., Spanswick, D., Renaud, L.P. & Buijs, R.M. (1996b) Inhibitory action of vasopressin on neurons of the rat hpothalamic [sic] paraventricular nucleus. Abstr. Soc. Neurosci., 22, 807,816 [sic]. |
[Seite 077]
1. Steigerung der Intra-PVN-Freisetzung von AVP bei Unverändertheit der Freisetzung von AVP an der Neurohypophyse im Sinne der bekannten dissoziierten zentralen und peripheren Freisetzung von AVP (Wotjak et al., 1998). 2. Hemmung der ACTH-Sekretion an der Adenohypophyse. Dies bedeutet, ein Gesamtmodell über die Wirkung von Alprazolam und Temazepam muss die Steigerung der Intra-PVN-Freisetzung von AVP aus den magnozellulären Neuronen mit der Hemmung der Freisetzung von AVP aus den parvozellulären Neuronen des PVN verbinden. Und beide Phänomene müssen mit der Wirkung der Benzodiazepine über GABAA-Rezeptoren erklärt werden können. Der entscheidende Erklärungsansatz findet sich bei Wotjak (Wotjak et al., 1998): AVP wird aus den Dendriten und den Somata magnozellulärer Neurone (Wotjak et al., 2001 und 2002) freigesetzt. Als biologisch aktives Peptid erreicht es im extrazellulären Raum GABAerge Neurone (Engelmann et al., 1998a; Roland & Sawchenko, 1993; Tasker & Dudek, 1993) in der Nähe des PVN, die V1a-Rezeptoren besitzen (Ostrowski et al., 1994). Diese perinukleären Neurone projizieren über Axone zurück zum PVN (Cullinan et al., 1996), wo sie über GABAA-Rezeptoren die parvozellulären Neurone des PVN hemmen (Hermes et al., 1996; Cole & Sawchenko, 2002), die für die Synthese und Sekretion von CRH und / oder AVP verantwortlich sind. Eine Steigerung der Sekretion von AVP in den magnozellulären [Seite 078] Neuronen kann nach diesem Modell zu einer Hemmung der Freisetzung von AVP aus den parvozellulären Neuronen führen. Wotjak C T, Ganster J, Kohl G, Holsboer F, Landgraf R und Engelmann M (1998) Dissociated central and peripheral release of vasopressin, but not oxytocin, in response to repeated swim stress. New insights into the secretory capacities of peptidergic neurons, in: Neuroscience 85: 1209-1222. Hatton G I (1990) Emerging concepts of structure-function dynamics in adult brain. The hypothalamo-neurohypophysial system, in: Progress in Neurobiology 34: 437-504. Pow D V und Morris J F (1989) Dendrites of hypothalamic magnocellular neurons release neurohypophysial peptides by exocytosis, in: Neuroscience 32: 435-439. Wotjak C T, Naruo T, Muraoka S, Sirneben R., LandgrafRund Engelmann M (2001) Forced swimming stimulates the expression of vasopressin and oxytocin in magnocellular neurons of the rat hypothalamic paraventricular nucleus., in: European Journal of Neuroscience 13: 2273-2281. Wotjak C T, Ludwig M, Ebner K, Russen J A, Singewald N, Landgraf R und Engelmann M (2002) Vasopressin from hypothalamic magnocellular neurons has opposite actions at the adenohypophysis and in the supraoptic nucleus on ACTH secretion, in: European Journal of Neuroscience 16:477-485. Engelmann M, Wotjak C T und Landgraf R (1998a) Differential central and peripheral release of vasopressin and oxytocin in response to swim stress in rats, in: Zingg (Hrsg.), Vasopressin and Oxytocin, Plenum Press, New York: 175-177. Roland B L und Sawchenko (1993) Local origins of some GABAergic projections to the paraventricular and supraoptic nuclei of the hypothalamus in the rat, in: Journal of Comparative Neurology 332: 123-143. Tasker J G und Dudek F E (1993) Local inhibitory synaptic inputs to neurones of the paraventricular nucleus in slices of rat hypothalamus, in: Journal of Physiology 469: 179-192. Ostrowski N L, Lolait S J und Young III WS (1994) Cellular localization of vasopressin V 1 a receptor messenger ribonucleic acid in adult male rat brain, pineal, and brain vasculature, in: Endocrinology 135: 1511-1528. Hermes M L H J, Spanswiek D, Renaud L P und Buijs R M (1996) Inhibitory action of vasopressin on neurons of the rat hypothalamic paraventricular nucleus, in: Society for Neuroscience. Abstracts 22 (807.16): 2053. Cullinan W E, Helmreich D L und Watson S J (1996) Fos expression in forebrain afferents to the hypothalamic paraventricular nucleus following swim stress, in: Journal of Comparative Neurology 368: 88-99. |
Nahezu identische Übernahme ohne Quellennennung. Der Verf. variiert lediglich die Auswahl der Quellenangaben. Der ausgelassene vorletzte Satz stammt aus der Quelle Engelmann (2000) und findet sich in Fragment 103 25. |
| [74.] Mek/Fragment 103 25 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 103, Zeilen: 25-29 |
Quelle: Engelmann 2000 Seite(n): 051, Zeilen: 24-28 |
|---|---|
| So führt auch die Erhöhung der AVP-Konzentration im Medium von Hypothalamuspräparaten zu einer Verstärkung der spontanen GABAA-Rezeptor-vermittelten, inhibitorischen postsynaptischen Ströme parvozellulärer Neurone, wobei dieser Effekt durch AVP-Rezeptorantagonisten gehemmt werden kann (Hermes et al., 1996b).
Hermes, M.L.H.J., Spanswick, D., Renaud, L.P. & Buijs, R.M. (1996b) Inhibitory action of vasopressin on neurons of the rat hpothalamic [sic] paraventricular nucleus. Abstr. Soc. Neurosci., 22, 807,816 [sic]. |
In diesem Zusammenhang sollte erwähnt werden, daß die Erhöhung der AVP-Konzentration im Medium von Hypothalamuspräparaten die Frequenz der spontanen GABAA-rezeptorvermittelten, inhibitorischen postsynaptischen Ströme parvozellulärer Neuronen [sic] des PVN verstärkt; ein Effekt, der durch selektive AVP-Rezeptorantagonisten hemmbar ist (Hermes et al., 1996b).
Hermes, M.L.H.J., Spanswick, D., Renaud, L.P., Buijs, R.M. (1996b). Inhibitory action of vasopressin on neurons of the rat hypothalamic paraventricular nucleus. Abstr. Soc. Neurosci. 22, 807.16. |
Kein Hinweis auf die eigentliche Quelle, die in der gesamten Arbeit nirgends genannt ist. Man beachte auch, dass der Verfasser bei der Literaturangabe analog zu seiner Vorlage den Namen der Zeitschrift nicht ausschreibt, was er sonst in aller Regel getan hat. Das Fragment befindet sich in der Auslassung von Fragment 103 01 (das aus Schindele (2003) übernommen ist). |
| [75.] Mek/Fragment 104 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 104, Zeilen: 01 ff. (komplett) |
Quelle: Schindele 2003 Seite(n): 078, Zeilen: 03-27 |
|---|---|
| Sowohl auf den magnozellulären Neuronen (Magnusson & Meyerson, 1993; Fenelon & Herbison, 1995; Fenelon et al., 1995) als auch auf den parvozellulären Neuronen (Plotsky et al., 1987; Calogero et al. , 1988; Hillhouse & Milton, 1989; Tsagarakis et al., 1990) des PVN sind GABAA-Rezeptoren nachgewiesen, über die Alprazolam und Temazepam wirken können:
1. Alprazolam und Temazepam steigern indirekt über GABAA-Rezeptoren die Intra-PVN-Freisetzung von AVP aus den Dendriten und den Somata der magnozellulären Zellen (Pow & Morris, 1989). Dies kann man mit der Existenz von gabaergen, perinukleären Interneuronen mit GABAA-Autorezeptoren mit Benzodiazepin-Bindungsstellen erklären. Das vermehrt freigesetzte Intra-PVN-AVP hemmt in der Folge über den oben beschriebenen Mechanismus über gabaerge perinukleäre Neurone die Freisetzung von CRH und / oder AVP aus den parvozellulären Neuronen des PVN am GABAA-Rezeptor. Die axonale Sekretion von AVP aus der Neurohypophyse wird dabei unbeeinflusst gelassen (Wotjak et al., 1998) oder sogar gehemmt (Wible et al., 1985a; b; Magnusson & Meyerson, 1993). 2. Alprazolam und Temazepam hemmen möglicherweise auch direkt über GABAA-Rezeptoren die Freisetzung von CRH und / oder AVP von den parvozellulären Neuronen des PVN in der Eminentia mediana der Hypophyse. Die GABAA-Rezeptoren sind postsynaptisch lokalisiert und bewirken eine Hemmung des postsynaptischen Neurons. In beiden Fällen wird die Sekretion von ACTH an der Adenohypophyse in das periphere Blut des Systemkreislaufes gehemmt (vgl. Abb. 22). Magnusson, AM . & Meyerson, B.J. (1993) GABAa antagonist muscimol inhibits stimulated vasopressin release in the posterior pituitary of Sprague- Dawley, Wistar, Wistar- Kyoto and spontaneously hypertensive rats. Neuroendocrinology, 58, 519-524. Fenelon, V.S. & Herbison, A.E. (1995) Characterization of GABAa receptor subunit expression by magnocellular neurones in rat hypothalamus. Molecular Brain Research, 34, 45-56. Fenelon, V.S., Sieghart, W. & Herbison, A.E. (1995) Cellular localization and differential distribution of GABAa receptor subunit proteins and messenger RNAs within hypothalamic magnocellular neurons. Neuroscience, 64, 1129-1143. Plotsky, P.M., Otto, S. & Sutton, S. (1987) Neurotransmittermodulation of CRF secretion into the hypophysial- portal circulation. Life Sciences, 41 , 1311-1317. Calogero, A.E., Gallucci, W.T., Chrousos, G.P. & Gold, P.W. (1988) Interaction between GABAergic neurotransmission and rat hypothalamic CRH secretion in vitro. Brain Research, 463, 28-36. Hillhouse, E.W. & Milton, N.G.N. (1989) Effects of noradrenaline and GABA on the secretion of CRF 41 and arginine vasopressine from the rat hypothalamus in vitro. Journal of Endocrinology, 122, 719-723. Tsagarakis, S., Rees, L.H ., Besser, G.M. & Grossman, A.B. (1990) GABA modulation of CRF-41 secretion from the rat hypothalamus in vitro. Journal of Neuroendocrinology, 2, 221-224. Pow, D.V. & Morris, J.F. (1989) Dendrites of hypothalamic magnocellular neurons release neurohypophysial peptides by exocytosis. Neuroscience, 32, 435-439. Wotjak, C.T., Ganster, J., Kohl, G., Holsboer, F., Landgraf, R. & Engelmann, M. (1998) Dissociated central and peripheral release of vasopressin, but not oxytocin, in response to repeated swim stress: new insights into the secretory capacities of peptidergic neurons. Neuroscience, 85, 1209- 1222. Wible, J.H., Zerbe, R.L. & Dimicco, J.A. (1985a) Stimulation of vasopressin release by GABA antagonists in spinal cord transected rats. The Journal of Pharmacology and Experimental Therapeutics, 234, 378-385. Wible, J.H., Zerbe, R.L. & Dimicco, J.A. (1985b) Benzodiazepine receptors modulate circulating plasma vasopressin concentration. Brain Research, 359, 368-370. Magnusson, A.M. & Meyerson, B.J. (1993) GABAa antagonist muscimol inhibits stimulated vasopressin release in the posterior pituitary of Sprague- Dawley, Wistar, Wistar- Kyoto and spontaneously hypertensive rats. Neuroendocrinology, 58, 519-524. |
Sowohl auf den magnozellulären Neuronen (Fenelon et al., 1995a; Magnusson & Meyerson, 1993) als auch auf den parvozellulären Neuronen (Calogero et al., 1988b; Hillhouse & Milton, 1989; Olschowka, 1987; Plotsky et al., 1987a; Tsagarakis et al., 1990) des PVN sind GABAA-Rezeptoren nachgewiesen, über die Alprazolam und Temazepam wirken können:
1. Alprazolam und Temazepam steigern indirekt über GABAA-Rezeptoren die Intra-PVN-Freisetzung von AVP aus den Dendriten und den Somata der magnozellulären Zellen (Nordmann & Dayanithi, 1988; Pow & Morris, 1989). Dies kann man mit der Existenz von GABAergen, perinukleären Interneuronen mit GABAA-Autorezeptoren mit Benzodiazepin-Bindungsstellen erklären. Alprazolam und Temazepam bewirken über diesen GABAA-Autorezeptor eine Hemmung des perinukleären hemmenden GABAergen Interneurons, d.h. das magnozelluläre AVP-Neuron wird letztlich enthemmt. Das vermehrt freigesetzte Intra-PVN-AVP hemmt in der Folge: über den oben beschriebenen Mechanismus über GABAerge perinukleäre Neurone mit V1a-Rezeptoren die Freisetzung von CRH und / oder AVP aus den parvozellulären Neuronen des PVN am GABAA-Rezeptor. Die axonale Sekretion von AVP aus der Neurohypophyse wird dabei unbeeinflusst gelassen (Wotjak et al., 1998; Engelmann et al., 1998a) oder sogar gehemmt (vgl. Wirkung von GABA: Bisset & Chowdrey, 1980; Magnusson & Meyerson, 1993; Unger et al., 1983; Wible et al., 1985a und b). Es besteht außerdem die Möglichkeit, dass AVP aus magnozellulären Neuronen direkt an parvozellulären Neuronen des PVN wirkt. 2. Alprazolam und Temazepam hemmen direkt über die GABAA-Rezeptoren die Freisetzung von CRH und / oder AVP von den parvozellulären Neuronen des PVN in der Eminentia mediana der Hypophyse. (Alprazolam mindert eher die CRH-Freisetzung, Temazepam die Sekretion von AVP.) In beiden Fällen wird die Sekretion von ACTH an der Adenohypophyse in das periphere Blut des Systemkreislaufes gehemmt. Fenelon V S, Sieghart W und Herbison A E (1995a) Cellular localization and differential distribution of GABAA receptor subunit proteins and messenger RNAs within hypothalamic magnocellular neurons, in: Neuroscience 64: 1129-1143. Magnusson A M und Meyerson B J (1993) GABA-A agonist muscimol Inhibits stimulated vasopressin release in the posterior pituitary of sprague-dawley, wistar, wistar-Kyoto and spontaneously hypertensive rats, in: Neuroendocrinology 58. 519-524. Calogero A E, Gallucci W T, Chrousos G P und Gold P W (1988b) Interaction between GABAergic neurotransmission and rat hypothalamic corticotropin-releasing hormone secretion in vitro, in: Brain Research 463: 28-36. Hillhouse E W und Milton N G N (1989) Effect of noradrenaline and y-aminobutyric acid on the secretion of corticotrophin-releasing factor-41 and arginine vasopressin from the rat hypothalamus in vitro, in: Journal of Endocrinology 122: 719-723. Olschowka J A (1987) GABAergic innervation of corticotropin releasing factor neurons in the rat paraventricular nucleus. An electron microscopic immunocytochemical study, in: Society for Neuroscience. Abstracts 13 (460.15): 1656. Tsagarakis S, Rees L H, Besser G M und Grossman A (1990) Gamma-aminobutyric acid modulation of corticotrophin-releasing factor-41 secretion from the rat hypothalamus in vitro, in: Journal of Neuroendocrinology 2: 221-224. Nordmann J J und Dayanithi G (1988) Release of neuropeptides does not only occur at nerve terminals, in: Bioscience Reports 8: 471-483. Pow D V und Morris J F (1989) Dendrites of hypothalamic magnocellular neurons release neurohypophysial peptides by exocytosis, in: Neuroscience 32: 435-439. Wotjak C T, Ganster J, Kohl G, Holsboer F, Landgraf R und Engelmann M (1998) Dissociated central and peripheral release of vasopressin, but not oxytocin, in response to repeated swim stress. New insights into the secretory capacities of peptidergic neurons, in: Neuroscience 85: 1209-1222. Engelmann M, Wotjak C T und Landgraf R (1998a) Differential central and peripheral release of vasopressin and oxytocin in response to swim stress in rats, in: Zingg (Hrsg.), Vasopressin and Oxytocin, Plenum Press, New York: 175-177. Bisset G W und Chowdrey H S (1980) Central inhibition by GABA ofthe release of vasopressin by carbachol in the rat, in: British Journal of Pharmacology 70: 78P. Unger T, Bles F Ganten D, Lang R E, Rettig R und Schwab N A (1983) GABAergic stimulation inhibits central actions of angiotensin II. Pressor responses, drinking and release of vasopressin, in: European Journal of Pharmacology 90: 1-9. Wible, Jr. J H, Zerbe R L und DiMicco J A (1985a) Benzodiazepine receptors modulate circulating plasma vasopressin concentration, in: Brain Research 359: 368-370. Wible J H, Zerbe R L und DiMicco J A (1985b) Stimulation of vasopressin release by y-aminobutyric acid antagonists in spinal cord transected rats, in: Journal of Pharmacology and Experimental Therapeutics 234: 378-385. |
Nahezu wörtliche übernahme ohne Nennung der eigentlichen Quelle. |
| [76.] Mek/Fragment 105 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 105, Zeilen: Abb. 22 |
Quelle: Schindele 2003 Seite(n): 079, Zeilen: Abb. 4.2 |
|---|---|
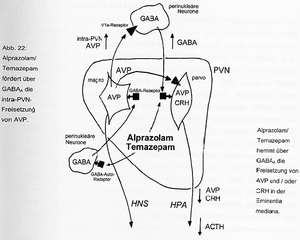
|

|
Kein Hinweis auf die Quelle. |
| [77.] Mek/Fragment 121 09 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 121, Zeilen: 09-24 |
Quelle: Erhardt 2003 Seite(n): 023, 044, Zeilen: 023:03-16; 044:02-05 |
|---|---|
| Das verwendete Morphinhydrochlorid (Merck, Darmstadt) wurde in 0,9%iger Kochsalzlösung gelöst. Die Injektionsdosis wurde täglich dem Tiergewicht angepasst. Das Injektionsschema entsprach dem Sensitivierungsschema von Acquas und Di Chiara (Acquas & Di Chiara, 1992). Die subkutanen Injektionen fanden zweimal täglich jeweils um 7:00 und 19:00 Uhr über sieben Tage statt. Die letzte Injektion wurde am 8. Tag morgens verabreicht, damit während der anschließenden Mikrodialyse-Operation keine Entzugszeichen provoziert wurden. Injektionsschema für Morphinhydrochlorid über sieben Tage:
Tag 1: 5 mg/kg, Tag 2-4: 10mg/kg, Tag 5-7: 15mg/kg; Tag 8: 10mg/kg. Kontrollgruppe: gleiches Behandlungsschema wie bei Morphinhydrochlorid unter Verwendung von 0,9%iger Kochsalzlösung (Vehikel). 5.2.1.2 Wirkung auf die Freisetzung von Monoaminen Die Voraussetzungen für den Einschluss der Experimentaltiere in die statistische Auswertung waren 1.) korrekte Lage der Mikrodialysesonde im analysierten Gehirnbereich und 2.) keine sichtbaren pathologischen Prozesse an der Sonde oder an der Hirnsubstanz bei der postmortalen Inspektion. Acquas, E. & Di Chiara, G. (1992) Depression of mesolimbic dopamine transmission and sensitization to morphine during opiate abstinence. Journal of Neurochemistry, 58, 1620-1625. |
[Seite 023]
Das verwendete Morphin-Hydrochlorid (Merck, Darmstadt) wurde in 0,9%iger Kochsalzlösung aufgelöst. Die Injektionsdosis (s.u.) wurde täglich dem Tiergewicht angepasst. Das Injektionsschema entsprach dem Sensibilisierungsschema von Acquas und Di Chiara (1992). Die subkutanen Injektionen fanden zweimal täglich jeweils um 7.00 und 19.00 über 7 Tage statt. Die letzte Injektion wurde am 8. Tag morgens verabreicht, damit während der anschließenden Mikrodialyse-Operation keine Entzugszeichen provoziert wurden. Injektionsschema für Morphinhydrochlorid über 7 Tage: Tag 1 5 mg/kg KG Tag 2-4 10mg/kg KG Tag 5-7 15mg/kg KG Tag 8 10mg/kg KG Kontrollgruppe: gleiches Vorbehandlungsschema wie bei Morphinhydrochlorid unter Verwendung von 0,9%iger Kochsalzlösung (Vehikel). [Seite 044] Die Voraussetzungen für den Einschluss der Experimenttiere in die statistische Auswertung waren 1.) korrekte Lage der Mikrodialysesonde im analysierten Gehirnbereich und 2.) keine sichtbaren pathologischen Prozesse an der Sonde oder an der Hirnsubstanz bei der postmortalen Inspektion. Acquas, E. und G. Di Chiara (1992). "Depression of mesolimbic dopamine transmission and sensitization to morphine during opiate abstinence." Journal of Neurochemistry 58(5): 1620-5. |
Diese Kopie wurde schonmal auf Seite 37 ohne Quellangabe verwendet. |
| [78.] Mek/Fragment 122 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 122, Zeilen: 01 ff. (komplett) |
Quelle: Erhardt 2003 Seite(n): 044-045, Zeilen: 044:06-11; 045:01-06 |
|---|---|
| 5.2.1.2.1 Intrazerebrale Dopaminfreisetzung nach akuter rTMS bei anästhesierten Ratten
Abbildung 30 zeigt eine zusammenfassende Darstellung der Gesamteffekte vor und nach rTMS resultierend aus Mikrodialyse-Ergebnissen bei anästhesierten Ratten. Zusätzlich sind exemplarisch histologische Abbildungen der untersuchten Hirnregionen dargestellt. Abb. 30: Darstellung der maximalen prozentualen Freisetzung von Dopamin im Hippocampus, Nucleus acumbens septi und Striatum nach rTMS (20 Hz). Koronare Rattenhirnschnitte (Nissl- Färbung) mit Nachweis der stereotaktisch implantierten Mikrodialysesonden. *P<0,05 vs. rTMS. |
[Seite 044]
3.1 Experiment 1: intrazerebrale Dopaminfreisetzung nach akuter rTMS bei anästhesierten Ratten Abbildung 3.1 zeigt eine zusammenfassende Darstellung der Gesamteffekte vor und nach rTMS resultierend aus Mikrodialyse-Ergebnissen bei anästhesierten Ratten. Zusätzlich sind exemplarisch histologische Abbildungen der untersuchten Hirnregionen dargestellt. [Seite 045] Abbildung 3.1: Darstellung der maximalen prozentualen Freisetzung von Dopamin im Hippokampus, Striatum und Nucleus accumbens nach rTMS (20Hz). [...] Koronare Rattenhirnschnitte (Nissl- Färbung) mit Nachweis der stereotaktisch implantierten Mikrodialysesonde (Pfeil) in der entsprechenden Hirnregion. * P<0,05. |
Die Quelle wird nicht genannt. Die einzelnen Elemente der Grafik sind leicht verschoben, die Richtung der Pfeile wird umgekehrt. Kann alternativ auch als Verschleierung gewertet werden. |
| [79.] Mek/Fragment 123 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 123, Zeilen: 01-15, 18-31 |
Quelle: Erhardt 2003 Seite(n): 044,046-047, Zeilen: 044:12-26; 046:06-15; 047:06-09 |
|---|---|
| Intrahippocampale Dopaminfreisetzung
Die Auswertung der Mikrodialysate ergab einen signifikanten Anstieg der Dopaminkonzentration nach rTMS-Applikation (n=7). Die gemessenen Ausgangsdopaminwerte vor Stimulation (basal 1 und 2: 0,029±0,01 pmol/Probe) waren in beiden Behandlungsgruppen, rTMS und sham, vergleichbar (Abb. 31). Im Gegensatz zu scheinstimulierten Wistar-Ratten (n=6), zeigt sich nach rTMS-Anwendung ein signifikanter intrahippocampaler Dopaminanstieg während des vierten und fünften Mikrodialyseintervalls. Die statistische Auswertung mittels Zweiweg-ANOVA bestätigte einen signifikanten Effekt auf die Dopaminfreisetzung zwischen den unterschiedlich behandelten Gruppen (F7,77>=35,57; P<0,05). Im Vergleich zu intraaccumbalen und intrastriatalen Messwerten (Abb. 31), kam es im Hippocampus zum prompten Dopaminanstieg mit einem Maximum nach 90 Minuten. Unter den drei ausgewählten Strukturen des mesolimbischen Systems konnte somit im dorsalen Hippocampus der höchste Dopaminanstieg gemessen werden (max, 220 % des Basalwertes). [...] Intraaccumbale Dopaminfreisetzung Die Mikrodialyseauswertung zeigte einen signifikanten Dopaminanstieg nach rTMS-Behandlung (n=7). Die Ausgangsdopaminwerte waren in beiden Gruppen vergleichbar (basal 1 und 2; 0.025±0,003 pmol/Probe). Im Gegensatz zu scheinstimulierten Wistar-Ratten (n=6) zeigte sich nach rTMS-Anwendung ein signifikanter intraaccumbaler Dopaminanstieg während des sechsten, siebten und achten Mikrodialyseintervalls. Die statistische Auswertung mittels Zweiweg-ANOVA bestätigte einen signifikanten Effekt auf die Dopaminfreisetzung zwischen den unterschiedlich behandelten Gruppen (F7,77>=17,46; P<0,01). Zusätzlich zeigte sich eine signifikante Interaktion mit dem Faktor Zeit (F7,77>=4,47; P<0,01). Intrastriatale Dopaminfreisetzung Die Auswertung der Mikrodialysate ergab einen signifikanten Anstieg der Dopaminkonzentrationen nach rTMS-Applikation (n=6). Die gemessenen Ausgangsdopaminwerte vor der Stimulation (basal 1 und 2: 0,059±0,01 pmol/Probe) [waren in beiden Behandlungsgruppen, rTMS und sham, vergleichbar (Abb. 31).] |
[Seite 044]
3.1.1 Intrahippokampale Dopaminfreisetzung Die Auswertung der Mikrodialysate ergab einen signifikanten Anstieg der Dopaminkonzentration nach rTMS-Applikation (n=7). Die gemessenen Ausgangsdopaminwerte vor Stimulation (basal 1 und 2: 0,029 ± 0,01 pmol/Probe) waren in beiden Behandlungsgruppen, rTMS und sham, vergleichbar (Abb. 3.2). Im Gegensatz zu scheinstimulierten Wistar-Ratten (n=6), zeigt sich nach rTMS-Anwendung ein signifikanter intrahippokampaler Dopaminanstieg während dem vierten und fünften Mikrodialyseintervall. Die statistische Auswertung mittels 2-Wege-ANOVA bestätigte einen signifikanten Effekt auf die Dopaminfreisetzung zwischen den unterschiedlich behandelten Gruppen (F7,77> = 35,57; P < 0,05). Im Vergleich zu intraaccumbalen und intrastriatalen Messwerten (Abb. 3.3 bzw. 3.4), kommt es im Hippokampus zum prompten Dopaminanstieg mit dem maximalen Wert nach 90 Minuten. Unter den drei ausgewählten Strukturen des mesolimbischen Systems konnte somit im dorsalen Hippokampus der höchste Dopaminanstieg gemessen werden (max. 220 % des Basalwertes [Seite 046] 3.1.2 Intraaccumbale Dopaminfreisetzung Die Mikrodialyseauswertung zeigte einen signifikanten Dopaminanstieg nach rTMS-Behandlung (n=7). Die Ausgangsdopaminwerte waren vergleichbar in beiden Gruppen (basal 1 und 2: 0.025 ± 0,003 pmol/Probe). Im Gegensatz zu scheinstimulierten Wistar-Ratten (n=6) zeigt sich nach rTMS-Anwendung ein signifikanter intraaccumbaler Dopaminanstieg während dem sechsten, siebten und achten Mikrodialyseintervall. Die statistische Auswertung mittels 2-Wege-ANOVA bestätigte einen signifikanten Effekt auf die Dopaminfreisetzung zwischen den unterschiedlich behandelten Gruppen (F7,77> = 17,46; P < 0,01). Zusätzlich zeigte sich eine signifikante Interaktion mit dem Faktor Zeit (F7,77>=4,47; P < 0,01). [Seite 047] 3.1.3 Intrastriatale Dopaminfreisetzung Die Auswertung der Mikrodialysate ergab einen signifikanten Anstieg der Dopaminlevel nach rTMS-Applikation (n=6). Die gemessenen Ausgangsdopaminwerte vor der Stimulation (basal 1 und 2: 0,059 ± 0,01 pmol/Probe) waren in beiden Behandlungsgruppen, rTMS und sham, vergleichbar (Abb. 3.4). |
Aus dem Ergebnisteil - ohne Quellenangabe. Der Verf. fügt einen kurzen (hier ausgelassenen) Satz hinzu. |
| [80.] Mek/Fragment 124 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 124, Zeilen: 01 ff. (komplett) |
Quelle: Erhardt 2003 Seite(n): 046-048, Zeilen: 046:01-05; 047:01-05; 047: 8-16; 048: 01-07 |
|---|---|
| [Die gemessenen Ausgangsdopaminwerte vor der Stimulation (basal 1 und 2: 0,059±0,01 pmol/Probe)] waren in beiden Behandlungsgruppen, rTMS und sham, vergleichbar (Abb. 31). Im p Gegensatz zu scheinstimulierten Wistar-Ratten (n=10), zeigte sich nach rTMS- Anwendung ein signifikanter intrastriataler Dopaminanstieg während des fünften, sechsten, siebten und achten Mikrodialyseintervalls. Die statistische Auswertung mittels Zweiweg-ANOVA bestätigte einen signifikanten Effekt auf die Dopaminfreisetzung zwischen den unterschiedlich behandelten Gruppen (F7,98=11,58; P<0,05) und in Abhängigkeit vom Faktor Zeit (F7,98=2,29; P<0,05). Zusätzlich zeigte sich eine signifikante Interaktion zwischen den Faktoren Gruppe und Zeit (F7,98=5,08; P<0,01).
Abb. 31: Auswirkungen von 20 trains (1000 Stimuli) repetitiver transkranielle Magnetstimulation (rTMS; Kreise) und Scheinstimulation (sham; Quadrate) auf die Dopamin-Freisetzung im (A) dorsalen Hippocampus (rTMS: n=7; sham: n=6), (B) Nucteus accumbens Shell (rTMS: n=7; sham: n=6) und (C) dorsalen Striatum (rTMS: n=6; sham: n=10) Urethan-anästhesierter männlicher Wistar-Ratten. Mittelwerte in Prozent der Basalwerte + SEM. *P<0.05, **P<0.01 vs. Scheinstimulation. #P<0.05, ##P<0.01 vs. basal. |
[Seite 047]
Die gemessenen Ausgangsdopaminwerte vor der Stimulation (basal 1 und 2: 0,059 ± 0,01 pmol/Probe) waren in beiden Behandlungsgruppen, rTMS und sham, vergleichbar (Abb. 3.4). Im Gegensatz zu scheinstimulierten Wistar-Ratten (n=10), zeigt sich nach rTMS- Anwendung ein signifikanter intrastriataler Dopaminanstieg während dem fünften, sechsten, siebten und achten Mikrodialyseintervall. Die statistische Auswertung mittels 2-Wege-ANOVA bestätigte einen signifikanten Effekt auf die Dopaminfreisetzung zwischen den unterschiedlich behandelten Gruppen (F7,98 = 11,58; P < 0,05) und in Abhängigkeit vom Faktor Zeit (F7,98 = 2,29; P < 0,05). [Seite 048] Zusätzlich zeigte sich eine signifikante Interaktion zwischen den Faktoren Gruppe und Zeit (F7,98 = 5,08; P < 0,01). [Zusammengefasste Abbildung aus Seiten 046, 047 und 048] [Seite 046] Abbildung 3.4: Die Auswirkung von rTMS (Kreise) (20Hz, 20 trains, 1000 Stimuli) und der Scheinstimulation (Vierecke) auf Dopamingehalt in 30-minütigen Dialysaten, gesammelt im Striatum (rTMS: n = 6; sham: n = 10) Urethan-anästhesierter, männlicher Wistar-Ratten. Die Werte sind in Prozent, bezogen auf den mittleren Basalwert ± SEM dargestellt. * P < 0,05, P < 0,01 versus Scheinstimulation. # P < 0,05, ## P <0,01 versus basal. |
Die Abbildungen wurden in eine Abbildung zusammengefasst, sind aber in ihrem Verlauf identisch. Kopie ohne Quellenangabe. |
| [81.] Mek/Fragment 125 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 125, Zeilen: 01 ff. (komplett) |
Quelle: Erhardt 2003 Seite(n): 048-050, Zeilen: 048:08-14; 049:01-08; 050:01-12 |
|---|---|
| 5.2.1.2.2 Intrazerebrale Dopaminfreisetzung nach akuter rTMS bei wachen Ratten
Intrahippocampale Dopaminfreisetzung Es zeigte sich ein signifikanter Anstieg von Dopamin nach rTMS (n=6). Der Ausgangsmittelwert von Dopamin in den Mikrodialysaten vor Stimulation (basal 1 und 2: 0,04±0,001 pmol/Probe) war sowohl bei den rTMS-behandelten Tieren als auch bei sham-Tieren vergleichbar (Abb. 32). Im Gegensatz zu scheinstimulierten Tieren (n=5), zeigte sich bei rTMS-behandelten Wistar-Ratten ein signifikanter intrahippocampaler Dopaminanstieg während des fünften, sechsten, siebten und achten Dialyseintervalls (Abb. 32). Die statistische Auswertung mittels Zweiweg-ANOVA bestätigte einen signifikanten Effekt zwischen den unterschiedlich behandelten Gruppen (F7,63=5,15; P<0,01) und dem Faktor Zeit (F7,63=8,83; P<0,05). Zusätzlich fand sich eine signifikante Interaktion zwischen den Faktoren Gruppe und Zeit (F7,63=5,61 ; P<0,07). Intraaccumbale Freisetzung Der Ausgangsmittelwert von Dopamin in den Mikrodialysaten vor Stimulation (basal 1 und 2: 0,03+0,009 pmol/Probe) war sowohl bei rTMS-behandelten Tieren (n=8) als auch bei sham-Tieren (n=6) vergleichbar (Abb. 32). Im Gegensatz zu scheinstimulierten Tieren zeigte sich bei rTMS-behandelten Wistar-Ratten ein signifikanter intraaccumbaler Dopaminanstieg nach dem dritten, vierten, fünften, sechsten, siebten und achten Dialyseintervall (Abb. 32). Die statistische Auswertung mittels Zweiweg-ANOVA bestätigte einen signifikanten Effekt zwischen den unterschiedlich behandelten Gruppen (F7,84=53,93; P<0,05). Zusätzlich fand sich eine signifikante Interaktion zwischen den Faktoren Gruppe und Zeit (F7,84=2,67; P<0,05). |
[Seite 048]
3.2 Experiment 2: intrazerebrale Dopaminfreisetzung nach akuter rTMS bei wachen Ratten 3.2.1 Intrahippokampale Dopaminfreisetzunq Die Bestimmung mit Hilfe der Mikrodialyse zeigte einen signifikanten Anstieg von Dopamin nach rTMS (n=6). Der Ausgangsmittelwert von Dopamin in den Mikrodialysaten vor der Stimulation (basal 1 und 2: 0,04 ± 0,001 pmol/Probe) war sowohl bei den rTMS-behandelten Tieren als auch bei den sham-Tieren vergleichbar [Seite 049] (Abb.3.5). Im Gegensatz zu den scheinstimulierten Tieren (n=5) zeigte sich bei den rTMS-behandelten Wistar-Ratten ein signifikanter intrahippokampaler Dopaminanstieg während dem fünften, sechsten, siebten und achten Dialyseintervall (Abb.3.5). Die statistische Auswertung mittels 2-Wege-ANOVA bestätigte einen signifikanten Effekt zwischen den unterschiedlich behandelten Gruppen (F7,63 = 5,15; P < 0,01) und dem Faktor Zeit (F7,63 = 8,83; P < 0,05). Zusätzlich fand sich eine signifikante Interaktion zwischen dem Faktor Gruppe und dem Faktor Zeit (F7,63 = 5,61; P < 0,07). [Seite 050] 3.2.2 Intraaccumbale Freisetzung Die Bestimmung mit Hilfe der Mikrodialyse zeigte einen signifikanten Anstieg von Dopamin nach rTMS (n=8). Der Ausgangsmittelwert von Dopamin in den Mikrodialysaten vor der Stimulation (basal 1 und 2: 0,03 ± 0,009 pmol/Probe) war sowohl bei den rTMS behandelten Tieren als auch bei den sham-Tieren vergleichbar (Abb.3.6). Im Gegensatz zu den scheinstimulierten Tieren (n=6), zeigte sich bei den rTMS-behandelten Wistar-Ratten ein signifikanter intraaccumbaler Dopaminanstieg nach dem dritten, vierten, fünften, sechsten, siebten und achten Dialyseintervall (Abb. 3.6). Die statistische Auswertung mittels 2-Wege-ANOVA bestätigte einen signifikanten Effekt zwischen den unterschiedlich behandelten Gruppen (F7,84 = 53,93; P < 0,05). Zusätzlich fand sich eine signifikante Interaktion zwischen dem Faktor Gruppe und Faktor Zeit (F7,84 = 2,67; P < 0,05). |
Keine Quellenangabe. |
| [82.] Mek/Fragment 126 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 126, Zeilen: 01-12 |
Quelle: Erhardt 2003 Seite(n): 049-051, Zeilen: 049:09-11; 050:13-17; 051:01-11 |
|---|---|
Abb. 32: Auswirkungen von 6 trains (300 Stimuli) repetitiver transkranielle Magnetstimulation (rTMS; Kreise) und Scheinstimulation (sham; Quadrate) auf die Dopamin-Freisetzung im (A) dorsalen Hippocampus (rTMS: n=6; sham: n=5) und im (B) Nucleus accumbens Shell (rTMS: n=8; sham: n=6) wacher männlicher Wistar-Ratten. Mittelwerte in Prozent der Basalwerte ± SEM. *P<0.05, **P<0.01 vs. Scheinstimulation. #P<0.05, ##P<0.01 vs. basal. 5.2.1.2.3 Intraaccumbale Dopaminfreisetzung nach akuter rTMS bei morphinvorbehandelten, wachen Tieren im Nucleus accumbens Shell Die Bestimmung der Dopaminfreisetzung im Nucleus accumbens shell mit Hilfe der Mikrodialyse zeigte einen signifikanten Anstieg von Dopamin nach rTMS (n=8). Die Basalwerte der morphinvorbehandelten und nicht-morphinvorbehandelten (Kontrollen) Sprague-Dawley-Ratten unterschieden sich nicht signifikant. Der Ausgangsmittelwert von Dopamin in den Mikrodialysaten vor Stimulation (basal 1 und [2: Morphin/rTMS: 1,61±0,07 pmol/Probe; Morphin/sham: 1,74±0,14 pmol/Probe; Kontrolle/rTMS: 1,68±0,11 pmol/Probe) war sowohl bei mit rTMS behandelten Tieren als auch bei sham-Tieren in den unterschiedlich vorbehandelten Gruppen vergleichbar (Abb. 33).] |
[Zusammengefasste Abbildung Seite 049 und 050]
[Seite 049] [Seite 049] Abbildung 3.5.: Die Auswirkung von rTMS (Kreise) (20Hz, 6 trains, 300 Stimuli) und der Scheinstimulation (Vierecke) auf den Dopamingehalt in 30-minütigen Dialysaten, gesammelt im Hippokampus (rTMS: n = 6, sham: n = 5) wacher, männlicher Wistar-Ratten Die Werte sind dargestellt in Prozent in Bezug auf den mittleren Basalwert ± SEM. * P < 0,05, ** P < 0,01 versus Scheinstimulation. ff P < 0,05, ff# P <0,01 versus basal. [Seite 051] 3.3 Experiment 3: intraaccumbale Dopaminfreisetzung nach akuter rTMS bei morphinvorbehandelten Tieren Die Bestimmung der Dopaminfreisetzung im Nucleus accumbens shell mit Hilfe der Mikrodialyse zeigte einen signifikanten Anstieg von Dopamin nach rTMS (n = 8). Die Basalwerte der morphinvorbehandelten und nicht-morphinvorbehandelten (Kontrollen) Sprague-Dawley-Ratten unterschieden sich nicht signifikant. Der Ausgangsmittelwert von Dopamin in den Mikrodialysaten vor der Stimulation (basal 1 und 2: Morphin/rTMS: 1,61 ± 0,07 pmol/Probe; Morphin/sham: 1,74 ± 0,14 pmol/Probe; Kontrolle/rTMS: 1,68 ± 0,11 pmol/Probe) war sowohl bei den mit rTMS behandelten Tieren als auch bei den sham-Tieren in den unterschiedlich vorbehandelten Gruppen vergleichbar (Abb. 3.7). |
Auch diese Übernahmen aus dem Analyseteil der Arbeit sind nicht gekennzeichnet. |
| [83.] Mek/Fragment 127 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 127, Zeilen: 01 ff. (komplett) |
Quelle: Erhardt 2003 Seite(n): 051-054, Zeilen: 051:06-11; 052:01-09; 053:01-07; 054:01-05 |
|---|---|
| [Der Ausgangsmittelwert von Dopamin in den Mikrodialysaten vor Stimulation (basal 1 und] 2: Morphin/rTMS: 1,61±0,07 pmol/Probe; Morphin/sham: 1,74±0,14 pmol/Probe; Kontrolle/rTMS: 1,68±0,11 pmol/Probe) war sowohl bei mit rTMS behandelten Tieren als auch bei sham-Tieren in den unterschiedlich vorbehandelten Gruppen vergleichbar (Abb. 33).
Die statistische Auswertung mittels Zweiweg-ANOVA bestätigte einen signifikanten Effekt zwischen den unterschiedlich behandelten Gruppen (F2,20=9,31; P<0,01) und dem Faktor Zeit (F7,140=10,72; P<0,01). Zusätzlich fand sich eine signifikante Interaktion zwischen dem Faktor Gruppe und dem Faktor Zeit (F14,140=3,58; P<0,01). Im Gegensatz zu scheinstimulierten morphinvorbehandelten Tieren (n=7), zeigte sich bei den rTMS-behandelten morphininjizierten Ratten ein signifikanter intraaccumbaler Dopaminanstieg während des dritten, vierten, fünften und sechsten Dialyseintervalls(Abb. 33). Die Dopaminfreisetzung nach rTMS-Behandlung in der morphinvorbehandelten Gruppe (n=8) war im Vergleich zur Kontrollgruppe (n = 8) signifikant höher während des dritten und fünften Dialyseintervalls (Abb. 33). Damit kann ein signifikanter Sensitivierungseffekt auf die Dopaminfreisetzung im Nucleus accumbens nach Morphinvorbehandlung gezeigt werden. (Zweiweg-ANOVA: Faktor Gruppen (F2,20-9,31; P<0,01), Faktor Zeit (F7,140=10,72; P<0,01), Faktor Gruppe x Zeit (F14,140=3,58; P<0,01), post hoc LSD-Test). Im Gegensatz zu morphinbehandelten scheinstimulierten Tieren (n=7) zeigte sich bei den rTMS-behandelten Kontrolltieren (n=8) ein signifikanter Dopaminanstieg im Nucleus accumbens Shell während des dritten Dialyseintervalls. (Zweiweg-ANOVA; Faktor Gruppen (F2,20 = 9,31; P < 0,01), Faktor Zeit (F7,140 = 10,72; P < 0,01), Faktor Gruppe x Zeit (F14,140 = 3,58; P < 0,01), Post-hoc LSD-Test). |
[Seite 051]
Der Ausgangsmittelwert von Dopamin in den Mikrodialysaten vor der Stimulation (basal 1 und 2: Morphin/rTMS: 1,61 ± 0,07 pmol/Probe; Morphin/sham: 1,74 ± 0,14 pmol/Probe; Kontrolle/rTMS: 1,68 ± 0,11 pmol/Probe) war sowohl bei den mit rTMS behandelten Tieren als auch bei den sham-Tieren in den unterschiedlich vorbehandelten Gruppen vergleichbar (Abb. 3.7). [Seite 052] Die statistische Auswertung mittels 2-Wege-ANOVA bestätigte einen signifikanten Effekt zwischen den unterschiedlich behandelten Gruppen (F2,20 = 9,31; P < 0,01) und dem Faktor Zeit (F7,140 = 10,72; P < 0,01). Zusätzlich fand sich eine signifikante Interaktion zwischen dem Faktor Gruppe und dem Faktor Zeit (F14,140 = 3,58; P <0,01). Im Gegensatz zu den scheinstimulierten morphinvorbehandelten Tieren (n = 7), zeigte sich bei den rTMS-behandelten morphininjizierten Ratten ein signifikanter intraaccumbaler Dopaminanstieg während dem dritten, vierten, fünften und sechsten Dialyseintervall (Abb.3.8). [Seite 053] Die Dopaminfreisetzung nach der rTMS-Behandlung in der morphinvorbehandelten Gruppe (n = 8) war im Vergleich zur Kontrollgruppe (n = 8) signifikant höher während dem dritten und fünften Dialyseintervall (Abb. 3.9). Damit kann ein signifikanter Sensitivierungseffekt auf die Dopaminfreisetzung im Nucleus accumbens nach Morphinvorbehandlung gezeigt werden. (2-Wege-ANOVA: Faktor Gruppen (F2,20 = 9,31; P < 0,01), Faktor Zeit (F7,140 = 10,72; P < 0,01), Faktor Gruppe x Zeit (F14,140 = 3,58; P < 0,01), Post-hoc LSD-Test). [Seite 054] Im Gegensatz zu morphinbehandelten scheinstimulierten Tieren (n-7) zeigte sich bei den rTMS-behandelten Kontrolltieren (n=8) ein signifikanter Dopaminanstieg im Nucleus accumbens Shell während dem dritten Dialyseintervall. (2-Wege-ANOVA: Faktor Gruppen (F2,20 = 9,31; P < 0,01), Faktor Zeit (F7,140 = 10,72; P < 0,01), Faktor Gruppe x Zeit (F14,140= 3,58; P < 0,01), Post-hoc LSD-Test). |
Die Daten und Texte wurden aus mehreren Seiten der Vorlage kopiert und ohne Quellenangabe auf der vorliegenden Seite zusammengetragen. |
| [84.] Mek/Fragment 128 01 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 128, Zeilen: 01-07 |
Quelle: Erhardt 2003 Seite(n): 051, Zeilen: 13-17 |
|---|---|

Abb. 33: Auswirkung von rTMS (20Hz, 6 trains, 300 Stimuli) bei morphinvorbehandelten, wachen Sprague Dawley-Ratten (Rauten, Morphin/rTMS) und vehikelbehandelten Kontroll-Tieren (Dreiecke, Kontrolle/rTMS) im Vergleich zu scheinstimulierten, morphinvorbehandelten (Quadrate, Morphin/sham) Ratten auf den Dopamingehalt in 30-minütigen Dialysaten, gesammelt im Nucleus accumbens Shell (Morphin/rTMS: n = 8; Morphin/sham: n = 7, Kontrolle/rTMS: n = 8). Die Werte sind dargestellt in Prozent der mittleren Basalwerte ± SEM. *P<0,05, **P<0,01 vs. Scheinstimulation. #P<0,05, ##P<0,01 vs. basal. °P<0,05, vs. Kontrolle. |

Abbildung 3.7: Die Auswirkung von rTMS (20Hz, 6 trains, 300 Stimuli) bei morphinvorbehandelten (Rauten, Morphin/rTMS) und bei Kontroll-Tieren (Dreiecke, Kontrolle/rTMS) im Gegensatz zu scheinstimulierten (Quadrate, Morphin/sham) Ratten auf den Dopamingehalt in 30-minütigen Dialysaten, gesammelt im Nucleus accumbens Shell (Morphin/rTMS: n = 8; Morphin/sham: n = 7, Kontrolle/rTMS: n = 8) wacher, männlicher Sprague-Dawley Ratten. Die Werte sind dargestellt in Prozent in Bezug auf den mittleren Basalwert ± SEM. *P < 0,05, **P < 0,01 versus Scheinstimulation. #P < 0,05, ##P < 0,01 versus basal. °P < 0,05, **P < 0,01 versus Kontrolle. |
Darstellung derselben Daten ohne Quellenangabe. |
| [85.] Mek/Fragment 165 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 165, Zeilen: 01 ff. (komplett) |
Quelle: Erhardt 2003 Seite(n): 005-006; 060-061, Zeilen: 005:27-31; 006:04-08; 060:11-30; 061:01-05 |
|---|---|
| Der Schwerpunkt der Untersuchungen monoaminerger Veränderungen bei depressiven Erkrankungen lag lange Zeit vornehmlich auf der noradrenergen und serotonergen Neurotransmission. Problematisch an der ursprünglichen Monoamin-Hypothese der Depression (Schildkraut, 1965) ist die Tatsache, dass jene Transmittersysteme, die eine große Bedeutung für Motivation und Belohnung haben, wie Dopamin- und Opiatsysteme, in dieser Theorie eine lediglich untergeordnete Rolle spielen (Rampello & Nicoletti, 2000). In neurobiologischen Modellvorstellungen zur Anhedonie und Depression wird jedoch ein Zusammenhang mit dem dopaminergen System vermutet (Loas & Boyer, 1996). Das zentrale Symptom der Depression, die negative Stimmung, könnte auf eine Hemmung positiver Verstärkerstrukturen, die Antriebslosigkeit und motorische Inaktivität auf eine Reduktion der Aktivität nigrostriataler Systeme rückführbar sein. Neuro-psychiatrische Erkrankungen, bei denen ebenfalls eine Störung der dopaminergen Transmission nachgewiesen oder zumindest vermutet wird, weisen häufig Stimmungsabweichungen in den negativen Bereich auf: zu nennen sind idiopathisches Parkinson-Syndrom, Schizophrenie und Suchterkrankungen im Stadium der Abstinenz (Loas, 2002). Weiterhin weisen epidemiologische Studien eine Komorbidität von bis zu 60% von idiopathischem Parkinson-Syndrom und Depression nach, wobei die depressive Verstimmung eines der charakteristischen Frühsymptome des idiopathischen Parkinson-Syndroms darstellt (Edwards et al., 2002). Das häufigste gemeinsame und für Patienten äußerst schwer quantifizierbare Symptom ist dabei die Anhedonie. Dieser Stimmungszustand wird als Verlust lustvollen Erlebens und dem Streben nach diesem definiert. Anhedonie wird von den betroffenen Patienten als eine Veränderung des subjektiven Erlebens geschildert, in deren Folge Sinnesreize weniger scharf getrennt und Eindrücke vermehrt negativ besetzt werden (Heinz, 1999). Als zentrale neuroanatomische Struktur bei der Vermittlung von Belohnung und positiven Gefühlen wird hierbei das mesolimbische System mit dem präfrontalen Kortex und Nucleus accumbens angesehen. Dabei scheint insbesondere die mesolimbische dopaminerge Verbindung, die von der Area tegmentalis ventralis zum Nucleus accumbens zieht (sog. A 10-Fasern) und u.a. für Motivation und emotionales Ausdrucksvermögen bedeutend ist, zur Entstehung von affektiven Störungen beizutragen (Klitenick et al., 1992). Das mesolimbische System [unterhält zusätzlich dichte Verbindungen zum präfrontalen Kortex und vice versa (Sesack & Pickel, 1992).]
Schildkraut, J.J. (1965) The catecholamine hypothesis of afective disorders: a review of supportive evidence. American Journal of Psychiatry, 122, 509-522 . Rampello, L. & Nicoletti, F. (2000) Dopamine and depression - therapeutic implications. CNS Drugs, 13, 35-45. Loas, G. & Bayer, P. (1996) Anhedonia in endomorphic depression. Psychiatric Research, 60, 57-65. Loas, G. (2002) Relationships between anhedonia, depression, and schizophrenia. Nerv Ment Dis, 190, 717-718. Edwards, E., Kitt, C., Oliver, E., Finkelstein, J., Wagster, M. & McDonald, W .M. (2002) Depression and Parkinson's disease: a new look at an old problem. Depression and Anxiety, 16, 39-48. Heinz, A. (1999) Anhedonia - a general nosology correlation of a dysfunction of the dopaminergic reward system? Nervenarzt, 70, 391-398. Klitenick, M.A ., Deutch, A.Y., Churchill, L. & Kalivas, P.W. (1992) Topography and functional role of dopaminergic projections from the ventral mesencephalic tegmentum to the ventral pallidum. Neuroscience, 50. |
[Seite 005]
Dabei scheint insbesondere die mesolimbische dopaminerge Verbindung, die von der Area tegmentalis ventralis zum Nucleus accumbens zieht (sog. A 10-Fasern, vgl. Abb. 1.2) und u.a. für Motivation und emotionales Ausdrucksvermögen bedeutend ist, zur Entstehung von affektiven Störungen beizutragen (Klitenick et al. 1992). [Seite 006] Epidemiologische Studien weisen eine Komorbidität von bis zu 60% von Parkinson und Depression nach und die depressive Verstimmung stellt eines der charakteristischen Frühsymptome beim idiopathischen Parkinson-Syndrom dar (Berlit 1999). Das mesolimbische System unterhält zusätzlich dichte Verbindungen zum präfrontalen Kortex (Abb. 1.2). [Seite 060] Der Schwerpunkt der Untersuchungen monoaminerger Veränderungen bei depressiven Erkrankungen lag lange Zeit v.a. auf der noradrenergen und serotonergen Transmission. Problematisch an der ursprünglichen Monoamin- Hypothese der Depression (Schildkraut 1965) ist die Tatsache, dass jene Transmittersysteme, die eine grosse Bedeutung für die Motivation und Belohnung haben, wie Dopamin- und Opiatsysteme, in dieser Theorie eine lediglich untergeordnete Rolle spielen (Rampello 2000). Das zentrale Symptom der Depression, die negative Stimmung, könnte aber auf eine Hemmung positiver Verstärkerstrukturen, die Antriebslosigkeit und motorische Inaktivität auf eine Reduktion der Aktivität nigrostriataler Systeme rückführbar sein. Neuro- psychiatrische Erkrankungen, bei denen ebenfalls eine Störung der dopaminergen Transmission nachgewiesen oder zumindest vermutet wird, weisen häufig Stimmungsabweichungen in den negativen Bereich auf: zu nennen sind idiopathisches Parkinson-Syndrom, Schizophrenie, Suchterkrankungen im Stadium der Abstinenz, posttraumatische Störungen und saisonale Depression (Loas 2002). Das häufigste gemeinsame und für Patienten äusserst schwer quantifizierbare Symptom ist dabei die Anhedonie. Dieser Stimmungszustand wird als Verlust vom lustvollen Erleben und dem Streben danach definiert. Die von Anhedonie Betroffenen schildern eine Veränderung des subjektiven Erlebens, so dass Sinnesreize weniger scharf getrennt und Eindrücke vermehrt negativ besetzt werden (Heinz 1999). [Seite 061] In neurobiologischen Modellvorstellungen zur Anhedonie und Depression wird ein Zusammenhang mit dem dopaminergen System vermutet (Übersicht: Loas und Boyer 1996). Als zentrale neuroanatomische Struktur bei der Vermittlung von Belohnung und positiven Gefühlen wird hierbei das mesolimbische System mit dem präfrontalen Kortex und Nucleus accumbens angesehen. Klitenick, M. A., A. Y. Deutch, Churchill L. und Kalivas P. W. (1992). "Topography and functional role of dopaminergic projections from the ventral mesencephalic tegmentum to the ventral pallidum." Neuroscience 50(2): 371-86. Berlit, P. (1999). Klinische Neurologie. Springer-Verlag Berlin Heidelberg. Schildkraut, J. (1965). "The catecholamine hypothesis of affective disorders: A review of suppportive evidence." American Journal of Psychiatry 122: 509-522 Rampello, L. und F. Nicoletti (2000). "Dopamine and depression - Therapeutic implications." Cns Drugs 13(1): 35-45. Loas, G. (2002). "Relationships between anhedonia, depression, and schizophrenia." Journal of Nervous and Mental Disease 190(10): 717-718. Heinz, A. (1999). "Anhedonia - a general nosology correlation of a dysfunction of the dopaminergic reward system?" Nervenarzt 70(5): 391-398. Loas, G. und P. Bayer (1996). "Anhedonia in endogenomorphic depression." Psychiatry Research 60(1): 57-65. |
Aus dem Diskussionsteil - ohne Quellenangabe. |
| [86.] Mek/Fragment 168 02 |
| KomplettPlagiat |
|---|
| Untersuchte Arbeit: Seite: 168, Zeilen: 02-33 |
Quelle: Erhardt 2003 Seite(n): 067-068, Zeilen: 067:04-32; 068:01-14 |
|---|---|
| Die Behandlung mit rTMS bewirkte einen signifikanten Anstieg von extrazellulärem Dopamin in dieser Hirnregion, wobei sich bei morphinvorbehandelten Tieren im Vergleich zur Kontrollgruppe ein Sensitivierungseffekt zeigte.
Pharmakologische Studien belegen, dass p-Rezeptoren der Area tegmentalis ventralis eine besondere Rolle für die verstärkenden Effekte von Morphin und damit für die Entwicklung von Abhängigkeit haben. Dabei kommt es über eine Inhibition der hemmenden gabaergen Interneurone zu einer Erregung der mesolimbischen Dopaminneurone und somit zu einer erhöhten Freisetzung von Dopamin im Nucleus accumbens (Spanagel et al., 1993). Wird Morphin chronisch verabreicht, verändert sich das Freisetzungsmuster von Dopamin (Acquas & Di Chiara, 1992; Diana et al., 1995). Mit dem in unserem Experiment angewandten Morphinbehandlungsschema wurde eine Sensitivierung hervorgerufen, die vornehmlich durch p-Rezeptoren vermittelt wird (Kalivas & Stewart, 1991; Spanagel, 1995). Als neurobiologische Folge der Morphinsensitivierung wird die erhöhte Dopaminausschüttung auf erneute Morphinverabreichung im Vergleich zu Kontrolltieren mit erstmaliger Drogenapplikation angesehen (Kalivas & Stewart, 1991; Robinson & Berridge, 2001). Hierfür sind sowohl präsynaptische als auch postsynaptische Änderungen verantwortlich: Es kommt zu einer lokalen Herunterregulierung präsynaptischer D2-Autorezeptoren, die normalerweise über Rückkopplungsmechanismen die Dopaminausschüttung vermindern (Berke & Hyman, 2000). Postsynaptisch konnte eine erhöhte Sensitivität des D1-Rezeptors sowie eine verminderte Empfindlichkeit des Glutamat-Rezeptors im Nucleus accumbens gefunden werden (White, 1996). Die Sensitivierungseffekte in den verschiedenen anatomischen Teilen des Nucleus accumbens, core und Shell, sind hierbei nicht gleichartig. Die Arbeitsgruppe von Cadoni stellte fest, dass die Dopaminantwort auf erneute Morphin-, Amphetamin- oder Kokaingabe nach Sensitivierung nur im core, nicht jedoch im shell-Bereich erhöht ist (Cadoni & Di Chiara, 1999; Cadoni et al., 2000). Unsere Untersuchungen hingegen weisen auf einen Sensitivierungseffekt im Nucleus accumbens shell hin: Als akute Reaktion auf die rTMS-Behandlung zeigten die morphinvorbehandelten Tiere dabei einen um rund 30% höheren Dopaminanstieg als die Kontrolltiere. Dies deutet auf stattgefundene [neuronale Veränderungen im Nucleus accumbens Shell hin, die möglicherweise durch rTMS über Projektionen, die mit der Drogenwirkung zunächst nichts gemeinsam haben, aktiviert werden.] Spanagel, R., Almeida, O.F. & Shippenberg, T.S. (1993) Long lasting changes in morphine-induced mesolimbic dopamine release after chronic morphine exposure. Synapse, 14, 243-245. Acquas, E. & Di Chiara, G. (1992) Depression of mesolimbic dopamine transmission and sensitization to morphine during opiate abstinence. Journal of Neurochemistry, 58, 1620-1625. Diana, M., Pistis, M., Muntoni, A. & Gessa, G . (1995) Profound decrease of mesolimbic dopaminergic neuronal activity in morphine withdrawn rats. Journal of Pharmacology & Experimental Therapeutics, 272, 781-785. Kalivas, P.W. & Stewart, J. (1991) Dopamine transmission in the initiation and expression of drug- and stress-induced sensitization of motor activity. Brain Research - Brain Research Reviews, 16, 223-244. Spanagel, R. (1995) Modulation of drug-induced sensitization processes by endogenaus opioid systems. Behavioural Brain Research, 70, 37-49. Robinson, T.E. & Berridge, K.C . (2001) Incentive-sensitization and addiction. Addiction, 96, 103-114. Berke, J.D. & Hyman, S.E. (2000) Addiction , dopamine, and the molecular mechanisms of memory. Neuron, 25, 515-532. White, F.J. (1996) Synaptic regulation of mesocorticolimbic dopamine neurons. Annual Review of Neuroscience, 19, 405-436. Cadoni, C. & Di Chiara, G. (1999) Reciprocal changes in dopamine responsiveness in the nucleus accumbens shell and core and in the dorsal caudate-putamen in rats sensitized to morphine. Neuroscience, 90, 447-455. Cadoni, C , Solinas, M. & Di Chiara, G. (2000) Psychostimulant sensitization: differential changes in accumbal shell and core dopamine. European Journal of Pharmacology, 388, 69-76. |
[Seite 067]
Die anschliessende Behandlung mit rTMS bewirkte jedoch einen signifikanten Anstieg von extrazellulärem Dopamin in dieser Hirnregion, wobei sich bei morphinvorbehandelten Tieren im Vergleich zur Kontrollgruppe ein Sensitivierungseffekt zeigte. 4.5.1 Sensitivierung Pharmakologische Studien belegen, dass p-Rezeptoren der Area tegmentalis ventralis eine besondere Rolle für die verstärkenden Effekte von Morphin und damit für die Entwicklung von Abhängigkeit haben. Dabei kommt es über eine Inhibition der hemmenden y-Aminobuttersäure(GABA)-ergen Interneurone zu einer Erregung der mesolimbischen Dopaminneurone und somit zu einer erhöhten Freisetzung von Dopamin im Nucleus accumbens (Spanagel und Shippenberg 1993). [...] Wird Morphin chronisch verabreicht, verändert sich das Freisetzungsmuster von Dopamin (Guaza et al. 1980; Acquas und Di Chiara 1992; Tjon et al. 1994; Diana et al. 1995). Mit dem in unserem Experiment angewandten Morphinbehandlungsschema (10 mg/kg/KG) wurde eine Verhaltenssensitivierung hervorgerufen, die v.a. durch p-Rezeptoren vermittelt wird (Kalivas et al. 1991; Spanagel 1995). [...] Als neurobiologische Folge der Morphinsensitivierung wird eine erhöhte Dopaminausschüttung auf erneute Morphinverabreichung im Vergleich zu Kontrolltieren mit erstmaliger Drogenapplikation angesehen (Kalivas et al. 1991; Robinson und Berridge 2001). Sowohl präsynaptische als auch postsynaptische Änderungen sind für diese Reaktion verantwortlich. Man fand beispielsweise eine lokale Herunterregulierung präsynaptischer D2-Autorezeptoren, die normalerweise [Seite 068] über Rückkopplungsmechanismen die Dopaminausschüttung vermindern (Berke und Hyman 2000). Damit wird pro Aktionspotential mehr Dopamin freigesetzt. Postsynaptisch konnte eine erhöhte Sensitivität des D1-Rezeptors sowie eine verminderte Empfindlichkeit des Glutamat-Rezeptors im Nucleus accumbens gefunden werden (White 1996). Die Sensitivierungseffekte in den verschiedenen Teilen des Nucleus accumbens, core und Shell, müssen nicht gleichartig sein. Die Arbeitsgruppe von Cadoni stellte fest, dass die Dopaminantwort auf erneute Morphingabe nach Sensitivierung nur im core, nicht jedoch im shell-Bereich erhöht ist (Cadoni und DiChiara 1999). Ähnliches fanden Cadoni et al. auch nach Amphetamin- und Kokainsensitivierung (Cadoni et al. 2000). Die vorliegenden Ergebnisse dieser Dissertation weisen jedoch auf einen Sensitivierungseffekt im Nucleus accumbens Shell hin: Als akute Reaktion auf die rTMS-Behandlung zeigten die morphinvorbehandelten Tiere dabei einen um rund 30% höheren Dopaminanstieg als die Kontrolltiere. Das deutet auf stattgefundene neuronale Veränderungen im Nucleus accumbens Shell hin, die möglicherweise durch rTMS über unbekannte Pfade, die mit der Drogenwirkung nichts gemeinsam haben, demaskiert werden. Spanagel, R. und T. S. Shippenberg (1993) . "Modulation of morphine-induced sensitization by endogenaus kappa opioid systems in the rat." Neuroscience Letters 153(2): 232-6. Guaza, C., A. Torrellas, Borrell S. und Borrell J. (1980). "The effects of acute and chrenic administration of morphine on the turnover of brain and adrenal catecholamines in rats." Psychopharmacoloqy 68(1): 43-9. Acquas, E. und G. Di Chiara (1992). "Depression of mesolimbic dopamine transmission and sensitization to morphine during opiate abstinence." Journal of Neurochemistry 58(5): 1620-5. Tjon, G. H., T. J. De Vries, Ronken E., Hagenboom F., Wardeh G., Mulder A. H. und Schaffelmeer A. N. (1994). "Repeated and chronic morphine administration causes differential long-lasting changes in dopaminergic neurotransmission in rat striatum without changing its delta- and kappa-opioid receptor regulation." European Journal of Pharmacology 252(2): 205-12. Diana, M., M. Pistis, Muntoni A. und Gessa G. L. (1995). "Profound decrease of mesolimbic dopaminergic neuronal activity in morphine withdrawn rats." Journal of Pharmacology & Experimental Therapeutics 272(2): 781-5. Kalivas, P. W. und J. Siewart (1991). "Dopamine transmission in the initiation and expression of drug- and stress-induced sensitization of motor activity." Brain Research - Brain Research Reviews 16(3): 223-44. Spanagel, R. (1995). "Modulation of drug-induced sensitization processes by endogenaus opioid systems." Behavioural Brain Research 70(1): 37-49. Robinson, T. E. und K. G. Berridge (2001). "Incentive-sensitization and addiction." Addiction 96(1): 103-114. Berke, J. D. und S. E. Hyman (2000). "Addiction, dopamine, and the molecular mechanisms of memory." Neuron 25(3): 515-532. White, F. J. (1996). "Synaptic regulation of mesocorticolimbic dopamine neurons." Annual Review of Neuroscience 19: 405-436. Cadoni, C. und G. Di Chiara (1999). "Reciprocal changes in dopamine responsiveness in the nucleus accumbens shell and core and in the dorsal caudate-putamen in rats sensitized to morphine." Neuroscience 90(2): 447-55. Cadoni, C., M. Solinas und Di Chiara G. (2000). "Psychostimulant sensitization: differential changes in accumbal shell and core dopamine." European Journal of Pharmacology 388(1): 69-76. |
Wörtliche übernahmen im Diskussionsteil ohne Quellenangabe. |
| [87.] Mek/Fragment 169 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 169, Zeilen: 01 ff. (komplett) |
Quelle: Erhardt 2003 Seite(n): 068-069, Zeilen: 068:14-33; 069:01-14 |
|---|---|
| [Dies deutet auf stattgefundene] neuronale Veränderungen im Nucleus accumbens Shell hin, die möglicherweise durch rTMS über Projektionen, die mit der Drogenwirkung zunächst nichts gemeinsam haben, aktiviert werden. Die höhere Freisetzung von Dopamin im Nucleus accumbens Shell könnte auch durch eine erhöhte Stressreaktion der morphinvorbehandelten Tiere, die sich im Abstinenzstadium befinden, erklärt werden. Diese Möglichkeit ist nach dem Vergleich mit der scheinstimulierten Gruppe jedoch wenig wahrscheinlich, da diese keinerlei Änderungen der dopaminergen Neurotransmission aufwies.
Der Vorgang der Sensitivierung scheint eine bedeutende Rolle für die motivationale und belohnende Wirkung der Drogen und somit in der Aufrechterhaltung der Sucht zu spielen. So ist bekannt, dass Sensitivierung sowohl die psychomotorischen Effekte als auch die belohnende Wirkung einer Droge erhöhen kann (De Vries & Shippenberg, 2002). Bei Amphetamin-sensitivierten Ratten findet sich beispielsweise eine erhöhte Dopaminantwort auf natürliche Belohnungsstimuli, z.B. Kopulation oder Nahrungsaufnahme (Fiorino & Phillips, 1999). Dieser Befund weist auf eine mögliche „Suchtbahnung" durch Sensitivierung hin: Die unphysiologisch höhere Dopaminfreisetzung im mesolimbischen System könnte dazu führen, dass sich die Potenz zur Erzeugung eines Suchtverhaltens durch andere physiologische und nicht-physiologische belohnende Stimuli erhöht. Damit würde sich auch die Bandbreite möglicher Suchtgefahren vergrößern. Die durch uns erhobenen Befunde führen zu der Frage, ob rTMS möglicherweise eine Rolle in der Suchtbehandlung spielen könnte. Obwohl das drogensuchende Verhalten nicht in einem fest definierten zeitlichen Abstand zu Drogeneinnahme- und Abstinenz auftritt, wäre es durchaus denkbar, dass unbekannte Schwellenmechanismen im dopaminergen System für das Craving verantwortlich sind. Während des Cravings konnte mit Hilfe von PET die Aktivierung kortiko-striato-thalamischer Regionen dargestellt werden (Volkow et al., 2002). Mit rTMS können die meisten dieser Regionen über transkortikale Projektionen erreicht werden. Durch eine rTMS-Therapie, die zur Aktivierung der dopaminergen Transmission im Nucleus accumbens führt, könnte daher möglicherweise der pathologische Kreislauf, der für das Auftreten von Craving verantwortlich ist, durchbrochen werden. De Vries, T.J. & Shippenberg, T.S. (2002) Neuralsystems underlying opiate addiction. Journal of Neuroscience, 22, 3321-3325. Fiorino, D.F. & Phillips, A.G. (1999) Facilitation of sexual behavior and enhanced dopamine efflux in the nucleus accumbens of male rats after D-amphetamineinduced behavioral sensitization. Journal of Neuroscience, 19, 456-463. Volkow, N.D., Wang, G.J. & Fowler, J.S. (2002) Imaging drug reinforcement and addiction in the human brain. Abstracts of Papers of the American Chemical Society, 223, 037-NUCL. |
[Seite 068]
Das deutet auf stattgefundene neuronale Veränderungen im Nucleus accumbens Shell hin, die möglicherweise durch rTMS über unbekannte Pfade, die mit der Drogenwirkung nichts gemeinsam haben, demaskiert werden. Die höhere Freisetzung von Dopamin im Nucleus accumbens Shell könnte auch durch eine erhöhte Stressreaktion der morphinvorbehandelten Tiere, die sich im Abstinenzstadium befinden, erklärt werden. Diese Möglichkeit ist nach dem Vergleich mit der scheinstimulierten Gruppe jedoch wenig wahrscheinlich, da diese keinerlei Änderungen der dopaminergen Neurotransmission aufweist. Der Vorgang der Sensitivierung scheint eine bedeutende Rolle für die motivationale und belohnende Wirkung der Drogen und somit in der Aufrechterhaltung der Sucht zu spielen (Wise und Bozarth 1985). So ist bekannt, dass Sensitivierung sowohl die psychomotorischen Effekte als auch die belohnende Wirkung einer Droge erhöhen kann (De Vries und Shippenberg 2002). Bei Amphetamin-sensitivierten Ratten findet sich eine erhöhte Dopaminantwort auf natürliche Belohnungsstimuli, z.B. Kopulation oder Nahrungsaufnahme (Fiorino et al. 1999). Dieser Befund weist auf eine mögliche „Suchtbahnung" durch Sensitivierung hin: die unphysiologisch höhere Dopaminfreisetzung im mesolimbischen System könnte dazu führen, dass sich die Potenz zur Erzeugung eines Suchtverhaltens durch andere physiologische und nicht-physiologische belohnende Stimuli erhöht. Damit würde sich auch die Bandbreite möglicher Suchtgefahren vergrössern. [Seite 069] An dieser Stelle muss diskutiert werden, welche Rolle die rTMS in der Suchtbehandlung spielen könnte. Obwohl das drogensuchende Verhalten nicht im fest definierten zeitlichen Abstand zu Drogeneinnahme- und Abstinenz auftritt, wäre es durchaus denkbar, dass unbekannte Schwellenmechanismen im dopaminergen System für das Craving verantwortlich sind. [...] Während des Cravings konnte mit Hilfe von PET die Aktivierung kortiko-striato-thalamischer Regionen dargestellt werden (Volkow et al. 2002). Mit rTMS können die meisten dieser Regionen über transkortikale Projektionen erreicht werden. Mit einer geplanten rTMS-Therapie, die zur Aktivierung der dopaminergen Transmission im Nucleus accumbens führt, könnte daher möglicherweise der pathologische Kreislauf, der für das Auftreten von Craving verantwortlich ist, durchbrochen werden. De Vries, T. J. und T. S. Shippenberg (2002). "Neural systems underlying opiate addiction." Journal of Neuroscience 22(9): 3321-3325. Fiorino, D. F. und A. G. Phillips (1999). "Facilitation of sexual behavior and enhanced dopamine efflux in the nucleus accumbens of male rats after D-amphetamineinduced behavioral sensitization." Journal of Neuroscience 19(1): 456-463. Volkow, N. D., J. S. Fowler und Wang G. J. (2002). "Role of dopamine in drug reinforcement and addiction in humans: results from imaging studies." Behavioural Pharmacology 13(5-6): 355-366. |
Aus dem Diskussionsteil - ohne Quellenangabe. |
| [88.] Mek/Fragment 170 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 170, Zeilen: 01 ff. (komplett) |
Quelle: Erhardt 2003 Seite(n): 069-070, Zeilen: 069:22-32; 070:01-31 |
|---|---|
| Abstinenzphase
Der beschriebene Sensitivierungseffekt wird durch weitreichende neuronale Prozesse vermittelt. Die wiederholte Stimulation der Dopaminfreisetzung durch Morphin bewirkt zunächst eine Anhebung der basalen Dopaminkonzentration im mesolimbischen System (Di Chiara & Imperato, 1986; Maisonneuve et al., 2001). Im Zuge der Anpassung des Organismus kommt es in der Folge zur erniedrigten basalen Dopaminfreisetzung in der Abstinenzphase (Acquas & Di Chiara, 1992; Spanagel & Shippenberg, 1993; Diana et al., 1995). Unter der Voraussetzung, dass Morphin weiterhin regelmäßig zugeführt wird, ist in diesem Zustand die dopaminerge Homöostase ausgeglichen (Koob & Le Moal, 2001). Wird jedoch die Droge nicht mehr verabreicht, kommt es zum längerfristigen Dopaminmangel im mesolimbischen System, der unter anderem für die psychischen Symptome des Entzugs verantwortlich gemacht wird. Die akute Abstinenzphase ist mit dem Auftreten eines negativen Affektes, wie Dysphorie, Ängstlichkeit, Anhedonie, Irritabilität und Depression vergesellschaftet (Heinz, 1999). Die genannten Symptome und ihre Ausprägung sind wahrscheinlich für die Motivation zur erneuten Drogeneinnahme entscheidend. Mit Hilfe intrakranieller Selbststimulation (ICSS) des medialen Vorderhirnbündels, welche in einer erhöhten Dopaminfreisetzung resultiert, konnte außerdem im Tiermodell gezeigt werden, dass die „belohnende" Schwelle der meisten suchterzeugenden Drogen während der Abstinenzphase erhöht ist. Mikrodialyse-Studien zeigen zudem, dass die Dopamin-Freisetzung im Nucleus accumbens während des Entzugs nach Opioid-Einnahme reduziert ist (Koob & Le Moal, 2001). Gleichzeitig konnte in elektrophysiologischen Messungen eine signifikante Reduktion der dopaminergen neuronalen Aktivität im Nucleus accumbens nachgewiesen werden (Diana et al., 1999). Es ist daher davon auszugehen, dass die chronische Verabreichung von Drogen die basale Dopaminfreisetzung durch neuroplastische Vorgänge unterdrückt, um die ständige Stimulation durch die Droge auszugleichen (Koob & Le Moal, 2001). Diese Dysfunktion der Dopaminneurone ist prinzipiell reversibel und zeitlich länger vorhanden als die Entzugssymptome selbst: Während der Morphinabstinenz nach Sensitivierung ist die Dopaminfreisetzung bei Ratten nach 48 Stunden am niedrigsten; die vollständige Normalisierung tritt etwa nach einer Woche ein (Acquas & Di Chiara, 1992). Es ist derzeit davon auszugehen, dass während der exzessiven [Drogenverabreichung eine Herunterregulierung von postsynaptischen D2-Rezeptoren stattfindet.] Di Chiara, G. & Imperato, A. (1986) Preferential Stimulation of dopamine release in the nucleus accumbens by opiates, alcohol, and barbiturates: studies with transcerebral dialysis in freely moving rats. Annals of the New York Academy of Sciences, 473, 367-381. Maisonneuve, I.M., Warner, L.M. & Glick, S.O. (2001) Biphasic dose-related effects of morphine on dopamine release. Drug & Alcohol Dependence, 65, 55-63. Acquas, E. & Di Chiara, G. (1992) Depression of mesolimbic dopamine transmission and sensitization to morphine during opiate abstinence. Journal of Neurochemistry, 58, 1620-1625. Spanagel, R. & Shippenberg, T.S. (1993) Modulation of morphine-induced sensitization by endogenaus kappa opioid systems in the rat. Neuroscience Letters, 153, 232-236. Diana, M., Pistis, M., Muntoni, A. & Gessa, G. (1995) Profound decrease of mesolimbic dopaminergic neuronal activity in morphine withdrawn rats. Journal of Pharmacology & Experimental Therapeutics, 272, 781-785. Koob, G.F. & Le Moal, M. (2001) Drug addiction, dysregulation of reward, and allostasis. Neuropsychopharmacology, 24, 97-129. Heinz, A. (1999) Anhedonia - a general nosology correlation of a dysfunction of the dopaminergic reward system? Nervenarzt, 70, 391-398. Diana, M., Muntoni, A.L., Pistis, M., Melis, M. & Gessa, G.L. (1999) Lasting reduction in mesolimbic dopamine neuronal activity after morphine withdrawal. European Journal of Neuroscience, 11 , 1037-1041. |
[Seite 069]
4.5.2 Abstinenzphase Der Sensitivierungseffekt wird von weiteren neuronalen Prozessen begleitet. Die ständige Stimulation der Dopaminfreisetzung durch Morphin bewirkt zunächst eine Anhebung der basalen Dopaminkonzentration im mesolimbischen System (DiChiara und Imperato 1986; Wise 1989; Maisonneuve et al. 2001). Im Zuge der Anpassung des Organismus an die neuen Verhältnisse kommt es zur erniedrigten basalen Dopaminfreisetzung in der Abstinenzphase (Acquas und DiChiara 1992; Spanagel et al. 1993; Diana et al. 1995). Unter der Voraussetzung, dass das Morphin weiterhin regelmässig zugeführt wird, ist in diesem Zustand die dopaminerge Homöostase ausgeglichen (Koob 2001). Wird jedoch die Droge nicht mehr verabreicht, kommt es zum längerfristigen Dopaminmangel im mesolimbischen System, der für die [Seite 070] psychischen Symptome des Entzugs verantwortlich gemacht wird. Die akute Abstinenzphase ist mit dem Auftreten eines negativen affektiven Zustands sowie negativer Emotionen, wie Dysphorie, Ängstlichkeit, Anhedonie, Irritabilität und Depression, vergesellschaftet (Heinz 1999; Anraku et al. 2001). Die genannten Symptome und ihre Ausprägung sind wahrscheinlich für die Motivation zur erneuten Drogeneinnahme entscheidend. Mit Hilfe intrakranieller Selbststimulation (ICSS) des medialen Vorderhirnbündels konnte ausserdem im Tiermodell gezeigt werden, dass die „belohnende“ Schwelle der meisten suchterzeugenden Drogen während der Abstinenzphase erhöht ist (Naranjo et al. 2001). Darüberhinaus zeigen Mikrodialyse-Studien, daß die Dopamin-Freisetzung im Nucleus accumbens während des Entzugs nach Opioid-Einnahme reduziert ist (Acquas et al. 1991; Rossetti et al. 1992; Diana et al. 1995). Gleichzeitig konnte in elektrophysiologischen Messungen eine signifikante Reduktion der dopaminergen neuronalen Aktivität im Nucleus accumbens nachgewiesen werden (Diana et al. 1999). Man geht daher davon aus, daß die chronische Verabreichung von Drogen die basale Dopaminfreisetzung durch neuroplastische Vorgänge unterdrückt, um die ständige Stimulation durch die Droge auszugleichen (Koob 2001). Diese Dysfunktion der Dopaminneurone ist prinzipiell reversibel und zeitlich länger vorhanden als die Entzugssymptome selbst: Während der Morphinabstinenz nach Sensitivierung ist die Dopaminfreisetzung bei Ratten nach 48 h am niedrigsten; die vollständige Normalisierung tritt etwa nach einer Woche ein (Acquas und DiChiara 1992). [...] Es ist daher anzunehmen, dass während der exzessiven Drogenverabreichung eine Herunterregulierung von postsynaptischen Dopamin-2-Rezeptoren stattfindet. Di Chiara, G. und A. Imperato (1986). "Preferential Stimulation of dopamine release in the nucleus accumbens by opiates, alcohol, and barbiturates: studies with transcerebral dialysis in freely moving rats." Annals of the New York Academy of Sciences 473: 367-81 . Wise, R. A. (1989). "Opiate reward: sites and substrates." Neuroscience & Biobehavioral Reviews 13(2-3): 129-33. Maisonneuve, I. M., L. M. Warner und Glick S. O. (2001). "Biphasic dose-related effects of morphine on dopamine release." Drug & Alcohol Dependence 65(1): 55-63. Acquas, E. und G. Di Chiara (1992). "Depression of mesolimbic dopamine transmission and sensitization to morphine during opiate abstinence." Journal of Neurochemistry 58(5): 1620-5. Spanagel, R. , O. F. Almeida und Shippenberg T. S. (1993). "Long lasting changes in morphine-induced mesolimbic dopamine release after ehrenie morphine exposure." Synapse 14(3): 243-5. Diana, M., M. Pistis, Muntoni A. und Gessa G. L. (1995). "Profound decrease of mesolimbic dopaminergic neuronal activity in morphine withdrawn rats." Journal of Pharmacology & Experimental Therapeutics 272(2): 781-5. Koob, G. F. (2001). "Orug addiction, reward dysregulation and allostasis." British Journal of Pharmacology 134: 195P. Heinz, A. (1999). "Anhedonia - a general nosology correlation of a dysfunction of the dopaminergic reward system?" Nervenarzt 70(5): 391-398. Anraku, T., Y. lkegaya, Matsuki N. und Nishiyama N. (2001). "Withdrawal from chronic morphine administration causes prolonged enhancement of immobility in rat forced swimming lest." Psychopharmacoloqy 157(2): 217-220. Naranjo, C. A., L. K. Tremblay und Busto U. E. (2001). The role of the brain reward system in depression." Progress in Neuro-Psychopharmacology & Biological Psychiatry 25(4): 781-823. Acquas, E., E. Carboni und G. Di Chiara (1991). "Profound depression of mesolimbic dopamine release after morphine withdrawal in dependent rats." European Journal of Pharmacology 193(1): 133-4. Rossetti, Z. L., Y. Hmaidan, und Gessa G. L. (1992). "Marked inhibition of mesolimbic dopamine release: a common feature of ethanol, morphine, cocaine and amphetamine abstinence in rats." European Journal of Pharmacology 221(2-3): 227-34. Diana, M., A. L. Muntoni, Pistis M., Melis M. und Gessa G. L. (1999). "Lasting reduction in mesolimbic dopamine neuronal activity after morphine withdrawal." European Journal of Neuroscience 11(3): 1037-41 . |
Aus dem Diskussionsteil - ohne Quellennennung. |
| [89.] Mek/Fragment 171 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 171, Zeilen: 01 ff. (komplett) |
Quelle: Erhardt 2003 Seite(n): 070-072, Zeilen: 070:31-33; 071:01-33; 072:01-04 |
|---|---|
| [Es ist derzeit davon auszugehen, dass während der exzessiven] Drogenverabreichung eine Herunterregulierung von postsynaptischen D2-Rezeptoren stattfindet. Zu Beginn der Abstinenz kommt es zum raschen Abfall der Dopaminfreisetzung, während die Dichte der Dopamin-Rezeptoren jedoch mit zeitlicher Verzögerung ansteigt (Koob & Le Moal, 2001).
In unseren Experimenten konnten wir keine Erniedrigung der basalen Dopaminkonzentration im Nucleus accumbens der Sprague-Dawley-Ratten nach 48 Stunden Morphinabstinenz feststellen. Ein Grund für dieses Ergebnis könnte darin liegen, dass nicht die Regulation der basalen Dopaminfreisetzung den entscheidenden Faktor für den dysphorischen Zustand während der Abstinenzphase darstellt, sondern die allgemeine Empfindlichkeit des Systems. Möglicherweise ist die Normalisierung der Dopaminfreisetzung individuell verschieden und geht nach Verabreichen kleiner Sensitivierungsdosen schneller voran als bisher beschrieben. Nicht ausgeschlossen werden kann die Möglichkeit der Beeinflussung der basalen Dopaminkonzentration im Nucleus accumbens Shell durch die Aktivierung von Stresskreisläufen im zentralen Nervensystem (Martinez-Pinero et al., 1994). Durch die chronische Verabreichung von Drogen und während des Drogenentzugs wird die HPA-Achse aktiviert, wobei die erhöhte Freisetzung der Stresshormone die Entzugsphase überdauern kann (Sarnyai et al., 2001). Die Wirkung der extensiven präexperimentellen Habituation durch tägliches Handling könnte zudem im Drogenentzug abgeschwächt oder aufgehoben sein, so dass die Stresswirkung auf die Dopaminfreisetzung bereits zu Anfang des Experiments vorhanden wäre. In diesem Fall wären bei morphinvorbehandelten Ratten erhöhte basale Dopaminwerte messbar, die im Vergleich zu Kontrolltieren scheinbar im Normalbereich lägen. Das entscheidende Ergebnis der Untersuchungen ist jedoch die gemessene Anhebung der Dopaminkonzentration im Nucleus accumbens Shell durch rTMS während der Abstinenzphase. Hierdurch könnte rTMS eventuell eine neue therapeutische Option in der Behandlung von Suchtpatienten darstellen. Wie oben geschildert, normalisieren sich die Dopaminkonzentrationen im Nucleus accumbens erst innerhalb mehrerer Wochen nach Absetzen der Droge (Acquas & Di Chiara, 1992). Gerade in diesem Zeitraum ist die Verbesserung anhedonischer und dysphorischer Stimmungen von großer Bedeutung für die Patienten, da diese Symptome subjektiv als sehr belastend empfunden werden. Die Rolle der akuten physischen Entzugssymptomatik ist für die langfristige Suchttherapie hingegen von [geringerer Relevanz, da diese wenig Bedeutung für einen möglichen Rückfall der Patienten hat (Nestler, 2002).] Koob, G.F. & Le Moal, M. (2001) Drug addiction, dysregulation of reward, and allostasis. Neuropsychopharmacology, 24, 97-129. Martinez-Pinero, M.G., Milanes, M.V. & Vargas, M.L. (1994) Modulation by catecholamine of hypothalamus-pituitary-adrenocortical (HPA) axis activity in morphine-tolerance and withdrawal. General Pharmacology, 25, 187-192. Sarnyai, Z., Shaham, Y. & Heinrichs, S.C. (2001) The role of corticotropin-releasing factor in drug addiction. Pharmacological Reviews, 53, 209-243. Acquas, E. & Di Chiara, G . (1992) Depression of mesolimbic dopamine transmission and sensitization to morphine during opiate abstinence. Journal of Neurochemistry, 58, 1620-1625. Nestler, E.J. (2002) From neurobiology to treatment: progress against addiction. Nature Neuroscience, 5, 1076-1079. |
[Seite 070]
Es ist daher anzunehmen, dass während der exzessiven Drogenverabreichung eine Herunterregulierung von postsynaptischen Dopamin-2-Rezeptoren stattfindet. Zu Beginn der Abstinenz kommt es zum raschen Abfall der Dopaminfreisetzung [Seite 071] während die Dichte der Dopamin-Rezeptoren jedoch mit zeitlicher Verzögerung ansteigt (Koob 2001). In unserem Experiment konnten wir keine Erniedrigung der basalen Dopaminkonzentration im Nucleus accumbens der Sprague-Dawley-Ratten nach 48 Stunden Morphinabstinenz feststellen. Die Morphinvorbehandlung fand gemäss dem Protokoll von Aquas und DiChiara (1992) statt. Ein Grund für dieses unerwartete Ergebnis könnte darin liegen, dass die Regulation der basalen Dopaminfreisetzung nicht der entscheidende Faktor für den dysphorischen Zustand während der Abstinenzphase ist, sondern die allgemeine Empfindlichkeit des Systems. Möglicherweise ist die Normalisierung der Dopaminfreisetzung individuell verschieden und geht nach Verabreichen kleiner Sensitivierungsdosen schneller voran als angenommen. [...] Nicht ausgeschlossen werden kann die Möglichkeit der Beeinflussung der basalen Dopaminkonzentration im Nucleus accumbens Shell durch die Aktivierung von Stresskreisläufen im zentralen Nervensystem (Suemaru et al. 1985; Martinez-Pinero et al. 1994). Durch die chronische Verabreichung von Drogen und während des Drogenentzugs wird die HPA-Achse aktiviert, wobei die erhöhte Freisetzung der Stresshormone die Entzugsphase überdauern kann (Sarnyai et al. 2001). Die Wirkung des präexperimentellen Handlings könnte durch den dysphorischen Zustand der Tiere abgeschwächt oder aufgehoben sein, so dass die Stresswirkung auf die Dopaminfreisetzung bereits zu Anfang des Experiments vorhanden wäre. In diesem Fall würde man bei den morphinvorbehandelten Ratten erhöhte basale Dopaminwerte messen, die im Vergleich zu Kontrolltieren scheinbar im Normalbereich lägen. Das entscheidende Ergebnis des Experiments ist die gemessene Anhebung des Dopaminspiegels im Nucleus accumbens Shell durch rTMS während der Abstinenzphase. Hierdurch bietet rTMS eventuell eine neue therapeutische Option für Suchtpatienten. Wie oben geschildert, normalisieren sich die Dopaminspiegel im Nucleus accumbens erst innerhalb mehrerer Wochen nach Absetzen der Droge [Seite 072] (Acquas und Di Chiara 1992). Gerade in diesem Zeitraum ist die Verbesserung anhedonischer und dysphorischer Stimmungen von grosser Bedeutung für die Patienten, da diese Symptome subjektiv als sehr belastend empfunden werden. Die Rolle der physischen Entzugssymptome für die langfristige Suchttherapie ist weniger relevant da diese keine Bedeutung für den Rückfall der Patienten haben (Nestler 2002). Koob, G. F. (2001). "Drug addiction, reward dysregulation and allostasis." British Journal of Pharmacology 134: 195P. Acquas, E. und G. Di Chiara (1992). "Depression of mesolimbic dopamine transmission and sensitization to morphine during opiate abstinence." Journal of Neurochemistry 58(5): 1620-5. Suemaru, S., K. Hashimoto und Ota Z. (1985). "Effects of morphine on hypothalamic corticotropin-releasing factor (CRF), norepinephrine and dopamine in nonstressed and stressed rats." Acta Medica Okayama 39(6): 463-70. Martinez-Pinero, M. G., M. V. Milanes und Vargas M. L. (1994). "Modulation by catecholamine of hypothalamus-pituitary-adrenocortical (HPA) axis activity in morphine-tolerance and withdrawal." General Pharmacology 25(1): 187-92. Sarnyai, Z., Y. Shaham und Heinrichs S. C. (2001). "The role of corticotropin-releasing factor in drug addiction." Pharmacological Reviews 53(2): 209-243. Nestler, E. J. (2002). "From neurobiology to treatment: progress against addiction." Nature Neuroscience 5: 1076-1079. |
Kein Hinweis auf die Quelle. |
| [90.] Mek/Fragment 172 01 |
| Verschleierung |
|---|
| Untersuchte Arbeit: Seite: 172, Zeilen: 01-07 |
Quelle: Erhardt 2003 Seite(n): 072, Zeilen: 03-11 |
|---|---|
| [Die Rolle der akuten physischen Entzugssymptomatik ist für die langfristige Suchttherapie hingegen von] geringerer Relevanz, da diese wenig Bedeutung für einen möglichen Rückfall der Patienten hat (Nestler, 2002). Im Gegensatz zur Methadonsubstitution unterhält rTMS darüber hinaus nicht die Drogenwirkung an Rezeptoren, die für die Suchterkrankung verantwortlich sind. Zudem konnte wiederholt gezeigt werden, dass rTMS die Aktivität der HPA-Achse, deren Dysregulation die Irritabilität der Betroffenen steigert (Heinz, 1999), positiv beeinflussen kann (Keck et al., 2000a, 2001a; Czeh et al., 2002; Hedges et al., 2002).
Nestler, E.J. (2002) From neurobiology to treatment: progress against addiction. Nature Neuroscience, 5, 1076-1079. Heinz, A. (1999) Anhedonia - a general nosology correlation of a dysfunction of the dopaminergic reward system? Nervenarzt, 70, 391-398. Keck, M.E., Engelmann, M., Müller, M.B., Henniger, M.S.H., Hermann, B., Rupprecht, R. , Neumann, 1.0., Toschi, N., Landgraf, R. & Post, A. (2000a) Repetitive transcranial magnetic Stimulation induces active coping strategies and attenuates the neuroendocrine stress response in rats. Journal of Psychiatric Research, 34, 265-276. Keck, M.E., Welt, T., Post, A., Müller, M.B., Toschi, N., Wigger, A., Landgraf, R., Holsboer, F. & Engelmann, M. (2001b) Neuroendocrine and behavioral effects of repetitive transcranial magnetic stimulation in a psychopathological animal model are suggestive of antidepressant-like effects. Neuropsychopharmacology, 24, 337-349. Czeh, B., Welt, T., Fischer, A.K., Erhardt, A., Schmitt, W ., Mueller, M.B., Toschi, N., Fuchs, E. & Keck, M.E. (2002) Chronic psychosocial stress and concomitant repetitive transcranial magnetic Stimulation: Effects on stress hormone levels and adult hippocampal neurogenesis. Biological Psychiatry, pp. 1057-1065. Hedges, D.W., Salyer, D.L., Higginbotham, B.J., Lund, T.D., Hellewell, J.L., Ferguson, D. & Lephart, E.D. (2002) Transcranial Magnetic Stimulation (TMS) effects on Testosterone, Prolactin, and Corticosterone in adult male rats. Biological Psychiatry, 51, 417-421. |
Die Rolle der physischen Entzugssymptome für die langfristige Suchttherapie ist weniger relevant da diese keine Bedeutung für den Rückfall der Patienten haben (Nestler 2002). rTMS kann im Prinzip täglich verabreicht werden und weist wenige Nebenwirkungen auf. Im Gegensatz zur Methadonsubstitution unterhält diese Methode nicht die Drogenwirkung an Rezeptoren, die für das Leiden verantwortlich sind. Zudem kann rTMS die HPA-Achse positiv beeinflussen (Keck et al. 2000a, 2001; Czeh et al. 2002), deren Dysregulation die Versagensängste und Irritabilität der Betroffenen steigert (Heinz 1999).
Nestler, E. J. (2002). "From neurobiology to treatment: progress against addiction." Nature Neuroscience 5: 1076-1079. Keck M. E., M. Engelmann, Muller M. B., Henniger M. S. H., Hermann B., Rupprecht R., Neumann I. D., Toschi N., Landgraf R. und Post A. (2000a) . "Repetitive transcranial magnetic stimulation induces active coping strategies and attenuates the neuroendocrine stress response in rats." Journal of Psychiatric Research 34(4-5): 265-276. Keck, M. E., T. Welt, Post A., Muller A. B., Toschi N., Wigger A., Landgraf R., Holsboer F. und Engelmann M. (2001) "Neuroendocrine and behavioral effects of repetitive transcranial magnetic stimulation in a psychopathological animal model are suggestive of antidepressant-like effects." Neuropsychopharmacology 24(4): 337-349. Czeh, B., T. Welt, A.K. Fischer, A. Erhardt, W. Schmidt, M.B. Müller, N. Toschi, E. Fuchs und M.E. Keck (2002). "Chronic psychosocial stress and concomitant repetitive transcranial magnetic stimulation: effects on stress hormone levels and adult hippocampal neurogenesis." Biological Psychiatry 52: 1057-1065 Heinz, A. (1999). "Anhedonia - a general nosology correlation of a dysfunction of the dopaminergic reward system?" Nervenarzt 70(5): 391-398. |
Aus dem Diskussionsteil - Abschluss von Kap. 5.4.3.3.1. Kein Hinweis auf die Quelle - von der hier der Inhalt der letzten Zeilen des Haupttextes übernommen werden. |
Quellen
| [1.] Quelle:Mek/Schindele 2003 |
| Autor | Thomas Schindele |
| Titel | Der Einfluss von Alprazolam und Temazepam auf die Regulation der Hypothalamus-Hypophysen-Nebennierenrinden-Achse bei der Ratte |
| Ort | München |
| Jahr | 2003 |
| Umfang | 117 S. |
| Anmerkung | München, Univ., Med. Fak., Diss., 2003 Angefertigt am Max-Planck-Institut für Psychiatrie, München; Tag der mündlichen Prüfung: 9. Oktober 2003 |
Literaturverz. |
nein |
| Fußnoten | nein |
| [2.] Quelle:Mek/Erhardt 2003 |
| Autor | Angelika Erhardt |
| Titel | Einfluß der repetitiven transkraniellen Magnetstimulation (rTMS) auf das mesolimbische dopaminerge System bei drogennaiven und morphinvorbehandelten Ratten |
| Ort | München |
| Jahr | 2003 |
| Umfang | III, 93 S. |
| Anmerkung | München, Univ., Med. Fak., Diss., 2003 Angefertigt am Max-Planck-Institut für Psychiatrie, München; Tag der mündlichen Prüfung: 15. Mai 2003 |
Literaturverz. |
nein |
| Fußnoten | nein |
| [3.] Quelle:Mek/Holsboer 1999 |
| Autor | Florian Holsboer |
| Titel | Molekulare Mechanismen der Depressionstherapie |
| Sammlung | Erkrankungen des Zentralnervensystems |
| Herausgeber | Detlev Ganten / Klaus Ruckpaul |
| Ort | Berlin / Heidelberg |
| Verlag | Springer-Verlag |
| Datum | 29. April 1999 |
| Seiten | 273-318 |
| Reihe | Handbuch der Molekularen Medizin; Bd. 5 |
| Anmerkung | Der Autor war von 1989 bis 2014 Direktor des Max-Planck-Instituts für Psychiatrie, München.[1] |
| ISBN | 978-3540645528 |
Literaturverz. |
nein |
| Fußnoten | nein |
| [4.] Quelle:Mek/Weber 1999 |
| Autor | Matthias M. Weber |
| Titel | Die Entwicklung der Psychopharmakologie im Zeitalter der naturwissenschaftlichen Medizin: Ideengeschichte eines psychiatrischen Therapiesystems |
| Herausgeber | Florian Holsboer |
| Ort | München |
| Verlag | Urban & Vogel |
| Jahr | 1999 |
| Umfang | XI, 224 S. |
| Reihe | Angewandte Neurowissenschaft; 4 |
| Anmerkung | Überarbeitete Fassung der Habilitationsschrift (Mai 1999) des Verfassers an der Medizinischen Fakultät der Ludwig-Maximilians-Universität München; angefertigt am Max-Planck-Institut für Psychiatrie, München |
Literaturverz. |
ja |
| Fußnoten | ja |
| [5.] Quelle:Mek/Engelmann 2000 |
| Autor | Mario Engelmann |
| Titel | Intrazerebral freigesetztes Vasopressin kontrolliert Emotionalverhalten und Streßverarbeitungsstrategien bei Ratten |
| Ort | Leipzig |
| Jahr | 2000 |
| Umfang | 150 S. |
| Anmerkung | Leipzig, Univ., Fak. f. Biowissenschaften, Pharmazie u. Psychologie, Habil.-Schr., 1999 Angefertigt am Max-Planck-Institut für Psychiatrie, München Als Datum der Einreichung ist der 20. Juli 1999 angegeben, als das der Verleihung der 6. November 2000. |
Literaturverz. |
nein |
| Fußnoten | nein |
| [6.] Quelle:Mek/Wotjak 1996 |
| Autor | Carsten Tobias Wotjak |
| Titel | Untersuchungen zur Vasopressin-Freisetzung in ausgewählten Kerngebieten des Rattengehirns unter besonderer Berücksichtigung des parvozellulären vasopressinergen Systems |
| Ort | München |
| Jahr | 1996 |
| Umfang | 96 S. |
| Anmerkung | München, Univ., Fak. f. Biologie, Diss., 1995 Angefertigt am Max-Planck-Institut für Psychiatrie, München |
Literaturverz. |
nein |
| Fußnoten | nein |
| [7.] Quelle:Mek/Droste 2003 |
| Autor | Susanne-Katrin Droste |
| Titel | Untersuchungen zu Änderungen der Hypothalamus-Hypophysen-Nebennierenrinden-Achse, des Schlafes und des Verhaltens bei Mäusen unter basalen und stressinduzierenden Bedingungen nach freiwilliger Benutzung eines Laufrades |
| Ort | München |
| Jahr | 2003 |
| Umfang | III, 131 S. |
| Anmerkung | München, Univ., Fak. f. Biologie, Diss., 2003 Angefertigt am Max-Planck-Institut für Psychiatrie, München Der Zeitpunkt der Vorlegung ist mit Februar 2003 angegeben, als Datum der mündlichen Prüfung der 17. Juni 2003. Das letzte Modifikationsdatum der PDF-Datei ist der 30. Juli 2003. |
| URL | https://edoc.ub.uni-muenchen.de/1156/1/droste_susanne.pdf |
Literaturverz. |
nein |
| Fußnoten | nein |
| [8.] Quelle:Mek/Landgraf 2003 |
| Autor | Rainer Landgraf |
| Titel | Neurobiologie und Genetik der Angst im Tiermodell |
| Zeitschrift | Der Nervenarzt |
| Ort | Berlin / Heidelberg |
| Verlag | Springer-Verlag |
| Datum | März 2003 |
| Jahrgang | 74 |
| Nummer | 3 |
| Seiten | 274-278 |
| Anmerkung | Der Aufsatz wurde unter demselben Titel in einer anderen Fassung ebenfalls im von Gerhard Roth und Uwe Opolka herausgegebenen Bd. 2 der Hanse-Studien: Angst, Furcht und ihre Bewältigung, ISBN 3-8142-0851-X, auf S. 39-47 veröffentlicht. Diese ist unter [2] auf dem Publikations-Server der Universität Oldenburg verfügbar. Die Übereinstimmungen der untersuchten Arbeit mit der in Der Nervenarzt veröffentlichten Fassung scheinen jedoch geringfügig größer zu sein. |
| DOI | https://doi.org/10.1007/s00115-002-1395-z |
Literaturverz. |
nein |
| Fußnoten | nein |
| [9.] Quelle:Mek/Ohl Landgraf 2000 |
| Autor | Frauke Ohl / Rainer Landgraf |
| Titel | Tiermodell Angst |
| Zeitschrift | Neuroforum |
| Ort | Heidelberg |
| Verlag | Spektrum Akademischer Verlag |
| Datum | September 2000 |
| Jahrgang | 6 |
| Nummer | 4 |
| Seiten | 263-268 |
| Anmerkung | Im Literaturverz. wird der Titel Ohl, F. & Landgraf, R. (2000) Animal models of anxiety. Neuroforum, 4, 257-262. aufgeführt. Ein englischsprachiger Aufsatz von Ohl & Landgraf ist jedoch zumindest in dieser Ausgabe der Zeitschrift nicht enthalten. |
| ISSN | 0947-0875 |
Literaturverz. |
nein |
| Fußnoten | nein |
| [10.] Quelle:Mek/Padberg et al 2003 |
| Autor | Frank Padberg / Peter Zwanzger / Rainer Rupprecht / Hans-Jürgen Möller / Martin E. Keck |
| Titel | Repetitive transkranielle Magnetstimulation (rTMS) des präfrontalen Kortex bei Depressionen |
| Zeitschrift | psychoneuro |
| Ort | Stuttgart |
| Verlag | Karl Demeter Verlag im Georg Thieme Verlag |
| Datum | Januar 2003 |
| Jahrgang | 29 |
| Nummer | 1 |
| Seiten | 44-50 |
| URL | https://www.thieme-connect.com/products/ejournals/pdf/10.1055/s-2003-37618.pdf |
Literaturverz. |
nein |
| Fußnoten | nein |
| [11.] Quelle:Mek/Ströhle 2003 |
| Autor | Andreas Ströhle |
| Titel | Die Neuroendokrinologie von Stress und die Pathophysiologie und Therapie von Depression und Angst |
| Zeitschrift | Der Nervenarzt |
| Ort | Berlin / Heidelberg |
| Verlag | Springer-Verlag |
| Datum | März 2003 |
| Jahrgang | 74 |
| Nummer | 3 |
| Seiten | 279-292 |
| DOI | https://doi.org/10.1007/s00115-002-1444-7 |
Literaturverz. |
nein |
| Fußnoten | nein |
| [12.] Quelle:Mek/Peller 2002 |
| Autor | Martin Peller |
| Titel | Erforschung der Auswirkungen der repetitiven fokalen transkraniellen Magnetstimulation (rTMS) auf den regionalen Glukosestoffwechsel mit Hilfe der Positronenemissionstomographie (PET) |
| Ort | München |
| Jahr | 2002 |
| Umfang | 90 S. |
| Anmerkung | München, Techn. Univ., Med. Fak., Diss., 2002 Angefertigt an der Neurologischen Klinik der TU München Eingereicht am 28.01.2002 und am 08.05.2002 durch die Fakultät angenommen Datum der mündlichen Prüfung: 02.07.2002 |
| URL | https://d-nb.info/965167607/34 https://mediatum.ub.tum.de/?id=602181 |
Literaturverz. |
nein |
| Fußnoten | nein |