68 gesichtete, geschützte Fragmente: Plagiat
| [1.] Slo/Fragment 001 16 - Diskussion Bearbeitet: 17. July 2014, 19:32 Hindemith Erstellt: 17. May 2014, 23:37 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 1, Zeilen: 16-26 |
Quelle: Schurek 2007 Seite(n): 1, Zeilen: 5ff |
|---|---|
| Um Stoffwechselendprodukte ausscheiden zu können, wird das Blut zunächst gefiltert, wobei der so genannte Primärharn entsteht. Dieser Primärharn wird in einem dem Filter nachgeschalteten Tubulussystem zu großen Teilen rückresorbiert. Die funktionellen Untereinheiten der Nieren sind Nephrone. Diese setzen sich aus dem Glomerulum, einem kapillaren Gefäßknäuel, und dem Tubulussystem mit den zugehörigen Blutgefäßen zusammen (Vgl. Abb. 1.1).
Das Glomerulum stellt die eigentliche Filtrationsbarriere für Proteine dar. Der Primärharn entsteht, indem das Blutplasma der Kapillaren in die Bowmannsche Kapsel abgepresst und von dort weiter in das Tubulussystem geleitet wird. Dabei werden innerhalb des Glomerulums drei Schichten passiert, die sich aus dem fenestrierten Endothel der Kapillaren, der glomerulären Basalmembran (GBM) und den Podozyten [zusammensetzen (Vgl. Abb.1.1).] |
Um Stoffwechselendprodukte ausscheiden zu können, wird das Blut zunächst gefiltert, wobei der so genannte Primärharn entsteht. Dieser Primärharn wird in einem dem Filter nachgeschalteten Tubulussystem zu großen Teilen rückresorbiert. Die funktionellen Untereinheiten der Nieren sind Nephrone. Diese setzen sich aus dem Glomerulum, einem kapillaren Gefäßknäuel, und dem Tubulussystem mit den zugehörigen Blutgefäßen zusammen (Vgl. Abb.1.1).
[...] Das Glomerulum stellt die eigentliche Filtrationsbarriere für Proteine dar. Der Primärharn entsteht, indem das Blutplasma der Kapillaren in die Bowmannsche Kapsel abgepresst und von dort weiter in das Tubulussystem geleitet wird. Dabei werden innerhalb des Glomerulums drei Schichten passiert, die sich aus dem fenestrierten Endothel der Kapillaren, der glomerulären Basalmembran (GBM) und den Podozyten zusammensetzen (Vgl. Abb.1.1). |
Ein Verweis auf die Quelle fehlt. |
|
| [2.] Slo/Fragment 002 01 - Diskussion Bearbeitet: 17. July 2014, 19:50 Hindemith Erstellt: 18. May 2014, 10:14 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 2, Zeilen: 1ff (komplett) |
Quelle: Schurek_2007 Seite(n): 1, 2, Zeilen: 1: Abbildung; 2: 1ff |
|---|---|
| Bei den Podozyten handelt es sich um viszerale Epithelzellen, die eine eindrucksvolle Zytoarchitektur aufweisen (Vgl. Abb. 1.2). Die primären Fußfortsätze der Podozyten teilen sich in sekundäre Fußfortsätze, welche reißverschlussgleich mit den Fußfortsätzen benachbarter Podozyten ineinander greifen. Zwischen diesen interdigitierenden sekundären Fußfortsätzen liegt die Schlitzmembran, ein hoch spezialisierter Zell-Zell-Kontakt.
Die Schädigung der Podozyten und der Schlitzmembran führt zu einem Funktionsverlust des Nierenfilters, der mit einer schweren Proteinurie einhergeht. Das daraus resultierende nephrotische Syndrom gehört zu den häufigsten klinischen Syndromen im Bereich der Nephrologie und ist gekennzeichnet durch eine erhöhte Eiweißausscheidung, Hyperlipidämie, Hypoalbuminämie und Ödeme. Dies findet sich im Wesentlichen bei drei definierten Krankheitsbildern: Minimal-change-Disease, membranöse Glomerulonephritis und fokale segmentale Glomerulonephritis (FSGS), welche alle durch eine Schädigung des Podozyten hervorgerufen werden und zu einer Verschmelzung der Fußfortsätze führen (Walz, 2003). Die Bemühungen, die molekularen Vorgänge innerhalb des Podozyten im Detail zu verstehen, haben deshalb während der letzten Dekade stark zugenommen. Ziel dieser Grundlagenforschung ist es, tiefere Einblicke in die Funktionsweise des Nierenfilters zu gewinnen. Abb. 1.1: Schematischer Aufbau der Säugerniere. Die Abbildung zeigt einen Querschnitt durch die Niere (links), ein heraus vergrößertes Glomerulum inklusive zu- und abführendem Gefäß und den sich anschließenden proximalen Tubulus (Mitte links). Weiter vergrößert stellt sich der Teil einer Kapillare mit aufliegenden Podozyten dar (Mitte rechts) sowie die Dreischichtung der glomerulären Filtrationsbarriere aus fenestriertem Endothel, glomerulärer Basalmembran (GBM) und Podozyten, zwischen deren Fußfortsätzen die Schlitzmembran ausgebildet wird (rechts) (Tryggvason et al., 2006). |
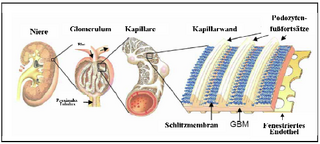
Abb. 1.1 Schematischer Aufbau der Säugerniere. Die Abbildung zeigt einen Querschnitt durch die Niere (links), ein heraus vergrößertes Glomerulum inklusive zu- und abführendem Gefäß und den sich anschließenden proximalen Tubulus (Mitte links). Weiter vergrößert stellt sich der Teil einer Kapillare mit aufliegenden Podozyten dar (Mitte rechts) sowie die Dreischichtung der glomerulären Filtrationsbarriere aus fenestriertem Endothel, glomerulärer Basalmembran (GBM) und Podozyten, zwischen deren Fußfortsätzen die Schlitzmembran ausgebildet wird (rechts) [106]. [...] Bei den Podozyten handelt es sich um viszerale Epithelzellen, die eine eindrucksvolle Zytoarchitektur aufweisen (Vgl. Abb. 1.2). Die primären Fußfortsätze der Podozyten teilen sich in sekundäre Fußfortsätze, welche reißverschlußgleich mit den Fußfortsätzen [Seite 2] benachbarter Podozyten ineinander greifen. Zwischen diesen interdigitierenden sekundären Fußfortsätzen liegt die Schlitzmembran, ein hoch spezialisierter Zell-Zell-Kontakt. Die Schädigung der Podozyten und der Schlitzmembran führt zu einem Funktionsverlust des Nierenfilters, der mit einer schweren Proteinurie einhergeht. Das daraus resultierende nephrotische Syndrom gehört zu den häufigsten klinischen Syndromen im Bereich der Nephrologie und ist gekennzeichnet durch eine erhöhte Eiweißausscheidung, Hyperlipidämie, Hypoalbuminämie und Ödeme. Dies findet sich im Wesentlichen bei drei definierten Krankheitsbildern: Minimal-change-Disease, membranöse Glomerulonephritis und fokale segmentale Glomerulonephritis (FSGS), welche alle durch eine Schädigung des Podozyten hervorgerufen werden und zu einer Verschmelzung der Fußfortsätze führen (Der Internist, Springer Verlag, 2003.44:1075-1082, G. Walz, Freiburg) [67]. Die Bemühungen, die molekularen Vorgänge innerhalb des Podozyten im Detail zu verstehen, haben deshalb innerhalb der letzten Dekade stark zugenommen. Ziel dieser Grundlagenforschung ist es, tiefere Einblicke in die Funktionsweise des Nierenfilters zu gewinnen. 106. Tryggvason K, Patrakka J, Wartiovaara J: Hereditary proteinuria syndromes and mechanisms of proteinuria. N Engl J Med 2006;354:1387-1401. |
Ein Verweis auf die Quelle fehlt. |
|
| [3.] Slo/Fragment 003 02 - Diskussion Bearbeitet: 17. July 2014, 19:50 Hindemith Erstellt: 18. May 2014, 18:47 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, Kriz 2006, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 3, Zeilen: 2ff (komplett) |
Quelle: Kriz 2006 Seite(n): 144, 146, 149, Zeilen: 144: 2. Spalte: letzte 4 Zeilen, 146: 1. Spalte: 5ff: 149: Abbildung |
|---|---|

Abb. 1.2: Rasterelektronenmikroskopisches Bild der Außenseite einer Glomeruluskapillare. Zu sehen ist ein Podozyt, von dessen Körper zunächst Primärfortsätze entspringen, die sich in die fingerförmigen Fußfortsätze aufspalten; zwischen letzteren erkennt man die Filtrationsschlitze. (Foto: Brunhilde Hähnel, Institut für Anatomie und Zellbiologie der Universität Heidelberg) 1.1.1 Podozyten und Schlitzmembran Podozyten bestehen aus einem großen Zellkörper und Fortsätzen, mit denen die Zellen an der GBM haften; die Zellkörper selbst berühren die GBM nicht, sie flottieren im Ultrafiltrat des Kapselraums (Abb. 1.2). Der Zellkern liegt nahe der dem Kapselraum zugewandten Zellmembran, der ausgedehnte „subnukleäre“ Zytoplasmaraum enthält den stark entwickelten Golgi-Apparat, ausgedehnte Areale aus rauem und glattem endoplasmatischen Retikulum und viele lysosomale Elemente. Vom Zellkörper ziehen zunächst kräftige Fortsätze (Primärfortsätze) zur GBM; dort spalten sie sich in die Fußfortsätze auf, die mit ihrer basalen Seite an der GBM haften. Diese in ihrer Form eher fingerförmigen Fortsätze (der Name Fußfortsatz bezieht sich auf das Schnittbild) interdigitieren sehr regelmäßig mit den Fußfortsätzen eines anderen Podozyten. Die interdigitierende Textur der Fußfortsätze bildet die äußere Schicht der Filtrationsbarriere (Abb. 1.3a). Die Verankerung der Fußfortsätze an der GBM erfolgt durch Integrine (α3/β1-Integrine, die an Laminin 5-2-1 binden) und durch Dystroglykan, das ebenfalls an Laminin 5-2-1 und an Agrin bindet (Raats et al., 2000; Regele et al., 2000). Integrine und Dystroglykan sind im Zytoplasma über Adaptermoleküle (Talin, Vinculin, Paxillin, Utrophin) mit dem Aktinfilamentsystem verknüpft. An dieser Stelle findet sich auch eine Integrin-assoziierte Kinase (Blattner & Kretzler, 2005). Dadurch wird einerseits eine mechanisch stabile und möglicherweise dynamische Verbindung zwischen GBM und Zytoskelett der Podozyten geschaffen, [andererseits ermöglichen diese Verbindungen ein „inside-out-“ und ein „outside-in-signalling“ und damit auch die Übertragung von mechanischen Signalen aus der GBM in die Fußfortsätze (Pavenstädt et al., 2003).] |
Zellaufbau
Podozyten bestehen aus einem großen Zellkörper und Fortsätzen, mit denen die Zellen an der GBM haften; die Zellkörper selbst berühren die GBM nicht, sie flottieren im Ultrafiltrat des Kapselraums (Abb. 3). Der Zellkern liegt nahe der dem Kapselraum zugewanden [sic] Zellmembran, der ausgedehnte „subnukleäre“ Zytoplasmaraum enthält den stark entwickelten Golgi-Apparat, ausgedehnte Areale aus rauem und glattem endoplasmatischen Retikulum und viele lysosomale Elemente. Vom Zellkörper ziehen zunächst kräftige Fortsätze (Primärfortsätze) zur GBM; dort spalten sie sich in die Fußfortsätze auf, die mit ihren „Sohlen“ an der GBM haften. Diese in ihrer Form eher fingerförmigen Fortsätze (der Name Fußfortsatz bezieht sich auf das Schnittbild) interdigitieren sehr regelmäßig mit den Fußfortsätzen eines anderen Podozyten. Die interdigitierende Textur der Fußfortsätze bildet die äußere Schicht der Filtrationsbarriere (Abb. 4). [Seite 146] Die Verankerung der Fußfortsätze in der GBM erfolgt durch Integrine (α3/β1- Integrine, die an Laminin 5-2-1 binden) und durch Dystroglykan, das ebenfalls an Laminin 5-2-1 und an Agrin bindet [28, 30]. Integrine und Dystroglykan sind im Zytoplasma über Adaptermoleküle (Talin, Vinculin, Paxillin, Utrophin) mit dem Aktinfilamentsystem verknüpft. An dieser Stelle findet sich auch eine integrinassoziierte Kinase [5]. Dadurch wird einerseits eine mechanisch stabile und möglicherweise dynamische Verbindung zwischen GBM und Zytoskelett der Podozyten geschaffen, andererseits ermöglichen diese Verbindungen ein „inside-out-“ und ein „outside-in-signalling“ und damit auch die Übertragung von mechanischen Signalen aus der GBM in die Fußfortsätze [27]. [Seite 149] Abb. 4 Rasterelektronenmikroskopisches Bild der Außenseite einer Glomeruluskapillare. Zu sehen ist ein Podozyt, von dessen Körper zunächst Primärfortsätze entspringen, die sich in die fingerförmigen Fußfortsätze aufspalten; zwischen letzteren erkennt man die Filtrationsschlitze. (Photo: Brunhilde Hähnel, Institut für Anatomie und Zellbiologie der Universität Heidelberg) 5. Blattner S, Kretzler M (2005) Integrin-linked kinase in renal disease: connecting cell-matrix interaction to the cytoskeleton. Curr Opin Nephrol Hypertens 14: 404–410 27. Pavenstadt H, Kriz W, Kretzler M (2003) Cell biology of the glomerular podocyte. Physiol Rev 83: 253– 307 28. Raats C, van den Born J, Bakker M et al. (2000) Expression of agrin, dystroglycan, and utrophin in normal renal tissue and in experimental glomerulopathies. Am J Pathol 156(5): 1749–1765 30. Regele H, Fillipovic E, Langer B et al. (2000) Glomerular expression of dystroglycans is reduced in minimal change nephrosis but not in focal segmental glomerulosclerosis. J Am Soc Nephrol 11(3): 403– 412 |
Ein Verweis auf die Quelle fehlt. |
|
| [4.] Slo/Fragment 004 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 19:06 (Hindemith) | Fragment, Gesichtet, Kriz 2006, SMWFragment, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 4, Zeilen: 1-26 |
Quelle: Kriz 2006 Seite(n): 146, 147, 149, Zeilen: 146: 2. Spalte: 5ff; 147: 1. Spalte: 20ff; 149: Abbildung |
|---|---|

Abb. 1.3: Transmissionselektronenmikroskopische Bilder. a) Glomeruluskapillare mit Mesangium (M), GBM, Porenendothel (E) und Podozytenschicht (P). Beachte, dass der Zellkörper des Podozyten nicht direkt auf der GBM aufsitzt, sondern sozusagen an seinen Fortsätzen hängend im Harnraum flottiert und b) Detailbild der Filtrationsbarriere bestehend aus dem Endothel mit offenen Poren, der GBM mit Lamina rara interna, Lamina densa und Lamina rara externa und der zwischen den Podozytenfüßchen ausgespannten Schlitzmembran. (Foto: Hiltraud Hosser, Institut für Anatomie und Zellbiologie der Universität Heidelberg) [Dadurch wird einerseits eine mechanisch stabile und möglicherweise dynamische Verbindung zwischen GBM und Zytoskelett der Podozyten geschaffen,] andererseits ermöglichen diese Verbindungen ein „inside-out-“ und ein „outside-in-signalling“ und damit auch die Übertragung von mechanischen Signalen aus der GBM in die Fußfortsätze (Pavenstädt et al., 2003). Zwischen den Fußfortsätzen bleiben mäandrierende Spalten offen, die sog. Filtrationsschlitze. Sie haben eine Tiefe von 300-500 nm und eine Breite von 30-40 nm. Diese Schlitze werden in der Tiefe von der ungefähr 4 nm dicken Schlitzmembran überbrückt (Abb. 1.3b, 1.4). Dies ist eine extrazelluläre Proteinstruktur mit einem außerordentlich regelmäßigen submikroskopischen Aufbau. Die Schlitzmembran ähnelt ultrastrukturell einer Adherensverbindung. An ihrem Aufbau sind die Proteine Nephrin, Neph1, 2 und 3, PCadherin und FAT beteiligt. Dies sind transmembranäre Proteine mit langen extrazellulären Domänen, von denen man annimmt, dass sie aus gegenüberliegenden Fußfortsätzen aufeinander zulaufen, sich überlappen und einander binden und dabei eine spezifische Porenstruktur die Schlitzmembran ausbilden. Der Aufbau der Schlitzmembran ähnelt einer Zonula adherens aus sich in der Mitte überlappenden, transmembranären Proteinen; dazu gehören bis zum heutigen Kenntnisstand die Proteine Nephrin, Podocin, CD2AP, ZO-1, Neph1-3, P-Cadherin, Densin-180 und FAT1/FAT2 (Ahola et al., 2003; Donoviel et al., 2001; Huber & Benzing, 2005; Ihalmo et al., 2003; Inoue et al., 2001; Kim et al., 2003; Reiser et al., 2000; Roselli et al., 2002; Sellin et al., 2002; Shih et al., 1999). |
Dadurch wird einerseits eine mechanisch stabile und möglicherweise dynamische Verbindung zwischen GBM und Zytoskelett der Podozyten geschaffen, andererseits ermöglichen diese Verbindungen ein „inside-out-“ und ein „outside-in-signalling“ und damit auch die Übertragung von mechanischen Signalen aus der GBM in die Fußfortsätze [27]. Zwischen den Fußfortsätzen bleiben mäandrierende Spalten offen, die sog. Filtrationsschlitze (Abb. 4). Sie haben eine Tiefe von 300-500 nm und eine Breite von 30-40 nm. Die Schlitze werden in der Tiefe von der 4 nm dicken Schlitzmembran überbrückt (Abb. 3b, 5). Dies ist eine extrazelluläre Proteinstruktur mit einem regelmäßigen submikroskopischen Aufbau. Die Schlitzmembran ähnelt ultrastrukturell einer Adherensverbindung. An ihrem Aufbau sind die Proteine Nephrin, Neph1,2 und 3, p-Cadherin und FAT beteiligt. Dies sind transmembranäre Proteine mit langen extrazellulären Domänen, von denen man annimmt, dass sie aus gegenüberliegenden Fußfortsätzen aufeinander zulaufen, sich überlappen und einander binden und dabei eine spezifische Porenstruktur der Schlitzmembran ausbilden; [...]
[Seite 147] Der Aufbau der Schlitzmembran ähnelt einer Zonula adherens aus sich in der Mitte überlappenden, transmembranären Proteinen; dazu gehören Nephrin, Neph1, 2 und 3, FAT1 und P-Cadherin. Über Adapterproteine (Catenine, ZO-1, Podocin, CD2AP) wird die Verbindung zum Aktinskelett hergestellt. [Seite 149] Abb. 3 Transmissionselektronenmikroskopische Bilder. a Glomeruluskapillare mit Mesangium (M), GBM, Porenendothel (E) und Podozytenschicht (P). Beachte, dass der Zellkörper des Podozyten nicht direkt auf der GBM aufsitzt, sondern sozusagen an seinen Fortsätzen hängend im Harnraum flottiert und b Detailbild der Filtrationsbarriere bestehend aus dem Endothel mit offenen Poren, der GBM mit Lamina rara interna, Lamina densa und Lamina rara externa und der zwischen den Podozytenfüßchen ausgespannten Schlitzmembran. (Photo: Hiltraud Hosser, Institut für Anatomie und Zellbiologie der Universität Heidelberg) 27. Pavenstadt H, Kriz W, Kretzler M (2003) Cell biology of the glomerular podocyte. Physiol Rev 83: 253– 307 |
Ein Verweis auf die Quelle fehlt. Siehe Slo/Fragment_005_00 für die Abb. 1.4. auf die im Text verwiesen wird. |
|
| [5.] Slo/Fragment 004 26 - Diskussion Bearbeitet: 17. July 2014, 19:51 Hindemith Erstellt: 18. May 2014, 20:20 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 4, Zeilen: 26-32 |
Quelle: Schurek 2007 Seite(n): 3, Zeilen: 17-25 |
|---|---|
| [...] dazu gehören bis zum heutigen Kenntnisstand die Proteine Nephrin, Podocin, CD2AP, ZO-1, Neph1-3, P-Cadherin, Densin-180 und FAT1/FAT2 (Ahola et al., 2003; Donoviel et al., 2001; Huber & Benzing, 2005; Ihalmo et al., 2003; Inoue et al., 2001; Kim et al., 2003; Reiser et al., 2000; Roselli et al., 2002; Sellin et al., 2002; Shih et al., 1999). An der direkten Überbrückung der Filtrationsschlitze sind dabei die Proteine Nephrin, Neph1-3, P-Cadherin und FAT1/FAT2 maßgeblich beteiligt (Vgl. Abb. 1.4). | Für deren Aufbau entscheidend sind bis zum heutigen Kenntnisstand die Proteine Nephrin, Podocin, CD2AP, ZO-1, Neph1-3, P-Cadherin, Densin-180 und FAT1/FAT2 [3;15;31;36;38;41;74;80;88;90]. An der direkten Überbrückung der Filtrationsschlitze sind dabei die Proteine Nephrin, Neph1-3, P-Cadherin und FAT1/FAT2 maßgeblich beteiligt (Vgl. Abb. 1.4 a).
3. Ahola H, Heikkila E, Astrom E, Inagaki M, Izawa I, Pavenstadt H, Kerjaschki D, Holthofer H: A novel protein, densin, expressed by glomerular podocytes. J Am Soc Nephrol 2003;14:1731-1737. 15. Donoviel DB, Freed DD, Vogel H, Potter DG, Hawkins E, Barrish JP, Mathur BN, Turner CA, Geske R, Montgomery CA, Starbuck M, Brandt M, Gupta A, Ramirez- Solis R, Zambrowicz BP, Powell DR: Proteinuria and perinatal lethality in mice 31. Huber TB, Benzing T: The slit diaphragm: a signaling platform to regulate podocyte function. Curr Opin Nephrol Hypertens 2005;14:211-216. 36. Ihalmo P, Palmen T, Ahola H, Valtonen E, Holthofer H: Filtrin is a novel member of nephrin-like proteins. Biochem Biophys Res Commun 2003;300:364-370. 38. Inoue T, Yaoita E, Kurihara H, Shimizu F, Sakai T, Kobayashi T, Ohshiro K, Kawachi H, Okada H, Suzuki H, Kihara I, Yamamoto T: FAT is a component of glomerular slit diaphragms. Kidney Int 2001;59:1003-1012. 41. Kim JM, Wu H, Green G, Winkler CA, Kopp JB, Miner JH, Unanue ER, Shaw AS: CD2-associated protein haploinsufficiency is linked to glomerular disease susceptibility. Science 2003;300:1298-1300. 74. Reiser J, Kriz W, Kretzler M, Mundel P: The glomerular slit diaphragm is a modified adherens junction. J Am Soc Nephrol 2000;11:1-8. 80. Roselli S, Gribouval O, Boute N, Sich M, Benessy F, Attie T, Gubler MC, Antignac C: Podocin localizes in the kidney to the slit diaphragm area. Am J Pathol 2002;160:131-139. 88. Sellin L, Huber TB, Gerke P, Quack I, Pavenstadt H, Walz G: NEPH1 defines a novel family of podocin interacting proteins. FASEB J 2003;17:115-117. 90. Shih NY, Li J, Karpitskii V, Nguyen A, Dustin ML, Kanagawa O, Miner JH, Shaw AS: Congenital nephrotic syndrome in mice lacking CD2-associated protein. Science 1999;286:312-315. |
Ein Verweis auf die Quelle fehlt. Alle zehn Literaturverweise sind identisch. |
|
| [6.] Slo/Fragment 005 00 - Diskussion Bearbeitet: 17. July 2014, 19:51 Hindemith Erstellt: 18. May 2014, 19:17 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, Kriz 2006, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 5, Zeilen: Abbildung |
Quelle: Kriz 2006 Seite(n): 150, Zeilen: Abbildung |
|---|---|

Abb. 1.4: Schema der Filtrationsbarriere. Zeichnung: Rolf Nonnenmacher, Institut für Anatomie und Zellbiologie der Universität Heidelberg. |

Abb. 5 Schema der Filtrationsbarriere. (Mod. nach [8]; Zeichnung: Rolf Nonnenmacher, Institut für Anatomie und Zellbiologie der Universität Heidelberg) 8. Endlich K, Kriz W, Witzgall R (2001) Update in podocyte biology. Curr Opin Nephrol Hypertens 10: 331–340 |
Es ist zwar deutlich gemacht, dass die Zeichnung nicht vom Autor angefertigt wurde, aber die Quelle ist nicht angegeben. Zudem ist die Abbildung auf dieser Seite Teil der Übernahme, die auf der Vorseite dokumentiert ist: Slo/Fragment_004_01. |
|
| [7.] Slo/Fragment 005 01 - Diskussion Bearbeitet: 17. July 2014, 19:51 Hindemith Erstellt: 18. May 2014, 20:29 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 5, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 3, 4, Zeilen: 3: 25ff - 4: 1ff |
|---|---|
| [Mutationen der Gene] dieser Schlitzmembrankomponenten können über die Schädigung der Podozyten zum nephrotischen Syndrom führen (Roselli et al., 2004; Tsukaguchi et al., 2002). Aus diesem Grund liegt der Fokus der nephrologischen Forschung verstärkt auf der Untersuchung der Schlitzmembranproteine und der Funktion der einzelnen Komponenten in dem Gesamtnetzwerk. Die Schlitzmembran ist der einzige Zell-Zell-Kontakt von Podozyten und weist Gemeinsamkeiten zu anderen Zell-Zell-Kontakten wie tight junctions oder adherens junctions auf (Lee et al., 2002; Reiser et al., 2000). Epitheliale tight junctions stellen nicht nur Barrieren dar, welche die apikobasale Zellpolarität aufrecht erhalten, sondern fungieren zusätzlich als regulatorische Organisationszentren, die Einfluss auf Zellwachstum, Proliferation und Differenzierungsprozesse nehmen (Lee et al., 2006). Neben diesen funktionellen Gemeinsamkeiten zu der Schlitzmembran wird in den Fußfortsätzen von Podozyten das tight junction-assoziierte Protein ZO-1 (Zonula Occludens-1) exprimiert (Schnabel et al., 1990). Die von der Schlitzmembran gebildeten interzellulären Filtrationsschlitze ähneln adherens junctions, die gleichermaßen Zellmembranen in einem vergleichbaren Abstand von 25 nm überbrücken. Adherens junctions dienen der Zell-Zell-Adhäsion und sind durch linker Proteine an das Aktin-Zytoskelett assoziiert. Die linker Proteine der Schlitzmembran sind unter anderem Catenine, ZO-1, CD2AP (CD2 associating protein), CASK und MAGI-2 (Lehtonen et al., 2005). | Mutationen der Gene dieser Schlitzmembrankomponenten können über die Schädigung der Podozyten zum nephrotischen Syndrom führen [81;107]. Aus diesem Grund liegt der Fokus der nephrologischen Forschung verstärkt auf der Untersuchung der Schlitzmembranproteine und
[Seite 4] der Funktion der einzelnen Komponenten in dem Gesamtnetzwerk. Die Schlitzmembran ist der einzige Zell-Zell-Kontakt von Podozyten und weist Gemeinsamkeiten zu anderen Zell- Zell-Kontakten wie tight junctions oder adherens junctions auf [49;74]. Epitheliale tight junctions stellen nicht nur Barrieren dar, welche die apikobasale Zellpolarität aufrecht erhalten, sondern fungieren zusätzlich als regulatorische Organisationszentren, die Einfluss auf Zellwachstum, Proliferation und Differenzierungsprozesse nehmen [49]. Neben diesen funktionellen Gemeinsamkeiten zu der Schlitzmembran wird in den Fußfortsätzen von Podozyten das tight junction-assoziierte Protein ZO-1 (Zonula Occludens-1) exprimiert [87]. Die von der Schlitzmembran gebildeten interzellulären Filtrationsschlitze ähneln adherens junctions, die gleichermaßen Zellmembranen in einem vergleichbaren Abstand von 25 nm überbrücken. Adherens junctions dienen der Zell-Zell-Adhäsion und sind durch linker Proteine an das Aktin-Zytoskelett assoziiert. Die linker Proteine der Schlitzmembran sind unter anderem Catenine, ZO-1, CD2AP (CD2 interacting protein), CASK und MAGI-2 (Vgl. 1.4 Zellpolarität, 1.6.1.1 WW-Domänen) [50]. 49. Lee DB, Huang E, Ward HJ: Tight junction biology and kidney dysfunction. Am J Physiol Renal Physiol 2006;290:F20-F34. 50. Lehtonen S, Ryan JJ, Kudlicka K, Iino N, Zhou H, Farquhar MG: Cell junctionassociated proteins IQGAP1, MAGI-2, CASK, spectrins, and alpha-actinin are components of the nephrin multiprotein complex. Proc Natl Acad Sci U S A 2005;102:9814-9819. 74. Reiser J, Kriz W, Kretzler M, Mundel P: The glomerular slit diaphragm is a modified adherens junction. J Am Soc Nephrol 2000;11:1-8. 81. Roselli S, Heidet L, Sich M, Henger A, Kretzler M, Gubler MC, Antignac C: Early glomerular filtration defect and severe renal disease in podocin-deficient mice. Mol Cell Biol 2004;24:550-560. 87. Schnabel E, Anderson JM, Farquhar MG: The tight junction protein ZO-1 is concentrated along slit diaphragms of the glomerular epithelium. J Cell Biol 1990;111:1255-1263. 107. Tsukaguchi H, Sudhakar A, Le TC, Nguyen T, Yao J, Schwimmer JA, Schachter AD, Poch E, Abreu PF, Appel GB, Pereira AB, Kalluri R, Pollak MR: NPHS2 mutations in late-onset focal segmental glomerulosclerosis: R229Q is a common disease-associated allele. J Clin Invest 2002;110:1659-1666. |
Ein Verweis auf die Quelle fehlt. |
|
| [8.] Slo/Fragment 006 01 - Diskussion Bearbeitet: 17. July 2014, 19:51 Hindemith Erstellt: 18. May 2014, 20:34 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 6, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 4, Zeilen: 15ff |
|---|---|

Abb. 1.5: Schematische Darstellung der Schlitzmembran (SD). Die SD ist ein spezialisierter Zell-Zell-Kontakt, der Bestandteil des glomerulären Filters der Nieren ist. Neben dieser Filterfunktion dient die SD als Plattform der Signaltransduktion und als regulatorisches Zentrum bei der Reorganisation des Aktin-Zytoskeletts (Benzing, 2004). Die Funktion des dynamischen Multiproteinkomplexes, der die Schlitzmembran aufbaut, ist nicht auf die Filtration beschränkt. Er dient des Weiteren als Plattform der Signaltransduktion und als regulatorisches Organisationszentrum bei Umstrukturierungen des Aktin-Zytoskeletts (Vgl. Abb. 1.5), (Benzing, 2004; Huber & Benzing, 2004). Die Fußfortsätze der Podozyten bilden keine statische Einheit; vielmehr handelt es sich um hoch dynamische Strukturen, die einen kontraktilen Apparat aus Aktin, Myosin-II, α-Aktinin-4, Talin und Vinculin beinhalten (Drenckhahn & Franke, 1988). Durch den Filtrationsfluss sind Podozyten Scherkräften ausgesetzt, die durch stetige Reorganisationen des Aktin-Zytoskeletts und die Verankerung in der GBM kompensiert werden (Endlich & Endlich, 2006; Endlich et al., 2001; Friedrich et al., 2006). Alle Formen des nephrotischen Syndroms resultieren durch Veränderungen des Zytoskeletts der Podozyten in einem charakteristischen Ablösen der Fußfortsätze. Im Zuge dieser pathologischen Veränderung verlieren die Podozyten ihre Fähigkeit, sich durch migratorische Prozesse entlang der GBM zu bewegen (Reiser et al., 2004). |

Abb. 1.4 b: Schematische Darstellung der Schlitzmembran (SD). Die SD ist ein spezialisierter Zell-Zell-Kontakt, der Bestandteil des glomerulären Filters der Nieren ist. Neben dieser Filterfunktion dient die SD als Plattform der Signaltransduktion und als regulatorisches Zentrum bei der Reorganisation des Aktin-Zytoskeletts [5]. Die Funktion des dynamischen Multiproteinkomplexes, der die Schlitzmembran aufbaut, ist nicht auf die Filtration beschränkt. Er dient des Weiteren als Plattform der Signaltransduktion und als regulatorisches Organisationszentrum bei Umstrukturierungen des Aktin-Zytoskeletts (Vgl. Abb. 1.4 b) [5;31]. Die Fußfortsätze der Podozyten bilden keine statische Einheit; vielmehr handelt es sich um hoch dynamische Strukturen, die einen kontraktilen Apparat aus Aktin, Myosin-II, α-actinin-4, Talin und Vinculin beinhalten [16]. Durch den Filtrationsfluss sind Podozyten Scherkräften ausgesetzt, die durch stetige Reorganisationen des Aktin- Zytoskeletts und die Verankerung in der GBM kompensiert werden [18;19;26]. Alle Formen des nephrotischen Syndroms resultieren durch Veränderungen des Zytoskeletts der Podozyten in einem charakteristischen Ablösen der Fußfortsätze. Im Zuge dieser pathologischen Veränderung verlieren die Podozyten ihre Fähigkeit, sich durch migratorische Prozesse entlang der GBM zu bewegen [75]. 5. Benzing T: Signaling at the slit diaphragm. J Am Soc Nephrol 2004;15:1382-1391. 16. Drenckhahn D, Franke RP: Ultrastructural organization of contractile and cytoskeletal proteins in glomerular podocytes of chicken, rat, and man. Lab Invest 1988;59:673- 682. 18. Endlich N, Endlich K: Stretch, tension and adhesion - adaptive mechanisms of the actin cytoskeleton in podocytes. Eur J Cell Biol 2006;85:229-234. 19. Endlich N, Kress KR, Reiser J, Uttenweiler D, Kriz W, Mundel P, Endlich K: Podocytes respond to mechanical stress in vitro. J Am Soc Nephrol 2001;12:413-422. 26. Friedrich C, Endlich N, Kriz W, Endlich K: Podocytes are sensitive to fluid shear stress in vitro. Am J Physiol Renal Physiol 2006;291:F856-F865. 31. Huber TB, Benzing T: The slit diaphragm: a signaling platform to regulate podocyte function. Curr Opin Nephrol Hypertens 2005;14:211-216. 75. Reiser J, Oh J, Shirato I, Asanuma K, Hug A, Mundel TM, Honey K, Ishidoh K, Kominami E, Kreidberg JA, Tomino Y, Mundel P: Podocyte migration during nephrotic syndrome requires a coordinated interplay between cathepsin L and alpha3 integrin. J Biol Chem 2004;279:34827-34832. |
Ein Verweis auf die Quelle fehlt. |
|
| [9.] Slo/Fragment 007 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 00:14 (Hindemith) | Fliegert 2006, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 7, Zeilen: 1ff (komplett) |
Quelle: Fliegert 2006 Seite(n): 4, 5, Zeilen: 4: 24ff; 5: 1ff |
|---|---|
| 1.2 Die TRP-Protein-Familie
1.2.1 Entdeckung Im Gegensatz zur Sehkaskade der Wirbeltiere, bei dem Transducin eine cGMP-spezifische Phosphodiesterase aktiviert, ist das Zielproteine für das lichtaktivierte Rhodopsin stimulierte G-Protein in Wirbellosen eine Phospholipase Cβ (Bloomquist et al., 1988). Während in den Stäbchen des Wirbeltierauges die Abnahme der cGMP-Konzentration nach Belichtung dazu führt, dass ein im Dunkeln offener CNG-Kanal („cyclic nucleotide gated“, Dunkelstrom) schließt, und die Membran hyperpolarisiert, führt Belichtung im Komplexauge von Insekten zur Öffnung eines Kanals und damit zur Depolarisation der Membran (Hardie & Raghu, 2001). Das Komplexauge der Drosophila Mutante trp ist im Gegensatz zum Wildtyp nicht in der Lage, bei Belichtung ein dauerhaftes Signal zu generieren. Das Rezeptorpotential ist transient, folglich die Bezeichnung „transient receptor potential“ (Cosens & Manning, 1969). Die trp-defizienten Fliegen werden durch intensives Licht geblendet, da der lang anhaltende Ca2+-Einstrom und damit die Adaptation ausbleiben. Obwohl diese Mutante bereits seit 1969 bekannt ist, wurde das Gen erst 1989 von Montell und Rubin kloniert (Montell & Rubin, 1989). Das von trp kodierte Protein weist acht hydrophobe Segmente auf. Hardie und Minke haben 1992 gezeigt, dass es sich bei Trp um einen indirekt durch Licht aktivierten Ca2+- permeablen Ionenkanal handelt. Unabhängig davon wurde ein CaMbindendes Protein aus dem Kopf-Bereich von Drosophila isoliert (Trp-like = Trpl), das eine hohe Homologie zu Trp aufwies und bei dem es sich ebenfalls um einen Kationenkanal handelt (Phillips et al., 1992). Im Gegensatz zu Trp handelt es sich bei Trpl um einen nicht-selektiven Kationenkanal. Während Trp für die lang anhaltende Depolarisation bei Dauerbelichtung verantwortlich ist, vermittelt Trpl die initiale Depolarisation, die im Elektroretinogramm der trp-Mutante beobachtet werden kann. Die Doppelmutation trp und trpl zeigt keine elektrische Antwort auf Belichtung mehr (Niemeyer et al., 1996). Sowohl Trp als auch Trpl sind homolog zu spannungsgesteuerten Na+- und Ca2+-Kanälen, ihnen fehlt jedoch die für die Spannungsregulation notwendigen positiv geladenen Aminosäuren in der Transmembranhelix S4. |
1.3 Die Superfamilie der TRP-Kanäle
1.3.1 Entdeckung Im Gegensatz zur Sehkaskade der Wirbeltiere, bei dem Transducin eine cGMP-spezifische Phosphodiesterase aktiviert, ist das Zielproteine für das lichtaktiviertes [sic] Rhodopsin stimulierte G-Protein in Wirbellosen eine Phospholipase Cβ (NorpA, Bloomquist et al., 1988). Während in den Stäbchen des Wirbeltierauges die Abnahme der cGMP-Konzentration nach Belichtung dazu führt, daß ein im Dunkeln offener CNG-Kanal (’cyclic nucleotide gated’, Dunkelstrom) schließt, und die Membran hyperpolarisiert, führt Belichtung im Komplexauge zur Öffnung eines Kanals und damit zur Depolarisation der Membran (Hardie und Raghu, 2001). Das Komplexauge der Drosophila Mutante trp ist im Gegensatz zum Wildtyp nicht in der Lage bei Belichtung ein dauerhaftes Signal zu generieren. Das Rezeptorpotential ist transient, folglich die Bezeichnung ’transient receptor potential’ (Cosens und Manning, 1969). [Seite 5] Die trp-defizienten Fliegen werden durch intensives Licht geblendet, da der langanhaltende Ca2+-Einstrom und damit die Adaptation ausbleiben. Obwohl diese Mutante bereits seit 1969 bekannt ist, wurde das Gen erst 1989 von Montell und Rubin kloniert (Montell und Rubin, 1989). Das von trp kodierte Protein weist acht hydrophobe Segmente auf. Hardie und Minke (1992) haben gezeigt, daß es sich bei Trp um einen (indirekt) durch Licht aktivierten Ca2+- permeablen Ionenkanal handelt. Unabhängig davon wurde ein CaM-bindendes Protein aus dem Kopf-Bereich von Drosophila isoliert (Trp-like = Trpl), das eine hohe Homologie zu Trp aufwies und bei dem es sich ebenfalls um einen Ionenkanal handelt (Phillips et al., 1992). Im Gegensatz zu Trp handelt es sich bei Trpl um einen nicht-selektiven Kationenkanal. Während Trp für die langanhaltende Depolarisation bei Dauerbelichtung verantwortlich ist, vermittelt Trpl die initiale Depolarisation, die im Elektroretinogramm der trp-Mutante beobachtet werden kann. Die Doppelmutation trp und trpl zeigt keine elektrische Antwort auf Belichtung mehr (Niemeyer et al., 1996). Sowohl Trp als auch Trpl sind homolog zu spannungsabhängigen Na+- und Ca2+-Kanälen, ihnen fehlt jedoch die für die Spannungsregulation notwendigen positiv geladenen Aminosäuren in der Transmembranhelix S4. |
Ein Verweis auf die Quelle fehlt. |
|
| [10.] Slo/Fragment 008 02 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 21:19 (Hindemith) | Burkert 2006, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 8, Zeilen: 2-8 |
Quelle: Burkert 2006 Seite(n): 8, 9, Zeilen: 8: 28-31 - 9: 1-3 |
|---|---|
| Die transient receptor potential-Kanäle stellen eine große Gruppe der verschiedenen Ionenkanäle dar, die für den Austausch von Ionen über die impermeable Plasmamembran aller Körperzellen zur gezielten Veränderung des Kationenhaushaltes verantwortlich sind. Obwohl es sich bei den TRP-Kanälen um Kationenkanäle mit hoher Sequenzhomologie und Strukturähnlichkeit handelt, variieren sie stark in ihrer Ionenselektivität und Art der Aktivierung (Montell et al., 2002). Sie werden sowohl in erregbaren als auch in nicht erregbaren Zellen exprimiert (Clapham et al., 2001). | Die transient receptor potential-Kanäle stellen eine große Gruppe der verschiedenen Ionenkanäle dar, die für den Austausch geladener Ionen über die impermeable Plasmamembran aller Körperzellen zur Aufrechterhaltung des intrazellulären Milieus verantwortlich sind. Obwohl es sich bei den TRP-Kanälen um Kationenkanäle mit hoher
[Seite 9] Sequenzhomologie und Strukturähnlichkeit handelt, variieren sie stark in ihrer Ionenselektivität und Art der Aktivierung (Montell et al., 2002). Sie werden sowohl in erregbaren als auch in nicht erregbaren Zellen exprimiert (Clapham et al., 2001). |
Ein Verweis auf die Quelle fehlt. |
|
| [11.] Slo/Fragment 008 09 - Diskussion Bearbeitet: 17. July 2014, 20:15 Hindemith Erstellt: 18. May 2014, 21:05 (Hindemith) | BauernOpfer, Flockerzi und Wissenbach 2005, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 8, Zeilen: 9-14 |
Quelle: Flockerzi und Wissenbach 2005 Seite(n): 620, 621, Zeilen: 620: 2. Spalte: 1ff; 621: Tabelle |
|---|---|
| Aufgrund struktureller Ähnlichkeit lassen sich die einzelnen TRP-Kanalproteine sieben Familien zuordnen (Tab. 1.1): Der TRPC („Canonical“)-Familie, der TRPV („Vanilloid“)-Familie, der TRPM („Melastatin“)-Familie, der TRPP („Polycystin“)- Familie, der TRPML („Mucolipin“)-Familie, der TRPA („Ankyrin“)-Familie und der TRPN („NOMPC“)-Familie. In Geweben von Säugern existieren Mitglieder aller Familien mit Ausnahme von TRPN.
Tab. 1.1: Die sieben TRP-Genfamilien mit Angabe der Zahl ihrer (publizierten) Mitglieder. In Hefe (Saccharomyces cerevisiae) wurde ein TRP-verwandtes Gen identifiziert, das aber keiner der sieben Familien zuzuordnen ist. Das TRPC2-Gen ist beim Menschen ein Pseudogen, weshalb die TRPC-Familie vom Mensch lediglich sechs, die von der Maus aber sieben Mitglieder umfasst (TRPC1 bis TRPC7). Die aufgeführten Gene wurden bisher in den Genomen von Drosophila melanogaster (Fliege), Caenorhabditis elegans (Wurm), Ciona intestinalis (Seescheide) bzw. Fugu rubripes (Kugelfisch) identifiziert. Anders als in Fugu wurden in Danio rerio (Zebrafisch) bisher zwei Mitglieder von TRPA und ein Mitglied von TRPN identifiziert (Flockerzi & Wissenbach, 2005). |
Aufgrund struktureller Ähnlichkeit lassen sich die einzelnen TRP-Kanalproteine sieben Familien zuordnen (Tab 1): Der TRPC(„ canonical“)-Familie, der TRPV(„Vanilloid“)- Familie, der TRPM(„Melastatin“)- Familie, der TRPP(„Polycystin“)-Familie, der TRPML(„Mucolipin“)-Familie, der TRPA(„Ankyrin“)-Familie und der TRPN(„ NOMPC“)-Familie. In Geweben von Säugern existieren Mitglieder aller Familien mit Ausnahme von TRPN.
[Seite 621] Tab. 1: Die sieben TRP-Genfamilien mit Angabe der Zahl ihrer (publizierten) Mitglieder. In Hefe (Saccharomyces cerevisiae) wurde ein TRP-verwandtes Gen identifiziert, das aber keiner der sieben Familien zuzuordnen ist. Das TRPC2-Gen ist beim Menschen ein Pseudogen, weshalb die TRPC-Familie vom Mensch lediglich sechs, die von der Maus aber sieben Mitglieder umfasst (TRPC1 bis TRPC7). Die aufgeführten Gene wurden bisher in den Genomen von Drosophila melanogaster (Fliege), Caenorhabditis elegans (Wurm), Ciona intestinalis (Seescheide) bzw. Fugu rubripes (Fisch) identifiziert. Anders als in Fugu wurden in Danio rerio (Zebrafisch) bisher zwei Mitglieder von TRPA und ein Mitglied von TRPN identifiziert. |
Die Quelle ist angegeben, aber der Verweis macht den Umfang und die Art der Übernahme nicht deutlich |
|
| [12.] Slo/Fragment 008 15 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 21:36 (Hindemith) | Brandenburger 2004, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 8, Zeilen: 15-19 |
Quelle: Brandenburger 2004 Seite(n): 12, Zeilen: 18-21 |
|---|---|
| Die ganze TRP-Familie gehört zur Überfamilie der nicht-selektiven Kationenkanäle. In dieser Familie finden sich ebenfalls spannungsabhängige K+-, Na+- und Ca2+-Kanäle, genauso wie durch zyklische Nukleotide beeinflusste (cyclic nucleotid gated, CNG) und durch Hyperpolarisation aktivierte Kanäle (hyperpolarisation activated cyclic nucleotide gated, HCN) (Benham et al., 2002). | Die ganze TRP-Familie gehört zur Überfamilie der nicht-selektiven Kationen-Kanäle. In dieser Familie finden sich ebenfalls spannungsabhängige K+-, Na+- und Ca2+-Kanäle, genauso wie durch zyklische Nukleotide beeinflusste (cyclic nucleotid gated, CNG) und durch Hyperpolarisation aktivierte, zyklische Nukleotidkanäle (HCN) (BENHAM et al. 2002). |
Ein Verweis auf die Quelle fehlt. |
|
| [13.] Slo/Fragment 009 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 22:01 (Hindemith) | Burkert 2006, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 9, Zeilen: 1-9 |
Quelle: Burkert 2006 Seite(n): 9, 10, Zeilen: 9: 25ff - 10: 1-2 |
|---|---|
| [Alle diese TRP-Kanäle verfügen über] sechs Transmembrandomänen. Zwischen dem fünften und sechsten Segment befindet sich eine hydrophobe Schleife, die dem Kanal die Funktion eines Selektivitätsfilters ermöglicht (Porenprinzip). C- und N-terminales Ende liegen intrazellulär. Je nach TRP-Subgruppe weist das N-terminale Ende eine unterschiedliche Anzahl von Ankyrin- Wiederholungen auf, wohingegen das C-terminale Ende über unterschiedlich Prolin-reiche Regionen verfügt (siehe Abb. 1.6). Die Größe der Proteine variiert von 500 Aminosäuren bei Mitgliedern der TRPC Familie bis zu 2000 Aminosäuren bei Mitgliedern der TRPM-Familie (Clapham et al., 2003; Minke & Cook, 2002; Montell, 2001). | Alle diese TRP-Kanäle verfügen über sechs Transmembrandomänen. Zwischen dem fünften und sechsten Segment befindet sich eine hydrophobe Schleife, die den Kanal mit Selektivitätsfilter bildet. C- und N-terminales Ende liegen intrazellulär. Je nach TRP-Subgruppe weist das N-terminale Ende eine verschiedene Anzahl von Ankyrin-Sequenzen auf, wohingegen das C-terminale Ende über unterschiedlich Prolin-reiche Regionen verfügt (Abbildung 1). Die Peptidlänge der Proteine variiert von 500 Aminosäuren bei Mitgliedern der TRPC-
[Seite 10] Familie bis zu 2000 Aminosäuren bei Mitgliedern der TRPM-Familie (Clapham, 2003; Minke et al., 2002; Montell, 2001). |
Ein Verweis auf die Quelle fehlt. |
|
| [14.] Slo/Fragment 010 01 - Diskussion Bearbeitet: 19. July 2014, 14:47 Singulus Erstellt: 18. May 2014, 22:10 (Hindemith) | Burkert 2006, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 10, Zeilen: 1ff (komplett) |
Quelle: Burkert 2006 Seite(n): 10, 11, Zeilen: 10: 3ff - 11: 1ff |
|---|---|
| Die Entdeckung der TRP-Familie als Ionenkanalproteine führte zu einem erweiterten molekularen Verständnis der Calcium-regulierten Signalübertragungsmechanismen. Folgende funktionelle Eigenschaften der TRP-Proteine tragen dazu bei (Clapham et al., 2003):
TRP-Kanäle sind nicht nur permeabel für monovalente, sondern auch für divalente Kationen wie Ca2+-, Ba2+-, und Mn2+-Ionen (Dietrich et al., 2005). Sie sind weniger selektiv für Calciumionen gegenüber Natriumionen mit PCa/PNa ≤ 10. Ausnahmen bilden TRPM4 und TRPM5, die ausschließlich selektiv für monovalente Kationen sind, sowie TRPV5 und TRPV6, die nur für Ca2+ mit PCa/PNa ≥ 100 durchlässig sind. Sie zeigen im Gegensatz zu spannungsabhängigen (voltage-gated) Calcium- oder Natriumkanälen keine Spannungsabhängigkeit, sondern depolarisieren die Zellen nach dem Öffnen vom jeweiligen Ruhepotential (bei den meisten Säugetierzellen um -70 mV) auf annährend 0 mV. Durch diese Depolarisation erhöhen sie den einwärtsgerichteten Ionenstrom und führen so zum Anstieg der intrazellulären Ca2+- und/oder Na+-Konzentration. Der initiale Öffnungsmechanismus der TRP-Kanäle ist uneinheitlich. Es existieren zwei mögliche Mechanismen, der Speicher-unabhängige und der Speicher-gesteuerte Öffnungsmechanismus. Beide wurden teilweise für dasselbe TRP-Protein beschrieben (Harteneck et al., 2000). Im Folgenden sollen die molekularen Mechanismen der Speicher-unabhängigen sowie der Speicher-gesteuerten Kanalöffnungsvorgänge gegenübergestellt werden: 1. Der Speicher-unabhängige (store-independent) Öffnungsmechanismus: Bei diesem Modell erfolgt die Aktivierung oder Modulation der TRP-Kanäle unabhängig von der Leerung intrazellulärer Calciumspeicher G-Protein- oder Tyrosinkinase-vermittelt, was zur Aktivierung der Phospholipase C (PLC) führt. PLC führt zur Spaltung von Phosphatidyl-Inositol-4, 5-Bisphosphat (PIP2) in Inositol-1, 4, 5-Trisphosphat (IP3) und Diacylglycerol (DAG). Beide dieser second messenger sind in der Lage, einerseits über Interaktion mit dem IP3-Rezeptor, andererseits direkt second-messenger-vermittelt TRP-Kanäle zu öffnen. Clapham DE, Montell C, Schultz G, Julius D (2003): „International Union of Pharmacology. XLIII. Compendium of voltage-gated ion channels: transient receptor potential channels.” Pharmacol Rev 55 (4): 591-596 Dietrich A, Mederos Y, Schnitzler M, Gollasch M, Gross V, Storch U, Dubrovska G, Obst M, Yildirim E, Salanova B, Kalwa H, Essin K, Pinkenburg O, Luft F, Gudermann T, Birnbaumer L (2005): „Increased vascular smooth muscle contractility in TRPC6-/-Mice.” Mol Cell Bio 25: 6980-6989 Harteneck C, Plant TD, Schultz G (2000): „From worm to man: three subfamilies of TRP channels.” Trends Neurosci 23: 159-166 |
Die Entdeckung der TRP-Familie als Ionenkanalproteine führte zu einem erweiterten molekularen Verständnis der Calcium-regulierten Signalübertragungsmechanismen. Folgende funktionelle Eigenschaften der TRP-Proteine tragen dazu bei (Clapham, 2003): TRP-Kanäle sind nicht nur permeabel für monovalente, sondern auch für divalente Kationen wie Ca2+-, Ba2+-, und Mn2+-Ionen (Dietrich et al., 2005). Sie sind wenig selektiv für Calciumionen gegenüber Natriumionen mit PCa/PNa ≤ 10. Ausnahmen bilden TRPM4 und TRPM5, die ausschließlich selektiv für monovalente Kationen sind sowie TRPV5 und TRPV6, die nur für Ca2+ mit PCa/PNa ≥ 100 durchlässig sind. Sie zeigen im Gegensatz zu spannungsabhängigen (voltage-gated) Calcium- oder Natriumkanälen keine Spannungsabhängigkeit, sondern depolarisieren die Zellen nach dem Öffnen vom jeweiligen Ruhepotential (bei den meisten Säugetierzellen um –70 mV) auf annährend 0 mV. Durch diese Depolarisation erhöhen sie den einwertsgerichteten [sic] Ionenstrom und führen so zum Anstieg der intrazellulären Ca2+- und/oder Na+-Konzentration. Der initiale Öffnungsmechanismus der TRP-Kanäle ist uneinheitlich. Es existieren zwei mögliche Mechanismen, der Speicher-unabhängige und der Speicher-gesteuerte Öffnungsmechanismus. Beide wurden teilweise für dasselbe TRP-Protein beschrieben (Harteneck et al., 2000). Im Folgenden sollen die
[Seite 11] molekularen Mechanismen der Speicher-unabhängigen sowie der Speicher-gesteuerten Kanalöffnungsvorgänge gegenüber gestellt werden: 1) Der Speicher-unabhängige (store-independent) Öffnungsmechanismus: Bei diesem Modell erfolgt die Aktivierung oder Modulation der TRP-Kanäle unabhängig von der Leerung intrazellulärer Calciumspeicher G-Protein- oder Tyrosinkinase-vermittelt, was zur Aktivierung der Phospholipase C (PLC) führt. PLC führt zur Spaltung von Phosphatidyl-Inositol-4,5-Bisphosphat (PIP2) in Inositol-1,4,5-Trisphosphat (IP3) und Diacylglycerol (DAG). Beide dieser Second Messenger sind in der Lage, einerseits über Interaktion mit dem IP3-Rezeptor, andererseits direkt Second-Messenger-vermittelt TRP-Kanäle zu öffnen. Clapham DE. TRP channels as cellular sensors. Nature. 2003;426:517-524. Dietrich A, Schnitzler M, Gollasch M, Gross V, Storch U, Dubrovska G, Obst M, Yildirim E, Salanova B, Kalwa H, Essin K, Pinkenburg O, Luft F, Gudermann T, Birnbaumer L. Increased vascular smooth muscle contractility in TRPC6-/-Mice. Molecular and Cellular Biology. 2005;25:6980-6989. Harteneck C, Plant TD, Schultz G. From worm to man: three subfamilies of TRP channels. Trends Neurosci. 2000;23:159-166. |
Ein Verweis auf die Quelle fehlt. Die Literaturangabe Clapham (2003) ist durch eine andere Arbeit desselben Autors mit demselben Erscheinungsjahr ausgetauscht. Die Quelle unterschlägt in der Autorenliste des Beitrags Dietrich et al. (2005) den Namen Y. Mederos des zweiten Autors. In der Quelle und in der untersuchten Arbeit wird nicht auf das Erratum derselben Autorengruppe zu diesem Aufsatz in Mol Cell Biol. 2005 Dec;25(24):11191 hingewiesen. In der Quelle und in der untersuchten Arbeit wird der Autor F. C. Luft zu F. Luft. |
|
| [15.] Slo/Fragment 011 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 22:17 (Hindemith) | Burkert 2006, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 11, Zeilen: 1-13, 18-22 |
Quelle: Burkert 2006 Seite(n): 11, Zeilen: 10ff |
|---|---|
| [Der genaue] Mechanismus ist unbekannt (Clapham et al., 2001; Hofmann et al., 1999; Minke & Cook, 2002; Montell, 2001).
2. Der Speicher-gesteuerte (store-operated) Öffnungsmechanismus: Bei diesem Modell kommt es zur Kanalaktivierung in Abhängigkeit vom Füllungszustand der intrazellulären Calciumspeicher (Birnbaumer et al., 1996; Putney, 1977; Putney & McKay, 1999). Folgende drei Theorien für den Mechanismus der Speicher-gesteuerten Kanalöffnung bestehen (Clapham, 2003; Putney & McKay 1999; Zitt et al., 2002): a. In der einen Theorie wird davon ausgegangen, dass ein Calcium Influx Factor (CIF) existiert, der bei Speicherentleerung freigesetzt wird, zur Plasmamembran diffundiert und dort die TRP-Kanäle aktiviert. b. Eine weitere Theorie beinhaltet das secretion-like coupling model, das besagt, dass ein TRP-Kanal in intrazellulären Vesikeln gespeichert vorliegt und dabei über einen IP3-Rezeptor des ER gebunden ist. Bei Entleerung des ER und der konsekutiven Aktivierung des IP3-Rezeptors werden die in Vesikeln vorliegenden TRP-Kanäle zur Plasmamembran transportiert, integriert und aktiviert. c. Die dritte Theorie, das conformation coupling model, besagt, dass Calciumspeicher und TRP-Kanal über den IP3-Rezeptor des ER miteinander verbunden sind. Bindet IP3 an den Rezeptor, wird gespeichertes Calcium freigesetzt und der TRP-Kanal erfährt eine Konformationsänderung, die zur Kanalöffnung und so zum Einstrom der Ionen über die Plasmamembran führt. |
Der genaue Mechanismus ist unbekannt (Clapham et al., 2001; Minke et al., 2002; Hofmann et al., 1999; Montell, 2001).
2) Der Speicher-gesteuerte (store-operated) Öffnungsmechanismus: Bei diesem Modell kommt es zur Kanalaktivierung in Abhängigkeit vom Füllungszustand der intrazellulären Calciumspeicher (Birnbaumer et al., 1996; Putney, 1977; Putney et al., 1999). Folgende drei Theorien für den Mechanismus der Speicher-gesteuerten Kanalöffnung bestehen (Clapham, 2003; Putney et al., 1999, Zitt et al. 2002): 1. In der einen Theorie wird davon ausgegangen, dass ein Calcium Influx Faktor (CIF) existiert, der bei Speicherentleerung freigesetzt wird, zur Plasmamembran diffundiert und dort die TRP-Kanäle aktiviert. 2. Eine weitere Theorie beinhaltet das Secretion-like coupling Model, das besagt, dass ein TRP-Protein über einen IP3-Rezeptor an den Calciumspeicher gebunden ist, bei Bindung von IP3 abgespalten wird, zur Plasmamembran diffundiert und dort als Kanal in diese eingebaut wird. 3. Die dritte Theorie, das conformation coupling model, besagt, dass Calciumspeicher und TRP-Kanal über einen IP3-Rezeptor miteinander verbunden sind. Bindet IP3 an den Rezeptor, wird Speichercalcium freigesetzt und der TRP-Kanal erfährt eine Konformationsänderung, die zur Kanalöffnung und so zum Einstrom der Ionen über die Plasmamembran führt. |
Ein Verweis auf die Quelle fehlt. Die Beschreibung der zweiten Theorie ist z.T. selbst formuliert und ging nicht in die Zeilenzählung mit ein. |
|
| [16.] Slo/Fragment 011 23 - Diskussion Bearbeitet: 17. July 2014, 19:51 Hindemith Erstellt: 18. May 2014, 21:40 (Hindemith) | Brandenburger 2004, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 11, Zeilen: 23-27 |
Quelle: Brandenburger 2004 Seite(n): 13, Zeilen: 13-17 |
|---|---|
| 1.2.3 Physiologische Bedeutung
Intrazelluläres Calcium dient als Vermittler bei einer Vielzahl von physiologischen Signalprozessen. Um dieser Rolle nachkommen zu können, müssen Aufnahme und Freisetzung eng kontrolliert werden. Hierbei spielt der Inositol-Lipid-Weg (PIP2-Kaskade), welcher zu den am weitesten verbreiteten Signalübertragungsprozessen [gehört, eine entscheidende Rolle.] |
2.4.3 Physiologische Bedeutung
Intrazelluläres Calcium dient als Vermittler bei einer Vielzahl von physiologischen Signalprozessen. Um dieser Rolle nachkommen zu können, müssen Aufnahme und Freisetzung eng kontrolliert werden. Hierbei spielt der Inositol-Lipid-Weg (PIP2-Kaskade), welcher zu den am weitesten verbreiteten Signalübertragungsprozessen gehört, eine entscheidende Rolle. |
Ein Verweis auf die Quelle fehlt. |
|
| [17.] Slo/Fragment 012 01 - Diskussion Bearbeitet: 17. July 2014, 19:51 Hindemith Erstellt: 18. May 2014, 21:43 (Hindemith) | Brandenburger 2004, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 12, Zeilen: 1ff (komplett) |
Quelle: Brandenburger 2004 Seite(n): 13, 14, Zeilen: 13: 19ff; 14: 1ff |
|---|---|
| Ausgehend von plasmamembranaler Rezeptoraktivierung kommt es über G-Protein vermittelte Phospholipase C-(PLC) Aktivität zu einer Spaltung von Phosphatidylinositol-4, 5-bisphosphat (PIP2) in das lösliche Inositol-1, 4, 5-trisphosphat (IP3) und das membrangebundene Diacylglycerin (DAG) (Berridge & Irvine, 1989). Der nachfolgende biphasische Anstieg der zytosolischen Ca2+-Konzentration beruht auf unterschiedlichen Vorgängen. Bei den sog. speicherabhängigen Ca2+-Kanälen, auch SOC-Kanäle (store operated calcium channels) genannt, vermittelt zunächst IP3 die Freisetzung von Calcium aus intrazellulären Speichern. In der Folge kommt es nun zu einem Einstrom über membrangebundene Calciumkanäle, welche durch die Entleerung dieser Speicher aktiviert werden. In nicht-erregbaren Zellen, wie den Epithelien des Verdauungstraktes, stellt dieser Weg den Hauptanteil der Ca2+-Aufnahme dar, während in erregbaren Zellen der Einstrom in der Regel über spannungsabhängige Ca2+-Kanäle stattfindet (Parekh & Penner, 1997). Speicherunabhängige Ca2+-Kanäle hingegen reagieren entweder auf den Anstieg des zytosolischen Calciums, z. B. auch durch, aber nicht aufgrund der Entleerung intrazellulärer Speicher, oder aber diese werden durch andere Signalkaskaden wie den DAG-Zweig des Inositol-Lipid-Weges aktiviert (Putney & McKay, 1999). Zurzeit sind die Proteine der TRP Familie die einzigen Inositol-vermittelten Calciumkanäle, welche sowohl speicherabhängige als auch speicherunabhängige Sensitivitäten beinhalten (Minke & Cook, 2002).
Die Abhängigkeit ihrer Aktivierung von der PLC ist für die TRP-Proteine der Säugetiere nur eingeschränkt gegeben. Während dieses für einige Kanäle, vor allem aus der TRPC-Familie, zutrifft, werden andere über Faktoren wie Hitze, Kälte oder Veränderungen des Zellvolumens aktiviert. Interessanterweise sprechen einzelne Kanäle dabei oft auf ein weites Spektrum unterschiedlichster Stimuli an (Montell et al., 2002a). Die eigentlichen Funktionsabläufe im Gewebe, an welchen die TRP-Kanäle direkt oder indirekt beteiligt sind, erweisen sich, soweit bereits bekannt, als ebenso vielfältig wie die Lokalisationen der Proteine im Körper. TRP-Kanäle sind in vielen Organen, hauptsächlich im Gehirn, aber auch in Herz, Lunge, Leber, Milz, Niere, Darm, Hoden, Prostata, Ovarien, Plazenta, Uterus und vaskulärem Gewebe nachgewiesen worden. |
Ausgehend von plasmamembranaler Rezeptoraktivierung kommt es über G-Protein-vermittelte Phospholipase C-(PLC-)Aktivität zu einer Spaltung von Phosphatidylinositol-4,5- bisphosphat (PIP2) in das lösliche Inositol-1,4,5-trisphosphat (IP3) und das membrangebundene Diacylglycerol (DAG) (BERRIDGE u. IRVINE 1989). Der nachfolgende biphasische Anstieg der zytosolischen Ca2+-Konzentration beruht auf unterschiedlichen Vorgängen. Bei den sog. speicherabhängigen Ca2+-Kanälen, auch SOC-Kanäle (store operated calcium channels) genannt, vermittelt zunächst IP3 die Freisetzung von Calcium aus intrazellulären Speichern. In der Folge kommt es nun zu einem Einstrom über membrangebundene Calciumkanäle, welche durch die Entleerung dieser Speicher aktiviert werden. In nicht-erregbaren Zellen, wie den Epithelien des Verdauungstraktes, stellt dieser Weg den Hauptanteil der Ca2+-Aufnahme dar, während in erregbaren Zellen der Einstrom in der Regel über spannungsabhängige Ca2+-Kanäle stattfindet (PAREKH u. PENNER 1997). Speicherunabhängige Ca2+-Kanäle hingegen reagieren entweder auf den Anstieg des zytosolischen Calciums, z. B. auch durch, aber nicht aufgrund der Entleerung intrazellulärer Speicher, oder aber diese werden durch andere Signalkaskaden wie den DAG-Zweig des
Inositol-Lipid-Weges aktiviert (PUTNEY u. MCKAY 1999). Zurzeit sind die Proteine der TRP-Familie die einzigen Inositol-vermittelten Calciumkanäle, welche sowohl speicherabhängige als auch speicherunabhängige Sensitivitäten beinhalten (MINKE u. COOK 2002). Die Abhängigkeit ihrer Aktivierung von der PLC ist für die TRP-Proteine der Säugetiere nur eingeschränkt gegeben. Während diese für einige Kanäle, vor allem aus der TRPC-Familie, zutrifft, werden andere über Faktoren wie Hitze, Kälte oder Veränderungen des Zellvolumens aktiviert. Interessanterweise sprechen einzelne Kanäle dabei oft auf ein weites Spektrum unterschiedlichster Stimuli an (MONTELL et al. 2002 a). Die eigentlichen Funktionsabläufe im Gewebe, an welchen die TRP-Kanäle direkt oder indirekt beteiligt sind, erweisen sich, soweit bereits bekannt, als ebenso vielfältig wie die Lokalisationen der Proteine im Körper. TRP-Kanäle sind in vielen Organen, hauptsächlich im Gehirn, aber auch in Herz, Lunge, Leber, Milz, Niere, Darm, Hoden, Prostata, Ovarien, Plazenta, Uterus und vaskulärem Gewebe nachgewiesen worden. |
Ein Verweis auf die Quelle fehlt. |
|
| [18.] Slo/Fragment 013 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 21:50 (Hindemith) | Brandenburger 2004, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 13, Zeilen: 1-11 |
Quelle: Brandenburger 2004 Seite(n): 14, Zeilen: 13ff |
|---|---|
| Dabei waren sie sowohl in neuronalen Zellen als auch in endothelialen, hämatopoetischen und epithelialen Zellen sowie in glatten Muskelzellen vertreten.
Während die klassischen Proteine TRP und TRPL bei der Phototransduktion von Drosophila melanogaster eine entscheidende Rolle spielen, sind z. B. TRPC2-Kanäle für die Signaltransduktion der Pheromonerkennung im Vomeronasalorgan und bei der Akrosomreaktion im Spermium einiger Säugetiere von Bedeutung (Liman et al., 1999; Jungnickel et al., 2001). Mitglieder der TRPV-Subfamilie sind beteiligt an Funktionen wie Hitze- und Schmerzperzeption (TRPV1 bis TRPV4), Osmorezeption (TRPV4) oder epithelialer Calciumaufnahme. TRPM-Proteine schließlich sind von potentieller Bedeutung bei der Regulation des Zellzyklus, für das Geschmacks- (TRPM5) oder Kälteempfinden (TRPM8) (Strotmann et al., 2000; Voets & Nilius, 2003). |
Dabei waren sie sowohl in neuronalen Zellen als auch in endothelialen und epithelialen Zellen sowie in glatten Muskelzellen vertreten.
Während die klassischen Proteine TRP und TRPL bei der Phototransduktion von Drosophila melanogaster eine entscheidende Rolle spielen, sind z. B. TRPC2-Kanäle für die Pheromonerkennung im Vomeronasalorgan und bei der Akrosomreaktion im Spermium einiger Säugetiere von Bedeutung (LIMAN et al. 1999; JUNGNICKEL et al. 2001). Mitglieder der TRPV-Subfamilie sind beteiligt an Funktionen wie Hitze- und Schmerzperzeption (TRPV1 bis TRPV4), Osmorezeption (TRPV4) oder epithelialer Calciumaufnahme. TRPM-Proteine schließlich sind von potentieller Bedeutung bei der Regulation des Zellzyklus, für das Geschmacks- (TRPM5) oder Kälteempfinden (TRPM8) (STROTMANN et al. 2000; VOETS u. NILIUS 2003). |
Ein Verweis auf die Quelle fehlt. |
|
| [19.] Slo/Fragment 013 13 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 22:22 (Hindemith) | Burkert 2006, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 13, Zeilen: 13-30 |
Quelle: Burkert 2006 Seite(n): 12, Zeilen: 3ff |
|---|---|
| Die menschliche TRP-Familie mit der größten Ähnlichkeit zu den Drosophila-TRPs ist die so genannte klassische TRPC-Subfamilie (canonical). Die TRPC-Gruppe ist die am häufigsten und bisher besten untersuchte TRP-Subgruppe und Schwerpunkt dieser Arbeit. Man unterscheidet vier Untergruppen anhand ihrer Sequenzhomologie und funktioneller Ähnlichkeiten: TRPC1; TRPC4, 5; TRPC3, 6, 7 und TRPC2 (Clapham et al., 2001; Vennekens et al., 2002).
TRPC1 ist das erste humane TRP-Protein, das identifiziert wurde und zeigt wie auch die folgenden TRP-Proteine ein ubiquitäres Vorkommen. Es konnte nachgewiesen werden, dass die Expression von TRPC1 alleine keine messbaren Ionenströme auslöst, sondern erst in Verbindung mit anderen TRPC-Proteinen. TRPC4, 5 beinhalten eine C-terminale Sequenz, die in anderen TRP-Molekülen nicht isoliert werden konnte und dafür spricht, [dass diese Kanäle Teile noch wenig verstandener multimolekularer Signalkomplexe sind.] |
Die menschliche TRP-Familie mit der größten Ähnlichkeit zu den Drosophila-TRPs ist die so genannte klassische TRPC-Subfamilie (Canonical). Die TRPC-Gruppe ist die am häufigsten und bisher besten untersuchte TRP-Subgruppe und Schwerpunkt dieser Arbeit. Man unterscheidet 4 Untergruppen anhand ihrer Sequenzhomologie und funktionellen Ähnlichkeiten: TRPC 1, TRPC 4,5, TRPC 3,6,7 und TRPC 2 (Clapham et al., 2001; Vennekens et al., 2002).
TRPC 1 ist das erste humane TRP-Protein, das identifiziert wurde und zeigt wie auch die folgenden TRP-Proteine ein ubiquitäres Vorkommen. Es konnte nachgewiesen werden, dass die Expression von TRPC1 alleine keine messbaren Ionenströme auslöst sondern erst in Verbindung mit anderen TRPC-Proteinen. TRPC 4, 5 beinhalten eine C-terminale Sequenz, die in anderen TRP-Molekülen nicht isoliert werden konnte und dafür spricht, dass diese Kanäle Teile noch wenig verstandener multimolekularer Signalkomplexe sind. |
Ein Verweis auf die Quelle fehlt. |
|
| [20.] Slo/Fragment 014 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 22:26 (Hindemith) | Burkert 2006, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 14, Zeilen: 1-18 |
Quelle: Burkert 2006 Seite(n): 12, Zeilen: 13ff |
|---|---|
| [TRPC4, 5 beinhalten eine C-terminale Sequenz, die in anderen TRP-Molekülen nicht isoliert werden konnte und dafür spricht,] dass diese Kanäle Teile noch wenig verstandener multimolekularer Signalkomplexe sind. TRPC3, 6, 7 zeigen eine besonders hohe Expression in glatten Muskelzellen und Herzmuskelzellen. Mit immunhistochemischen Verfahren sowie in situ-Hybridisierung konnte die Expression von TRPC1 sowie 3, 4, 5 und 6 in Endothelzellen sowie in glatten Gefäßmuskelzellen nachgewiesen werden, wohingegen TRPC7 sich nur in Endothelzellen zeigt (Yip et al., 2004). An Endothelzellen von TRPC6-knock-out-Mäusen stellte sich die besondere Funktion dieses Proteins bezüglich der Regulation des Gefäßtonus dar. Bei ausgeschaltetem TRPC6-Protein zeigte sich eine Hochregulation des TRPC3-Proteins. Damit einher ging ein Anstieg des basalen TRPC-abhängigen Kationeneinstromes, eine verstärkte Vasokonstriktion nach Agonistengabe sowie erhöhte Blutdruckwerte (Bergdahl et al., 2005; Dietrich et al., 2005). Diesbezüglich zeigten Liu et al. (2005) eine verstärkte Expression von TRPC3 in Monozyten hypertensiver Ratten.
TRPC2 ist das TRPC-Protein mit der geringsten Ähnlichkeit zu den anderen Mitgliedern dieser Proteingruppe. Es wurde als humanes Pseudogen eingeordnet (Vannier et al., 1999). In anderen, nicht-humanen Säugetierspezies wurde TRPC2 mit den Funktionen des Vomeronasalorganes und der Spermafunktion in Verbindung gebracht (Hofmann et al., 2000). |
TRPC 4, 5 beinhalten eine C-terminale Sequenz, die in anderen TRP-Molekülen nicht isoliert werden konnte und dafür spricht, dass diese Kanäle Teile noch wenig verstandener multimolekularer Signalkomplexe sind.
TRPC 3,6,7 zeigen eine besonders hohe Expression in glatten Muskelzellen und Herzmuskelzellen. Mit immunhistochemischen Verfahren sowie in situ-Hybridisation konnte die Expression von TRPC1 sowie 3, 4, 5 und 6 in Endothelzellen sowie in glatten Gefäßmuskelzellen nachgewiesen werden, wohingegen TRPC7 sich nur in Endothelzellen zeigt (Yip et al., 2004). An Endothelzellen von TRPC6-Knock-out- Mäusen stellte sich die besondere Funktion dieses Proteins bezüglich der Regulation des Gefäßtonus dar. Bei ausgeschaltetem TRPC6-Protein zeigte sich eine Hoch- Regulation des TRPC3-Proteins. Damit einher ging ein Anstieg des basalen TRPC-abhängigen Kationeneinstromes, eine verstärkte Vasokonstriktion nach Agonistengabe sowie erhöhte Blutdruckwerte (Dietrich et al., 2005; Bergdahl et al., 2005). Diesbezüglich zeigten Liu et al. (2005) eine verstärkte Expression von TRPC3 in Monozyten hypertensiver Ratten. TRPC2 ist das TRPC-Protein mit der geringsten Ähnlichkeit zu den anderen Mitgliedern dieser Proteingruppe. Es wurde als humanes Pseudogen eingeordnet (Vannier et al., 1999). In anderen, nicht-humanen Säugetierspezies wurde TRPC2 mit den Funktionen des Vomeronasalorganes und der Spermafunktion in Verbindung gebracht (Hofmann et al., 2000). |
Ein Verweis auf die Quelle fehlt. |
|
| [21.] Slo/Fragment 014 19 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 06:16 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 14, Zeilen: 19-31 |
Quelle: Schäfer 2004 Seite(n): 44, 45, Zeilen: 44: 30ff - 45: 1ff |
|---|---|
| 1.2.5 Aktivierung von TRPC-Kanälen
Neben einer Ca2+-abhängigen kompetitiven Regulation durch IP3-Rezeptoren und Calmodulin ist auch eine Steuerung durch andere Proteine denkbar, die das Signal vom Oberflächenrezeptor oder vom Ca2+-Speicher zum TRPC-Kanal leiten. Dazu können Adapterproteine ebenso wie das Aktin-Zytoskelett gehören, die eine korrekte Lokalisation der TRPC-Kanäle ermöglichen. In Drosophila Photorezeptoren bindet TRP an das Adapterprotein INAD („inactivation no after potential D“), das ebenfalls mit NORPA („no receptor potential A“), eine für Drosophila melanogaster spezifische PLCβ, interagiert, so dass die photorezeptorspezifische Phospholipase C, und das Kanalprotein TRP zusammengeführt werden, wobei zwei PDZ-Domänen von INAD mit NORPA und eine mit dem C-Terminus von TRP interagieren (van Huizen et al., 1998). Darüber hinaus gibt es Hinweise, dass der Rezeptor Rhodopsin, das gekoppelte G-Protein, der Effektor NORPA (PLCβ) und der [Kanal TRPC auf speziellen subzellulären Membrandomänen lokalisiert sind.] |
2.5.3 Einfluss des Cytoskeletts auf die Aktivierung von TRPC-Kanälen
Neben einer Ca2+-abhängigen kompetetiven Regulation durch IP3-Rezeptoren und Calmodulin ist auch eine Steuerung durch andere Proteine denkbar, die das Signal vom [Seite 45] Oberflächenrezeptor oder vom Ca2+-Speicher zum TRPC-Kanal leiten. Dazu können Adapterproteine ebenso wie das Actincytoskelett gehören, die eine korrekte Lokalisation der TRPC-Kanäle ermöglichen. In Drosophila Photorezeptoren bindet TRP an das Adapterprotein INAD („inactivation no after potential“), das ebenfalls mit NORPA interagiert, so dass die photorezeptorspezifische Phospholipase C, und das Kanalprotein TRP zusammengeführt werden, wobei zwei PDZ-Domänen von INAD mit NORPA und eine mit dem C-Terminus von TRP interagiert (Clapham, 1996; van Huizen et al., 1998). Darüber hinaus scheinen der Rezeptor Rhodopsin, das angekoppelte G-Protein, der Effektor NORPA und der Kanal TRP auf spezielle subzelluläre Membrandomänen beschränkt zu sein. |
Ein Verweis auf die Quelle fehlt. |
|
| [22.] Slo/Fragment 015 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 06:28 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 15, Zeilen: 1-32 |
Quelle: Schäfer 2004 Seite(n): 45, Zeilen: 10ff |
|---|---|
| Für G-Proteine wiederum liegen Hinweise auf eine direkte Interaktion mit Zytoskelettproteinen vor (van Huizen et al., 1998). Als erster Ansatz zur Untersuchung der Situation in Säugerzellen wurde die Bindung von TRPCs an das Drosophila Gerüstprotein INAD untersucht. Dabei war eine Ko-Immunpräzipitation mit TRPC1, 4 und 5 möglich, jedoch nicht mit TRPC3, 6 und 7. Eine Bindung an TRPC2 wurde nicht untersucht (Goel et al., 2002). Daher wurde vorgeschlagen, dass auch in Wirbeltieren PDZ-Domänen enthaltende Proteine eine Verbindungsstelle für die Bildung eines Signalkomplexes sowie für die korrekte Lokalisation von TRPC-Proteinen darstellen. TRPC4 und TRPC5 binden über ihren C-Terminus in HEK293 Zellen und im Gehirn erwachsener Mäuse an die erste PDZ-Domäne des Na+-H+-Austausch-regulierenden-Faktors („Na+-H+-exchange regulatory factor“, NHERF), welcher ebenfalls an die endogene PLCβ bindet. NHERF ist ein zwei PDZ-Domänen enthaltendes Protein, das mit dem Zytoskelett über Interaktionen mit Mitgliedern der Ezrin/Radixin/Moesin-Familie assoziiert ist. Es ist also möglich, das NHERF TRPC4- und TRPC5-enthaltende Kanäle mit PLCβ- Isoenzymen verbindet und beide mit dem Aktin-Zytoskelett verknüpft, wodurch die Verteilung und Regulation der Kanäle moduliert werden könnte (Tang et al., 2000). Die entfernt verwandten Ca2+-Kanalproteine TRPV5 und TRPV6 binden ebenfalls über eine konservierte Sequenz im C-Terminus spezifisch mit Hilfsproteinen, in diesem Fall Annexin2 und S100A10, die eine entscheidende Rolle beim Transport („routing“) von TRPV5 und TRPV6 zur Plasmamembran spielen (van de Graaf et al., 2003).
Auch der Zustand des Aktin-Zytoskeletts selbst hat einen Einfluss auf den IP3R-TRPC-Komplex. |
Für G-Proteine wiederum liegen Hinweise auf eine direkte Interaktion mit Cytoskelettproteinen vor (van Huizen et al., 1998). Als erster Ansatz wurde die Bindung an das Drosophila Gerüstprotein INAD untersucht. Dabei war eine Coimmunpräzipitation mit TRPC1, 4 und 5 möglich, jedoch nicht mit TRPC3, 6 und 7. Eine Bindung an TRPC2 wurde nicht untersucht (Goel et al., 2002). Daher wurde vorgeschlagen, dass auch in Wirbeltieren PDZ-Domänen enthaltende Proteine eine Verbindungsstelle für die Bildung eines Signalkomplexes sowie für die korrekte Lokalisation von TRPC-Proteinen anbieten. TRPC4 und TRPC5 binden über ihren C-Terminus in HEK293-Zellen und im Gehirn erwachsener Mäuse an die erste PDZ-Domäne des Na+-H+-Austausch-regulierenden- Faktors („Na+-H+-exchange regulatory factor“, NHERF), welcher ebenfalls an die endogene PLC-β bindet. NHERF ist ein zwei PDZ-Domänen-enthaltendes Protein, das mit dem Cytoskelett über Interaktionen mit Mitgliedern der Ezrin/Radixin/Moesin-Familie assoziiert. Es ist also möglich, das NHERF TRPC4- und TRPC5-enthaltende Kanäle mit PLCβ- Isoenzymen verbindet und beide mit dem Actincytoskelett verknüpft, wodurch die Verteilung und Regulation der Kanäle moduliert werden könnte (Tang et al., 2000). Die entfernt Ca2+- Kanalproteine TRPV5 und TRPV6 assoziieren ebenfalls über eine konservierte Sequenz im C-Terminus spezifisch mit Hilfsproteinen, in diesem Fall Annexin 2 und S100A10, die eine entscheidende Rolle beim Transport („routing“) von TRPV5 und TRPV6 zur Plasmamembran spielen (van de Graaf et al., 2003).
Auch der Zustand des Actincytoskeletts selbst hat einen Einfluss auf den IP3R-TRPC-Komplex. |
Ein Verweis auf die Quelle fehlt. |
|
| [23.] Slo/Fragment 016 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 06:36 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 16, Zeilen: 1-23 |
Quelle: Schäfer_2004 Seite(n): 45, 46, Zeilen: 45: 30ff - 46: 1ff |
|---|---|
| [Die Kopplung zwischen dem IP3RII mit hTRPC1 in Blutplättchen wurde] durch die Stabilisierung des kortikalen Aktin-Zytoskeletts verhindert, wohingegen die gleichen Reagenzien in HEK293-Zellen zur Internalisierung von hTRPC3 führten, die Bindung zum IP3R jedoch nicht beeinflussten (Lockwich et al., 2001; Rosado & Sage, 2001). Die Kopplung des IP3R an hTRPC1 in Blutplättchen fand nur statt, wenn die intrazellulären Ca2+-Speicher direkt oder durch Rezeptorstimulation entleert waren, und wurde durch Wiederauffüllen der Speicher gelöst (Rosado & Sage, 2001; Rosado et al., 2002). Verschiedene TRPC-Proteine werden also über verschiedene Mechanismen reguliert, wobei sich das Kopplungsmodell und das sekretionsähnliche Modell gegenseitig ergänzen anstatt ausschließen. Der Mechanismus kann darüber hinaus auch vom Zelltyp und spezifisch exprimierten Adaptermolekülen beeinflusst werden.
Die Interaktion zwischen dem IP3R und TRPC3 in HEK293-Zellen kann zwar durch eine Modifikation des Zytoskeletts nicht unterbunden werden, jedoch kommt es zur Internalisierung der TRPC3-IP3R-Komplexe nach Bildung einer festen Aktinschicht unter der Plasmamembran. Daher könnte es zu einer sekretionsähnlichen Aktivierung der Kationenströme kommen, indem die durch feste Bindung an den IP3R konstitutiv aktiven TRPC3-Kanäle nach Rezeptorstimulation in die Plasmamembran transportiert werden (Lockwich et al., 2001). Die verschiedenen Modelle zur Aktivierung rezeptorgesteuerter Ca2+-Kanäle sind demnach nicht strikt getrennt, sondern stellen Grenzfälle dar, für die es zahlreiche Mischfälle gibt. Je nachdem wie der TRPC-Kanal zusammengesetzt ist und wie stark die Bindung der beteiligten TRPC-Proteine an den IP3R, an CaM (Calmodulin), das Aktin-Zytoskelett und an Adapterproteine ist, können die resultierenden Kanäle auf unterschiedliche Weise reguliert werden, wobei verschiedene Wege sich überschneiden, ergänzen oder parallel verlaufen können. |
Die Kopplung zwischen dem IP3R II mit hTRPC1 in Blutplättchen wurde durch die Stabilisierung des kortikalen Actincytoskeletts verhindert, wohingegen die gleichen Reagenzien in HEK293-Zellen zur Internalisierung von hTRPC3 führten, die Bindung zum IP3R jedoch nicht beeinflussten (Rosado & Sage, 2001; Lockwich et al., 2001). Die Kopplung des IP3R an hTRPC1 in Blutplättchen fand nur statt, wenn die intrazellulären Ca2+-
[Seite 46] Speicher direkt oder durch Rezeptorstimulation entleert waren, und wurde durch Wiederauffüllen der Speicher gelöst (Rosado & Sage, 2001; Rosado et al., 2002). Verschiedene TRPC-Proteine scheinen also über verschiedene Mechanismen reguliert zu werden, wobei sich das Kopplungsmodell und des sekretionsähnliche Modell gegenseitig ergänzen anstatt auszuschließen. Der Mechanismus kann darüber hinaus auch vom Zelltyp und spezifisch exprimierten Adaptermolekülen beeinflusst werden. Die Interaktion zwischen dem IP3R und TRPC3 in HEK293-Zellen kann zwar durch eine Modifikation des Cytoskeletts nicht unterbunden werden, jedoch kommt es zur Internalisierung der TRPC3-IP3R-Komplexe nach Bildung einer festen Actinschicht unter der Plasmamembran. Daher könnte es zu einer sekretionsähnlichen Aktivierung der Kationenströme kommen, indem die durch feste Bindung an den IP3R konstitutiv aktiven TRPC3-Kanäle nach Rezeptorstimulation in die Plasmamembran transportiert werden (Lockwich et al., 2001). Die verschiedenen Modelle zur Aktivierung rezeptorgesteuerter Ca2+-Kanäle sind demnach nicht strikt getrennt, sondern stellen Grenzfälle dar, für die es zahlreiche Mischfälle gibt. Je nachdem wie der TRPC-Kanal zusammengesetzt ist und wie stark die Bindung der beteiligten TRPC-Proteine an den IP3R, an CaM, das Actincytoskelett und an Adapterproteine ist, können die resultierenden Kanäle auf unterschiedliche Weise reguliert werden, wobei verschiedene Wege sich überschneiden, ergänzen oder parallel verlaufen können. |
Ein Verweis auf die Quelle fehlt. |
|
| [24.] Slo/Fragment 019 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 19. May 2014, 06:57 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 19, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 9, Zeilen: 7ff |
|---|---|

Abb. 1.9: Dreidimensionale schematische Darstellung einer PDZ-Domäne (http://pawsonlab.mshri.on.ca/). 1.3 Das Protein PATJ Die ursprünglich entdeckte Proteinsequenz der murinen Variante von PATJ, CIPP (channel interacting PDZ domain protein), (Kurschner et al., 1998), beinhaltet vier so genannte PDZ-Domänen. Inzwischen ist bekannt, dass es sich bei der von Kurschner et al. 1998 gefundenen Sequenz um eine Verkürzungsmutante handelt und CIPP wie PATJ zehn PDZ-Domänen beinhaltet. PDZ-Domänen (DHRs, discs-large homology regions; GLGF repeats, Gly-Leu-Gly-Phe) sind Protein-Protein-Interaktionsmodule, die in der Sequenz von Gerüstproteinen vermehrt anzutreffen sind. Der Name dieser ca. 90 Aminosäuren langen Module leitet sich von Mitgliedern der MAGUK-Proteinfamilie ab, in denen sie erstmals beschrieben wurden: PSD-95 (postsynaptic density 95)/DLG (discs-large)/ZO- 1 (Ponting, 1997; Saras & Heldin, 1996). Die meisten der bisher bekannten Bindungsmotive von PDZ-Domänen bestehen aus den letzten vier C-terminalen Aminosäuren des Interaktionspartners, wobei Aminosäurereste bis hin zu Position -8 die Bindung beeinflussen können (Hung & Cheng, 2002; Kozlov et al., 2000; Niethammer et al., 1998; Songyang et al., 1997). Inzwischen sind auch interne Bindungsmotive von PDZ-Domänen bekannt (Penkert et al., 2004). Aufgrund der unterschiedlichen Bindungsspezifität wurden PDZ-Domänen in drei Gruppen klassifiziert (Vgl. Tab. 1.3) (Hung & Cheng, 2002). Tab. 1.3: Klassifizierung der PDZ-Domänen anhand der Konsensusbindungssequenz. AS: Aminosäure, X: unspezifische AS, Ф: hydrophobe AS (V, L, I) |

Abb. 1.9: Dreidimensionale schematische Darstellung einer PDZ-Domäne (http://pawsonlab.mshri.on.ca/). 1.5 Das Protein PATJ Die ursprünglich entdeckte Proteinsequenz der murinen Variante von PATJ, CIPP (Channel interacting PDZ domain protein, [46], beinhaltet vier so genannte PDZ-Domänen (Vgl. Abb. 1.9). Inzwischen ist bekannt, dass es sich bei der von Kurschner et al. 1998 gefundenen Sequenz um eine Verkürzungsmutante handelt und CIPP wie PATJ zehn PDZ-Domänen beinhaltet. PDZ-Domänen (DHRs, Discs-large homology regions; GLGF repeats, Gly-Leu-Gly-Phe) sind Protein-Protein-Interaktionsmodule, die in der Struktur von Gerüstproteinen vermehrt anzutreffen sind. Der Name dieser ca. 90 Aminosäuren beinhaltenden Module setzt sich aus Mitgliedern der MAGUK-Proteinfamilie zusammen, in denen diese erstmals beschrieben wurden: PSD-95 [Postsynaptic density]/DLG [Discslarge]/ ZO-1 [70;85]. Die meisten der bisher bekannten Bindungsmotive von PDZ-Domänen bestehen aus den letzten 4 C-terminalen Aminosäuren des Interaktionspartners, wobei Aminosäurereste bis hin zu Position -8 die Bindung beeinflussen können [32;43;63;95]. Inzwischen sind auch interne Bindungsmotive von PDZ-Domänen bekannt [69]. Aufgrund der unterschiedlichen Bindungsspezifität wurden PDZ-Domänen in drei Gruppen klassifiziert (Vgl. Tab. 1.1) [32]. Tab.1.1: Klassifizierung der PDZ-Domänen anhand der Konsensusbindungssequenz. AS: Aminosäure, X: unspezifische AS, Ф: hydrophobe AS (V, L, I) 32. Hung AY, Sheng M: PDZ domains: structural modules for protein complex assembly. J Biol Chem 2002;277:5699-5702. 43. Kozlov G, Gehring K, Ekiel I: Solution structure of the PDZ2 domain from human phosphatase hPTP1E and its interactions with C-terminal peptides from the Fas receptor. Biochemistry 2000;39:2572-2580. 46. Kurschner C, Mermelstein PG, Holden WT, Surmeier DJ: CIPP, a novel multivalent PDZ domain protein, selectively interacts with Kir4.0 family members, NMDA receptor subunits, neurexins, and neuroligins. Mol Cell Neurosci 1998;11:161-172. 63. Niethammer M, Valtschanoff JG, Kapoor TM, Allison DW, Weinberg RJ, Craig AM, Sheng M: CRIPT, a novel postsynaptic protein that binds to the third PDZ domain of PSD-95/SAP90. Neuron 1998;20:693-707. 69. Penkert RR, DiVittorio HM, Prehoda KE: Internal recognition through PDZ domain plasticity in the Par-6-Pals1 complex. Nat Struct Mol Biol 2004;11:1122-1127. 70. Ponting CP: Evidence for PDZ domains in bacteria, yeast, and plants. Protein Sci 1997;6:464-468. 85. Saras J, Heldin CH: PDZ domains bind carboxy-terminal sequences of target proteins. Trends Biochem Sci 1996;21:455-458. 95. Songyang Z, Fanning AS, Fu C, Xu J, Marfatia SM, Chishti AH, Crompton A, Chan AC, Anderson JM, Cantley LC: Recognition of unique carboxyl-terminal motifs by distinct PDZ domains. Science 1997;275:73-77. |
Ein Verweis auf die Quelle fehlt. |
|
| [25.] Slo/Fragment 020 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 19. May 2014, 07:02 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 20, Zeilen: 1-12 |
Quelle: Schurek 2007 Seite(n): 10, Zeilen: 1-11 |
|---|---|
| Die letzte Aminosäure des C-Terminus wird in allen drei Klassen durch einen hydrophoben Aminosäurerest wie Leucin, Valin oder Isoleucin dargestellt (Songyang et al., 1997).
Neben den zehn PDZ-Domänen besitzt PATJ mit einer N-terminalen L27-Domäne ein weiteres Protein-Protein-Interaktionsmodul. Jede L27-Domäne setzt sich aus drei Helices zusammen, die mit anderen L27-Domänen Heterodimere bildet und auf diese Weise zur Ausbildung multipler Proteinkomplexe beiträgt (Li et al., 2004). Da PATJ von entscheidender Bedeutung bei der Entwicklung von Zellpolarität ist (Shin et al., 2005; Shin et al., 2006), wurde in dieser Arbeitsgruppe ein Yeast Two-Hybrid Screen mit den letzten vier C-terminalen PDZ-Domänen der murinen Variante, CIPP, und einer humanen Podozyten cDNA Bank durchgeführt um potentielle Interaktionspartner identifizieren zu können. |
Die letzte Aminosäure des C-Terminus wird in allen drei Klassen durch einen hydrophoben Aminosäurerest wie Leucin, Valin oder Isoleucin dargestellt [95].
Neben den zehn PDZ-Domänen beinhaltet PATJ mit einer N-terminalen L27-Domäne ein weiteres Protein-Protein-Interaktionsmodul. Jede L27-Domäne setzt sich aus drei Helices zusammen, die mit anderen L27-Domänen Heterodimere bildet und auf diese Weise zur Ausbildung multipler Proteinkomplexe beiträgt [52]. Da PATJ von entscheidender Bedeutung bei der Entwicklung von Zellpolarität ist [91;92], wurde in dieser Arbeitsgruppe ein Yeast Two Hybrid Screen mit den letzten vier CTerminalen PDZ-Domänen der murinen Variante, CIPP, und einer humanen Podozyten cDNA Bank durchgeführt. Dabei konnte das Protein KIBRA als potentieller Interaktionspartner identifiziert werden. 52. Li Y, Karnak D, Demeler B, Margolis B, Lavie A: Structural basis for L27 domainmediated assembly of signaling and cell polarity complexes. EMBO J 2004;23:2723- 2733. 91. Shin K, Fogg VC, Margolis B: Tight junctions and cell polarity. Annu Rev Cell Dev Biol 2006;22:207-235. 92. Shin K, Straight S, Margolis B: PATJ regulates tight junction formation and polarity in mammalian epithelial cells. J Cell Biol 2005;168:705-711. 95. Songyang Z, Fanning AS, Fu C, Xu J, Marfatia SM, Chishti AH, Crompton A, Chan AC, Anderson JM, Cantley LC: Recognition of unique carboxyl-terminal motifs by distinct PDZ domains. Science 1997;275:73-77. |
Ein Verweis auf die Quelle fehlt. |
|
| [26.] Slo/Fragment 021 06 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 19. May 2014, 16:46 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schiffer und Haller 2006, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 21, Zeilen: 6-18 |
Quelle: Schiffer und Haller 2006 Seite(n): 1541, 1542, Zeilen: 1541: linke Spalte: 31ff; 1542: rechte Spalte: 3-5 |
|---|---|
| Bislang wird angenommen, dass es sich bei Podozyten um terminal entdifferenzierte Zellen handelt, die nicht effizient proliferieren können und somit ein Podozytenverlust nicht durch regenerative Zellteilung ausgeglichen werden kann. Bei der FSGS kommt es initial zu einer phänotypischen Dysregulation des Podozyten mit Verplumpung der Fußfortsätze, konsekutivem Verlust der Filtrationsschlitze („Effacement“) und letztlich zum fortschreitenden Zellverlust durch Ablösung von der glomerulären Basalmembran und Zelltod. Es gibt zahlreiche Hinweise aus dem Bereich der experimentellen Tiermodelle, die diese Dysregulation mit einem Verlust von Differenzierungsmarkern, Zellproliferation und Zelltod durch Apoptose in Verbindung bringen.
Die primäre, hereditäre FSGS ist eine häufige Ursache für das nephrotische Syndrom (NOS) im Erwachsenenalter. In der Literatur schwanken die Angaben zwischen 10–35% der biopsierten Fälle. Die ererbten Formen gehen mit einem steroid-resistenten NOS einher und führen rasch zur terminalen Niereninsuffizienz. |
Bislang wird angenommen, dass es sich bei Podozyten um terminal enddifferenzierte Zellen handelt, die nicht effizient proliferieren können und somit ein Podozytenverlust nicht durch regenerative Zellteilung ausgeglichen werden kann. Bei der FSGS kommt es initial zu einer phänotypischen Dysregulation des Podozyten mit Verplumpung der Fußfortsätze, konsekutivem Verlust der Filtrationsschlitze („Effacement“) und letztlich zum fortschreitenden Zellverlust durch Ablösung von der glomerulären Basalmembran und Zelltod. Es gibt zahlreiche Hinweise aus dem Bereich der experimentellen Tiermodelle, die diese Dysregulation mit einem Verlust von Differenzierungsmarkern, Zellproliferation und Zelltod durch Apoptose in Verbindung bringen.
[...] Die primäre FSGS ist eine häufige Ursache für das nephrotische Syndrom (NOS) im Erwachsenenalter. In der Literatur schwanken die Angaben zwischen 10–35% der biopsierten Fälle. [Seite 1542] Die ererbten Formen gehen mit einem steroid-resistenten NOS einher und führen rasch zur terminalen Niereninsuffizienz. |
Ein Verweis auf die Quelle fehlt. |
|
| [27.] Slo/Fragment 021 22 - Diskussion Bearbeitet: 17. July 2014, 19:57 Hindemith Erstellt: 18. May 2014, 09:58 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, Orphanet 2003, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 21, Zeilen: 22-31 |
Quelle: Orphanet 2003 Seite(n): 1 (internet Quelle), Zeilen: - |
|---|---|
| Die primäre intestinale Hypomagnesiämie mit sekundärer Hypocalcämie (HSH) oder hypomagnesiämische Tetanie ist durch sehr niedrige Mg2+- Serumspiegel, normale Mg2+-Ausscheidung in der Niere und Hypocalcämie charakterisiert. Es ist eine schwere Krankheit, die unbehandelt zum Tode führt. Als Ursache wird ein Defekt der Mg2+-Aufnahme im Darm angenommen. Die Neugeborenen leiden unter Unruhe, Zittern, Tetanie und Krampfanfällen. In einer Familie von blutsverwandten Beduinen wurde eine Kopplung der HSH mit Markern auf Chromosom 9q gefunden. Eine Patientin mit HSH und X-Autosom-Translokation hatte den autosomalen Bruchpunkt in 9q12-q22.2. Dieser HOMG-Lokus wurde durch Untersuchung weiterer Familien von ursprünglich 14 cM auf 1 cM eingeengt, bis durch [den Nachweis von Mutationen im TRPM6-Gen die Ursache gefunden war (Schlingmann et al., 2002; Walder et al., 2002).] | Die primäre intestinale Hypomagnesiämie mit sekundärer Hypokalzämie (HSH) oder Hypomagnesiämische Tetanie ist durch sehr niedrige Mg++-Serumspiegel, normale Mg++-Ausscheidung in der Niere und Hypokalzämie charakterisiert. Es ist eine schwere Krankheit, die unbehandelt zum Tode führt. Als Ursache wird ein Defekt der Mg++-Aufnahme im Darm angenommen. Die Neugeborenen leiden unter Unruhe, Zittern, Tetanie und Krampfanfällen. In einer Familie von blutsverwandten Beduinen wurde eine Kopplung der HSH mit Markern auf Chromosom 9q gefunden. Eine Patientin mit HSH und X-Autosom-Translokation hatte den autosomalen Bruchpunkt in 9q12-q22.2. Dieser HOMG-Lokus wurde durch Untersuchung weiterer Familien von ursprünglich 14 cM auf 1 cM eingeengt, bis durch den Nachweis von Mutationen im TRPM6-Gen die Ursache gefunden war (Schlingmann et al., 2002, Walder et al., 2002). |
Ein Verweis auf die Quelle fehlt. |
|
| [28.] Slo/Fragment 024 02 - Diskussion Bearbeitet: 17. July 2014, 20:15 Hindemith Erstellt: 19. May 2014, 16:09 (Hindemith) | BauernOpfer, Fragment, Gesichtet, Maier et al 2005, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 24, Zeilen: 2-5 |
Quelle: Maier et al 2005 Seite(n): 2637, 2638, Zeilen: 2637: 12ff; 2838: Abbildung |
|---|---|
| Die funktionelle Bedeutung, insbesondere der TRPC-Kanäle für die Endothelfunktion wird über ihre Ca2+-Permeabilität erklärt. Sie gelten als wichtige Regulatoren der Ca2+-abhängigen Synthese vasodilatierender Faktoren wie Stickstoffmonoxid und möglicherweise der EDHF-Signalgebung.
Abb. 1.11: Regulation der Endothelfunktion durch Ionenkanäle. cAMP = zyklisches Adenosinmonophsophat, cGMP = zyklische Guanosinmonophosphat, COX = Zyklooxygenase; DAG = Diazylglycerol; ER = endoplasmatisches Retikulum, EDHF = endotheliumderived hyperpolarising factor; IKCa1 und SKCa3 = Ca2+-aktitivierte Kaliumkanäle; IP3 = Inositoltrisphosphat; MSC = mechanosensitive Kationenkanäle; NOS = NO-Synthase, NO = Stickstoffmonoxid; PGI2 = Prostazyklin; TRPC = canonical TRP-Kanäle, TRPV = vanilloid TRP-Kanäle (Maier et al. 2005) |
Die funktionelle Bedeutung von TRP-Kanälen für die Endothelfunktion wird über ihre Ca2+-Permeabilität definiert. Sie gelten als wichtige Regulatoren der Ca2+-abhängigen Synthese vasodilatierender Faktoren wie Stickstoffmonoxid und möglicherweise der EDHF-Signalgebung.
[Seite 2638] Abb.1 Regulation der Endothelfunktion durch Ionenkanäle. cAMP=zyklisches Adenosinmonophosphat, cGMP=zyklisches Guanosinmonophosphat, COX=Zyklooxygenase; DAG=Diazylglyzerol, ER=endoplasmatisches Retikulum, EDHF=endothelium-derived hyperpolarising factor; IKCa1 und SKCa3: Ca2+-aktivierte Kaliumkanäle; IP3=Inositoltrisphosphat, MSC=mechanosensitive Kationenkanäle; NOS=NO-Synthase; TRPV=transient-receptor-potential- Kationenkanäle der Vanilloid-Rezeptorfamilie; NO=Stickstoffmonoxid; PGI2=Prostazyklin; TRPC=„kanonische“ transient-receptor-potential-Kationenkanäle. |
Auf die Quelle wird zwar verwiesen, aber nur für die Abbildung, nicht für den Text davor. |
|
| [29.] Slo/Fragment 035 01 - Diskussion Bearbeitet: 26. August 2014, 22:12 Hindemith Erstellt: 19. May 2014, 08:05 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 35, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 21, Zeilen: 1ff |
|---|---|
| 2.3.1 Home made ECL
Zur Analyse von Western Blots werden die benötigten Lösungen für die Peroxidasereaktion der verstärkten Chemilumineszenz (ECL, enhanced chemiluminescence) selbst hergestellt. Die Lösungen A und B sind bei 4°C zwei Tage stabil. Sie werden in einem Verhältnis von 1:1 zusammengegeben. Für eine PVDF-Membran ist ein Volumen von 1 ml Home made ECL ausreichend. Das lichtsensitive Luminol und die Coumaridinsäure werden in DMSO gelöst und aliquotiert bei -20°C gelagert. Tabelle 2.1 Home made ECL |
2.3.1 Home made ECL
Zur Analyse von Western Blots werden die benötigten Lösungen für die Peroxidasereaktion der verstärkten Chemilumineszenz (ECL, enhanced chemiluminescence) selbst hergestellt. Die Lösungen A und B sind bei 4°C zwei Tage stabil. Sie werden in einem Verhältnis von 1:1 zusammengegeben. Für eine PVDF-Membran ist ein Volumen von 1 ml Home made ECL ausreichend. Das lichtsensitive Luminol und die Coumaridinsäure werden in DMSO gelöst und aliquotiert bei -20°C gelagert. Tabelle 2.1 Home made ECL |
Ein Verweis auf die Quelle fehlt. |
|
| [30.] Slo/Fragment 048 01 - Diskussion Bearbeitet: 17. July 2014, 19:41 Hindemith Erstellt: 19. May 2014, 08:18 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 48, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 32, 33, Zeilen: 32: 1ff; 33: 1ff |
|---|---|
| 3. Methoden
3.1 Molekularbiologische Methoden Die Standard-Methoden wurden dem Handbuch „Molecular Cloning“ von J. Sambrook, E. F. Fritsch und T. Maniatis, Cold Spring Harbour Laboratory Press, 1989, entnommen und gegebenenfalls wie beschrieben modifiziert. Andere Quellen sind im Folgenden angegeben. 3.1.1 Konzentrationsbestimmung von Nukleinsäuren Die Konzentration von DNA bzw. RNA wird photometrisch durch die Messung der Absorption bei 260 nm bestimmt. Als Referenz dient das Lösungsmittel, in dem die Nukleinsäure in einer sinnvollen Verdünnung vorliegt. Eventuelle Verunreinigungen der Nukleinsäuren mit Protein werden durch den Quotienten der Absorption bei 260 nm und 280 nm überprüft. Der Quotient OD260nm/OD280nm sollte zwischen 1.7 und 2.1 liegen. 3.1.2 Polymerasekettenreaktion (PCR) (Mullis et al. 1986) Die Technik der Polymerasekettenreaktion (polymerase chain reaction) wird eingesetzt, um spezifische DNA-Abschnitte mithilfe eines Sets von zwei DNA-Oligonukleotiden (Primern) in einem Thermocycler zu amplifizieren. In Tabelle 3.3 sind nachfolgend verschiedene PCR-Bedingungen aufgelistet. Die amplifizierte DNA kann anschließend in einem Agarosegel durch elektrophoretische Auftrennung analysiert oder für eine Klonierung aufgereinigt werden. Die Reaktionsansätze für Sequenzierungsreaktionen werden nach erfolgter PCR im Sequenzierungslabor des Universitätsklinikum Münster abgeben und dort analysiert. |
3. Methoden
3.1 Molekularbiologische Methoden Die Standard-Methoden wurden dem Handbuch „Molecular Cloning“ von J. Sambrook, E. F. Fritsch und T. Maniatis, Cold Spring Harbour Laboratory Press, 1989, entnommen und gegebenenfalls wie beschrieben modifiziert. Andere Quellen sind im Folgenden angegeben. [...] 3.1.2 Konzentrationsbestimmung von Nukleinsäuren Die Konzentration von DNA bzw. RNA wird photometrisch durch die Messung der Absorption bei 260 nm bestimmt. Als Referenz dient das Lösungsmittel, in dem die Nukleinsäure in einer sinnvollen Verdünnung vorliegt. Eventuelle Verunreinigungen der Nukleinsäuren mit Proteinen werden durch den Quotienten der Absorption bei 260 nm und 280 nm überprüft. Der Quotient OD 260 nm/OD 280 nm sollte zwischen 1.7 und 2.1 liegen. [...] 3.1.4 Polymerasekettenreaktion (PCR) (Mullis et al. 1986[60]) Die Technik der Polymerasekettenreaktion (polymerase chain reaction) wird eingesetzt, um spezifische DNA-Abschnitte mithilfe eines Sets von zwei DNA-Oligonukleotiden (Primern) [Seite 33] in einem Thermocycler zu amplifizieren. In Tabelle 3.1 sind verschiedene verwendete PCR-Bedingungen aufgelistet. Die amplifizierte DNA kann anschließend in einem Agarosegel durch elektrophoretische Auftrennung analysiert oder für eine Klonierung aufgereinigt werden. Die Reaktionsansätze für Sequenzierungsreaktionen werden nach erfolgter PCR im Sequenzierungslabor des Universitätsklinikum Münster abgeben und dort analysiert. [...] |
Ein Verweis auf die Quelle fehlt. Tabelle 3.3 existiert in der untersuchten Arbeit nicht. Eine Tabelle 3.1. würde existieren, befindet sich aber auf Seite 56. |
|
| [31.] Slo/Fragment 049 01 - Diskussion Bearbeitet: 17. July 2014, 20:38 WiseWoman Erstellt: 19. May 2014, 08:26 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 49, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 33, 34, Zeilen: 33: 6ff; 34: 8ff |
|---|---|
| 3.1.3 Restriktionsanalyse
Es werden 250 ng bis 1 μg DNA mit 1 bis 4 U der entsprechenden Restriktionsendonuklease mit dem für diese vorgesehenen Puffer versetzt und nach Angaben des Herstellers behandelt. Üblicherweise wird der Restriktionsansatz für 1 h bei 37 °C inkubiert und anschließend für 10 Min bei 70 °C hitzeinaktiviert. 3.1.4 Agarose-Gelelektrophorese (McDonell et al. 1977) Die elektrophoretische Auftrennung von DNA-Fragmenten erfolgt in Agarosegelen (0.5-2 % w/v Agarose in 1x TAE-Puffer) mit 0.005 % Ethidiumbromidlösung bei 100-130 V. 3.1.5 Aufreinigung von DNA-Fragmenten Zur Aufreinigung von DNA-Fragmenten oder PCR-Reaktionslösungen aus Agarosegelen wird das Gel Extraction Kit® und das PCR Purification Kit® von Qiagen nach Herstellerangaben verwendet. Dazu wird die Probe (verdaute Insert- oder Vektor-DNA bzw. PCR-Ansatz) in einem Agarosegel elektrophoretisch aufgetrennt und anschließend auf einem UV-Tisch aus dem Gel geschnitten. Die erfolgreiche Aufreinigung der DNA wird durch erneutes Auftragen eines Aliquots der Gel eluierten DNA verifiziert, wobei gleichzeitig eine Abschätzung der DNA-Menge erfolgt. 3.1.6 Ligation von DNA-Fragmenten Um DNA-Fragmente zu klonieren werden die aus Agarosegelen aufgereinigte Insert-DNA und Vektor-DNA in einem Mol-Verhältnis von 1:3 (bei kohäsiven Enden) in einem Volumen von 20 μl mit 2 U T4-DNA-Ligase und einer entsprechenden Menge T4-Ligase-Puffer versetzt und über Nacht bei 16 °C inkubiert. Anschließend wird der Bakterien-Stamm DH5α mit der Ligationsreaktion transformiert. 3.1.7 Plasmidpräparation Um eine erfolgreiche Klonierung sicher zu stellen, werden einzelne Klone der transformierten Bakterien in Flüssigkultur (LB-Medium mit entsprechendem Antibiotikum) angeimpft und O/N bei 37 °C und 250 rpm inkubiert. |
3.1.5 Restriktionsanalyse
Es werden 250 ng bis 1 μg DNA mit 1 bis 4 U der entsprechenden Restriktionsendonuklease mit dem für diese vorgesehenen Puffer versetzt und nach Angaben des Herstellers behandelt. Üblicherweise wird der Restriktionsansatz für 1 h bei 37°C inkubiert und anschließend für 10 Min bei 70°C hitzeinaktiviert. [Seite 34] 3.1.7 Agarose-Gelelektrophorese (McDonell et al. 1977)[57] Die elektrophoretische Auftrennung von DNA-Fragmenten erfolgt in Agarosegelen (0.5 - 2 % w/v Agarose in 1 x TAE-Puffer) mit 0.005 % Ethidiumbromidlösung bei 100-130 V. 3.1.8 Aufreinigung von DNA-Fragmenten Zur Aufreinigung von DNA-Fragmenten oder PCR-Reaktionslösungen aus Agarosegelen wird das Wizard® SV Gel and PCR Clean-Up System von Promega nach Herstellerangaben verwendet. Dazu wird die Probe (verdaute Insert- oder Vektor-DNA bzw. PCR-Ansatz) in einem Agarosegel elektrophoretisch aufgetrennt und anschließend auf einem UV-Tisch aus dem Gel geschnitten. Die erfolgreiche Aufreinigung der DNA wird durch erneutes Auftragen eines Aliquots der Gel eluierten DNA verifiziert, wobei gleichzeitig eine Abschätzung der DNA-Menge erfolgt. 3.1.9 Ligation von DNA-Fragmenten Um DNA-Fragmente zu klonieren, werden die aus Agarosegelen aufgereinigte Insert-DNA und Vektor-DNA in einem Mol-Verhältnis von 1:3 (bei kohäsiven Enden) in einem Volumen von 20 μl mit 2 U T4-DNA-Ligase und einer entsprechenden Menge T4-Ligase-Puffer versetzt und für 2 h bei RT inkubiert. Anschließend wird der Bakterien-Stamm DH5α mit der Ligationsreaktion transformiert (Methoden, 3.3.3.2). 3.1.10 Plasmidpräparation Um eine erfolgreiche Klonierung sicher zu stellen, werden einzelne Klone der transformierten Bakterien in Flüssigkultur (LB-Medium mit entsprechendem Antibiotikum) angeimpft und O/N bei 37°C und 250 rpm inkubiert. [...] |
Ein Verweis auf die Quelle fehlt. |
|
| [32.] Slo/Fragment 050 01 - Diskussion Bearbeitet: 17. July 2014, 20:37 WiseWoman Erstellt: 19. May 2014, 08:30 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 50, Zeilen: 1-4, 9-24 |
Quelle: Schurek 2007 Seite(n): 34, 35, Zeilen: 34: letzte Zeile - 35: 1ff |
|---|---|
| [Die] Plasmidpräparation erfolgt nach Angaben des Herstellers (Wizard® Plus SV Minipreps, Promega). Die aufgereinigten Plasmide werden einer Restriktionsanalyse unterzogen. Zeigen die DNA-Fragmente die erwarteten Größen, schließt sich eine Sequenzierung dieser positiven Klone an.
[...] 3.1.9 Plasmidpräparation mit STET-Puffer Neben den kommerziellen Reaktionspaketen (Kits) bieten sich so genannte „Quick and Dirty“-Methoden an, um den Erfolg einer Klonierung im größeren Maßstab kostengünstig zu untersuchen. Dabei werden die Bakterienzellen analog zu den Reagenzien eines Kits zunächst lysiert. Es folgt eine alkoholische Fällung der Plasmid- DNA, die anschließend in einem basischen Puffer gelöst und durch Restriktionsanalyse untersucht wird. Von 5 ml O/N Kulturen wird pro Ansatz ca. 1 ml in ein 1.5 ml Reaktionsgefäß überführt und für 30 Sek bei 10 000 rpm zentrifugiert. Das entstandene Pellet wird in 480 μl STET-Puffer mit 20 μl Lysozym (10 mg/ml) resuspendiert und für 5 Min bei RT inkubiert. Anschließend wird für 5 Min bei 95 °C inkubiert und für 15 Min bei RT und 14 000 rpm zentrifugiert. Das entstandene Pellet wird entfernt und der Überstand mit 500 μl Isopropanol versetzt und vermischt. Nach einer Zentrifugation für 15 Min bei RT und 14 000 rpm wird der Überstand entfernt und das entstandene Pellet in 50 μl 10 mM Tris/HCl pH 8 resuspendiert. Zu dem folgenden Restriktionsverdau wird zusätzlich 100 μg/ml RNase A gegeben. |
Die Plasmidpräparation erfolgt nach Angaben des
[Seite 35] Herstellers (Wizard® Plus SV Minipreps, Promega). Die aufgereinigten Plasmide werden einer Restriktionsanalyse unterzogen. Zeigen die DNA-Fragmente die erwarteten Größen, schließt sich eine Sequenzierung (Tab.3.1 PCR-Bedingungen) dieser positiven Klone an. 3.1.11 Plasmidpräparation mit STET-Puffer Neben den kommerziellen Reaktionspaketen (Kits) bieten sich so genannte „Quick and Dirty“-Methoden an, um den Erfolg einer Klonierung im größeren Maßstab kostengünstig zu untersuchen. Dabei werden die Bakterienzellen analog zu den Reagenzien eines Kits zunächst lysiert. Es folgt eine alkoholische Fällung der Plasmid-DNA, die anschließend in einem basischen Puffer gelöst und durch Restriktionsanalyse untersucht wird. Von 5 ml O/N Kulturen wird pro Ansatz ca. 1 ml in ein 1.5 ml Reaktionsgefäß überführt und für 30 Sek bei 10.000 rpm zentrifugiert. Das entstandene Pellet wird in 480 μl STET-Puffer mit 20 μl Lysozym (10 mg/ml) resuspendiert und für 5 Min bei RT inkubiert. Anschließend wird für 5 Min bei 95°C inkubiert und für 15 Min bei RT und 14.000 rpm zentrifugiert. Das entstandene Pellet wird entfernt und der Überstand mit 500 μl Isopropanol versetzt und vermischt. Nach einer Zentrifugation für 15 Min bei RT und 14.000 rpm wird der Überstand entfernt und das entstandene Pellet in 50 μl 10 mM Tris/HCl pH 8 resuspendiert. Zu dem folgenden Restriktionsverdau wird zusätzlich 100 μg/ml RNase A gegeben. |
Ein Verweis auf die Quelle fehlt. |
|
| [33.] Slo/Fragment 050 05 - Diskussion Bearbeitet: 17. July 2014, 20:36 WiseWoman Erstellt: 18. May 2014, 07:02 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo |
|
|
| Untersuchte Arbeit: Seite: 50, Zeilen: 5-8 |
Quelle: Schäfer_2004 Seite(n): 73, Zeilen: 3-6 |
|---|---|
| 3.1.8 Plasmidpräparation über Ionenaustauschersäulen
Zur Isolierung hochreiner Plasmid-DNA für Sequenzierungen oder Transfektionen wurden käuflich erworbene Maxi-, Midi- und Minipräparations-„Kits“ der Firmen Macherey-Nagel oder Qiagen bezogen und nach Herstellerangaben verwendet. |
6.1.14 Plasmidpräparation über Ionenaustauschersäulen
Zur Isolierung hochreiner Plasmid-DNA für Sequenzierungen oder Transfektionen wurden käuflich erworbene Maxi-, Midi- und Minipräparations-„Kits“ der Firmen Macherey-Nagel oder Qiagen bezogen und nach Herstellerangaben verwendet. |
Ein Verweis auf die Quelle fehlt. |
|
| [34.] Slo/Fragment 050 25 - Diskussion Bearbeitet: 17. July 2014, 20:36 WiseWoman Erstellt: 18. May 2014, 07:06 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo |
|
|
| Untersuchte Arbeit: Seite: 50, Zeilen: 25-29 |
Quelle: Schäfer_2004 Seite(n): 73, Zeilen: 7-12 |
|---|---|
| 3.1.10 Fällen von DNA
Die zu fällende DNA wird vorgelegt und, falls nötig, mit Wasser auf mindestens 50 μl aufgefüllt. Zur Präzipitation wird die Lösung mit 1/10 Volumen 3 M NaOAc/HOAc pH = 4.7 und 2.5 x Volumen kaltem 100 % Ethanol versetzt. Die Mischung wird zunächst für 1 h bei –70 °C inkubiert und anschließend für mindestens 30 Min bei 14000 rpm [und 4 °C zentrifugiert.] |
6.1.15 Fällen von DNA
Die zu fällende DNA wird vorgelegt und, falls nötig, mit Wasser auf mindestens 50 μl aufgefüllt. Zur Präzipitation wird die Lösung mit 1/10 Volumen 3 M M NaOAc/HOAc pH = 4.7 und 2.5 x Volumen kaltem 100 % Ethanol versetzt. Die Mischung wird zunächst für 1 h bei –70 °C inkubiert und anschließend für mindestens 30 Min bei 14000 rpm und 4 °C zentrifugiert. |
Ein Verweis auf die Quelle fehlt. Fortsetzung auf der nächsten Seite. |
|
| [35.] Slo/Fragment 051 01 - Diskussion Bearbeitet: 17. July 2014, 20:30 WiseWoman Erstellt: 18. May 2014, 07:09 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo |
|
|
| Untersuchte Arbeit: Seite: 51, Zeilen: 1-4 |
Quelle: Schäfer 2004 Seite(n): 73, Zeilen: 12-15 |
|---|---|
| Die ausgefallene DNA wird zweimal mit kaltem 70 % Ethanol gewaschen und im Vakuum für 5 – 10 Min getrocknet. Bei Bedarf wird die DNA schließlich in dem gewünschten Puffer durch Inkubation für 10 – 15 Min bei 65 °C gelöst oder zur Sequenzierung an MWG BIOTECH geschickt. | Die ausgefallene DNA wird zweimal mit kaltem 70 % Ethanol gewaschen und im Vakuum für 5 – 10 Min getrocknet. Bei Bedarf wird die DNA schließlich in dem gewünschten Puffer durch Inkubation für 10 – 15 Min bei 65 °C gelöst oder zur Sequenzierung an MWG BIOTECH geschickt. |
Ein Verweis auf die Quelle fehlt. Die Übernahme beginnt auf der Vorseite: Slo/Fragment 050 25. |
|
| [36.] Slo/Fragment 051 05 - Diskussion Bearbeitet: 17. July 2014, 20:31 WiseWoman Erstellt: 19. May 2014, 08:34 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 51, Zeilen: 5-27 |
Quelle: Schurek 2007 Seite(n): 35, 36, Zeilen: 35: 18ff - 36: 1ff |
|---|---|
| 3.2 Proteinbiochemische Methoden
3.2.1 Proteinexpression und Proteingewinnung im prokaryoten System Das bakterielle Expressionssystem bietet den Vorteil, in kurzer Zeit große Proteinmengen gewinnen zu können. Bakterien sind jedoch nur in der Lage, Proteine bis zu einem Molekulargewicht von ca. 70 kD zu exprimieren, ohne dass es zu Degradationen dieses Proteins kommt. 3.2.1.1 GST-pulldown Der GST-pulldown ist eine biochemische in vitro Methode die sich eignet, um Protein- Protein-Interaktionen zu untersuchen. Dazu wird ein rekombinantes GST-Fusionsprotein im bakteriellen Expressionssystem hergestellt und an Glutathion- Sepharose (GS-beads) immobilisiert. Es folgt die Inkubation dieses Fusionsproteins mit einem Zellysat, das den potentiellen Interaktionspartner enthält. Der Nachweis dieser potentiellen Interaktion wird durch Western Blot Analyse ermittelt. Die Expression des rekombinanten GST-Fusionsproteins erfolgt durch das pGex- Vektorsystem. Dieser bakterielle Expressionsvektor enthält das Gen Glutathion-S-Transferase (GST), hinter welches das gewünschte Gen kloniert wird. Die Proteinexpression resultiert in einem Fusionsprotein, das mit hoher Affinität an Glutathion bindet. Im Versuch wird diese Affinität genutzt, um das Fusionsprotein an einer Glutathion-Sepharose-Matrix zu immobilisieren und dadurch von den endogenen bakteriellen Proteinen zu trennen. 3.2.1.2 Herstellung rekombinanter GST-Fusionsproteine Der E. coli-Stamm BL21 wird mit 100 ng Plasmid-DNA transformiert. Von den gewachsenen Kolonien wird ein Klon in 50 ml LB-Medium mit entsprechendem [Antibiotikum vorkultiviert und zum Animpfen einer 1 l Hauptkultur benutzt.] |
3.2 Proteinbiochemische Methoden
3.2.1 Proteinexpression und Proteingewinnung im prokaryoten System Das bakterielle Expressionssystem bietet den Vorteil, in kurzer Zeit große Proteinmengen gewinnen zu können. Bakterien sind jedoch nur in der Lage, Proteine bis zu einem Molekulargewicht von ca. 70 kD zu exprimieren, ohne dass es zu Degradationen dieses Proteins kommt. 3.2.1.1 GST-pulldown Der GST-pulldown ist eine biochemische in vitro Methode, die sich eignet, um Protein- Protein-Interaktionen zu untersuchen. Dazu wird ein rekombinantes GST-Fusionsprotein im bakteriellen Expressionssystem hergestellt und an Glutathion-Sepharose (GS-beads) immobilisiert. Es folgt die Inkubation dieses Fusionsproteins mit einem Zellysat, das den [Seite 36] potentiellen Interaktionspartner enthält. Der Nachweis dieser potentiellen Interaktion wird durch Western Blot Analyse ermittelt. Die Expression des rekombinanten GST-Fusionsproteins erfolgt durch das pGex- Vektorsystem. Dieser bakterielle Expressionsvektor enthält das Gen Glutathion-S-Transferase (GST), hinter welches das gewünschte Gen kloniert wird [28]. Die Proteinexpression resultiert in einem Fusionsprotein, das mit hoher Affinität an Glutathion bindet. Im Versuch wird diese Affinität genutzt, um das Fusionsprotein an einer Glutathion-Sepharose-Matrix zu immobilisieren und dadurch von den endogenen bakteriellen Proteinen zu trennen. 3.2.1.2 Herstellung rekombinanter GST-Fusionsproteine Der E. coli-Stamm BL21 wird mit 100 ng Plasmid-DNA transformiert (Vgl. 3.3.3.2). Von den gewachsenen Kolonien wird ein Klon in 50 ml LB-Medium mit entsprechendem Antibiotikum vorkultiviert und zum Animpfen einer 1 l Hauptkultur benutzt. 28. Guan KL, Dixon JE: Eukaryotic proteins expressed in Escherichia coli: an improved thrombin cleavage and purification procedure of fusion proteins with glutathione Stransferase. Anal Biochem 1991;192:262-267. |
Ein Verweis auf die Quelle fehlt. |
|
| [37.] Slo/Fragment 052 01 - Diskussion Bearbeitet: 17. July 2014, 20:29 WiseWoman Erstellt: 19. May 2014, 08:39 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 52, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 36, 37, Zeilen: 36: 12ff; 37: 1-7 |
|---|---|
| Die Hauptkultur wird bei einer OD600nm von 0.6 mit 1 mM IPTG versetzt und für 2-3 h bei 30 °C weiter kultiviert. Durch Zentrifugation bei 4 500 rpm für 20 Min bei 4 °C werden die Bakterienzellen pelletiert und anschließend in 15 ml Column-Puffer resuspendiert. Es folgt ein Einfrierschritt zur weiteren Lyse der Bakterienzellwände und zum Aufbrechen eventueller Einschlusskörperchen (inclusion bodies) in flüssigem Stickstoff. Die lysierten, schockgefrorenen Bakterien werden auf Eis aufgetaut, einer Ultraschallbehandlung (3 x 30 Sek 50 %) unterzogen und erneut bei 12 000 rpm und 4 °C für 20 Min zentrifugiert. Der entstandene Überstand („crude lysate“) wird zum Schutz vor Proteasen mit 0.25 mM PMSF versetzt.
3.2.1.3 Konzentrationsbestimmung der GST-Fusionsproteine Zur Konzentrationsbestimmung des rekombinanten Fusionsproteins wird 1 ml crude lysate mit 20 μl equilibrierter Glutathion Sepharose inkubiert. Nach 1h Inkubation bei 4 °C O/H folgen drei Waschschritte mit Column-Puffer. Das rekombinante GST-Fusionsprotein ist nun an der Glutathion-Sepharose immobilisiert und wird mit 20 μl 2x Laemmli-Probenpuffer für 5 Min bei 95 °C eluiert. Zusammen mit einer BSA-Standardreihe (1, 2.5 und 5 μg Protein) wird die Probe mittels SDS-PAGE aufgetrennt, um anschließend mit einer Coomassie-Färbung die Konzentration zu ermitteln. Das übrige crude lysate kann direkt für einen pulldown eingesetzt oder bis zu seiner Verwendung bei -20 °C gelagert werden. 3.2.1.4 Durchführung des GST-pulldowns Für den GST-pulldown werden 1-10 μg des GST-Fusionsproteins an 20 μl equilibrierter Glutathion-Sepharose immobilisiert und nach fünfmaligem Waschen mit Column-Puffer mit Zell- oder Gewebelysat (50-100 μg Gesamtprotein) versetzt. Es schließt sich eine Inkubation von 3-5 h bei 4 °C O/H an. Nach weiteren fünf Waschschritten mit IP-Puffer wird die Probe mit 20 μl 2x Laemmli-Probenpuffer für 5 Min bei 95 °C eluiert und durch SDS-PAGE aufgetrennt. Im Anschluss folgt eine Western Blot Analyse. |
Die Hauptkultur wird bei einer OD600nm von 0.6 mit 1 mM IPTG versetzt und für 2 - 3 h bei 30°C weiter kultiviert. Durch Zentrifugation bei 4.500 rpm für 20 Min bei 4 °C werden die Bakterienzellen pelletiert und anschließend in 15 ml Column-Puffer resuspendiert. Es folgt ein Einfrierschritt zur weiteren Lyse der Bakterienzellwände und zum Aufbrechen eventueller Einschlusskörperchen (inclusion bodies) in flüssigem Stickstoff. Die lysierten, schockgefrorenen Bakterien werden auf Eis aufgetaut, einer Ultraschallbehandlung (3 x 30 Sek 50 %) unterzogen und erneut bei 12.000 rpm und 4 °C für 20 Min zentrifugiert. Der entstandene Überstand („crude lysate“) wird zum Schutz vor Proteasen mit 0.25 mM PMSF versetzt.
3.2.1.3 Konzentrationsbestimmung der GST-Fusionsproteine Zur Konzentrationsbestimmung des rekombinanten Fusionsproteins wird 1 ml crude lysate mit 20 μl equilibrierter Glutathion Sepharose (GS beads) inkubiert. Nach 1 h Inkubation bei 4°C O/H folgen drei Waschschritte mit Column-Puffer. Das rekombinante GST-Fusionsprotein ist nun an der GS-Sepharose immobilisiert und wird mit 20 μl 2 x Laemmli-Probenpuffer für 5 Min bei 95°C gekocht. Zusammen mit einer BSA-Standardreihe (1, 2.5 und 5 μg Protein) wird die Probe mittels SDS-PAGE aufgetrennt, um anschließend mit einer Coomassie-Färbung die Konzentration zu ermitteln. Das übrige crude lysate kann direkt für einen pulldown eingesetzt oder bis zu seiner Verwendung bei –80°C gelagert werden. [Seite 37] 3.2.1.4 Durchführung des GST-pulldowns Für den GST-pulldown werden 1 - 10 μg des GST-Fusionsproteins an 20 μl equilibrierter Glutathion-Sepharose immobilisiert und nach fünfmaligem Waschen mit Column-Puffer mit Zell- oder Gewebelysat (50 - 100 μg Gesamtprotein) versetzt. Es schließt sich eine Inkubation von 3 - 5 h bei 4°C O/H an. Nach weiteren fünf Waschschritten mit IP-Puffer wird die Probe mit 20 μl 2 x Laemmli-Probenpuffer für 5 Min bei 95°C gekocht und durch SDS-PAGE aufgetrennt. Im Anschluss folgt eine Western Blot Analyse. |
Ein Verweis auf die Quelle fehlt. |
|
| [38.] Slo/Fragment 053 01 - Diskussion Bearbeitet: 17. July 2014, 20:28 WiseWoman Erstellt: 19. May 2014, 08:51 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 53, Zeilen: 1-19 |
Quelle: Schurek 2007 Seite(n): 37, Zeilen: 8ff |
|---|---|
| 3.2.2 Proteinexpression und Proteingewinnung im eukaryoten System
Für die Gewinnung endogen exprimierter Proteine aus kultivierten, eukaryoten Zellen kann je nach gewünschter Proteinzusammensetzung eine Fraktionierung erfolgen oder ein Volllysat hergestellt werden. Um die Proteine zu gewinnen, werden die Zellen einer konfluenten 10 cm Kulturschale zunächst mit 1 x PBS (4 °C) gewaschen. Mit einem Zellschaber werden die Zellen in 10 ml 1 x PBS (4 °C) mechanisch von der Kulturschale gelöst und in ein 15 ml Zentrifugenröhrchen überführt. Nach einer Zentrifugation bei 4 °C für 5 Min und 1 000 rpm wird das entstandene Zellpellet auf Eis in 300 μl IP-Puffer (Gebrauchslösung, frisch angesetzt) lysiert. Während einer 30 Min Inkubation auf Eis erfolgt eine mechanische Homogenisierung des Lysats mit einer 1 ml Spritze mit Kanüle (20G). Es schließt sich eine Zentrifugation für 15 Min bei 4 °C und 18 000 rpm an. Der Überstand mit den löslichen Proteinen kann bei -20 °C gelagert oder für ein Experiment eingesetzt werden. Um größere Mengen eines gewünschten Proteins zu gewinnen, das ein zu hohes spezifisches Molekulargewicht für das bakterielle Expressionssystem hat, können eukaryote Zellen mit einem geeigneten Expressionsvektor transfiziert werden. Diese verstärkt exprimierten, posttranslational modifizierten Proteine werden analog zu den endogen exprimierten Proteinen gewonnen. Die Proteine werden 24-48 h nach der Transfektion gewonnen. |
3.2.2 Proteinexpression und Proteingewinnung im eukaryoten System
Für die Gewinnung endogen exprimierter Proteine aus kultivierten, eukaryoten Zellen, kann je nach gewünschter Proteinzusammensetzung eine Fraktionierung erfolgen oder ein Vollysat hergestellt werden. Um die zytosolische Proteinfraktion zu gewinnen, werden die Zellen einer konfluenten 10 cm Kulturschale zunächst mit 1 x PBS (4°C) gewaschen. Mit einem Zellschaber werden die Zellen in 10 ml 1 x PBS (4°C) mechanisch von der Kulturschale gelöst und in ein 15 ml Zentrifugenröhrchen überführt. Nach einer Zentrifugation bei 4°C für 5 Min und 1.000 rpm wird das entstandene Zellpellet auf Eis in 300 μl IP-Puffer (Gebrauchslösung, frisch angesetzt) lysiert. Während einer 15 Min Inkubation auf Eis erfolgt eine mechanische Homogenisierung des Lysats mit einer 1 ml Spritze mit Kanüle (20G). Es schließt sich eine Zentrifugation für 15 Min bei 4°C und 18.000 rpm an. Der Überstand mit den löslichen, zytosolischen Proteinen kann bei -80°C gelagert oder für ein Experiment eingesetzt werden. Um größere Mengen eines gewünschten Proteins zu gewinnen, das ein zu hohes spezifisches Molekulargewicht für das bakterielle Expressionssystem hat, können eukaryote Zellen mit einem geeigneten Expressionsvektor transfiziert werden (Vgl. 3.3.4). Diese verstärkt exprimierten, posttranslational modifizierten Proteine werden analog zu den endogen exprimierten Proteinen gewonnen. Die Proteine werden 24 - 48 h nach der Transfektion gewonnen. |
Ein Verweis auf die Quelle fehlt. |
|
| [39.] Slo/Fragment 056 08 - Diskussion Bearbeitet: 17. July 2014, 20:27 WiseWoman Erstellt: 19. May 2014, 08:59 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 56, Zeilen: 8-21 |
Quelle: Schurek 2007 Seite(n): 38, Zeilen: 13ff |
|---|---|
| 3.2.3 SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE)
(Laemmli, 1970) Um Proteine nach ihrer molekularen Größe aufzutrennen, werden SDSPolyacrylamidgele (SDS-PAA-Gele) mit diskontinuierlichem Puffersystem verwendet. Trenn- und Sammelgele werden nach den in Tabelle 3.2 angegebenen Rezepturen hergestellt. Die Lösung für das Trenngel wird in eine Gelkassette gegossen und mit Isopropanol überschichtet. Nach dem das Trenngel vollständig polymerisiert ist, wird das Isopropanol entfernt. Das Sammelgel wird gegossen und ein Plastikkamm mit der gewünschten Anzahl an Taschen platziert wird. Bevor das Gel mit den Proteinproben beladen wird, werden diese in Laemmli- Probenpuffer für 5 Min bei 95 °C denaturiert. Ein Proteingrößenstandard (Marker, Precision Plus Protein Dual Colour Standard, BioRad) wird neben den Proben aufgetragen. Die Elektrophorese erfolgt bei 10 mA im Sammelgel und 20 mA im Trenngel unter Verwendung von 1x Protein-Laufpuffer. Tabelle 3.1 Rezepturen für SDS-PAA-Gele |
3.2.4 SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE)
(Laemmli, 1970)[47] Um Proteine nach ihrer molekularen Größe aufzutrennen, werden SDS-Polyacrylamidgele (SDS-PAA-Gele) mit diskontinuierlichem Puffersystem verwendet. Trenn- und Sammelgele werden nach den in Tabelle 3.2 angegebenen Rezepturen hergestellt. Die Lösung für das Trenngel wird in eine Gelkassette gegossen und mit Isopropanol überschichtet. Nachdem das Trenngel vollständig polymerisiert ist, wird das Isopropanol entfernt. Das Sammelgel wird auf das Trenngel gegossen. Ein Plastikkamm mit Aussparungen für die spätere Proteinbeladung wird in das Sammelgel platziert. Bevor das Gel mit den Proteinproben beladen wird, werden diese in Laemmli-Probenpuffer für 5 Min bei 95°C denaturiert. Ein Proteingrößenstandard (Marker, Precision Plus Protein Dual Colour Standard, Biorad) wird neben den Proben aufgetragen. Die Elektrophorese erfolgt bei 175 V im Sammelgel und 200 V im Trenngel unter Verwendung von 1 x Protein-Laufpuffer. Tabelle 3.2 Rezepturen für SDS-PAA-Gele [...] |
Ein Verweis auf die Quelle fehlt. |
|
| [40.] Slo/Fragment 057 01 - Diskussion Bearbeitet: 17. July 2014, 20:26 WiseWoman Erstellt: 19. May 2014, 09:04 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 57, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 39, Zeilen: 1ff |
|---|---|
| 3.2.4 Coomassie-Färbung von Proteingelen
Nach der Gelelektrophorese wird das Gel für 5-10 Min in Fixierlösung und für 30 Min (bis O/N) in der Coomassie-Gebrauchslösung inkubiert. Im Anschluss wird das Gel mit Destaining Solution entfärbt, bis Proteinbanden sichtbar werden. Mit Hilfe eines Durchlicht Scanners erfolgt eine Aufnahme des Gels. 3.2.5 Western Blot Zur Durchführung eines „semi-dry“ Western Blots wird ein 3 mm starkes Whatmanpapier in Größe des Gels in Transferpuffer getränkt. Darauf wird eine in Methanol equilibrierte PVDF-Membran gelegt. Als nächstes wird das SDS-PAA-Gel auf der Membran platziert, worauf sich wieder ein Whatmanpapier anschließt. Diese Mehrfachschichtung wird, gut in Transferpuffer getränkt und frei von Luftblasen, auf die Anode der Blotkammer gelegt, welche sodann mit der Kathode verschlossen wird. Da die negativ geladenen Proteine aus dem Gel auf die Membran transferiert werden sollen, ist darauf zu achten, dass die Membran zwischen Gel und Anode zu liegen kommt. Der Proteintransfer erfolgt bei 12 V für 2 h. Zur Überprüfung des erfolgten Transfers wird die Membran in Ponceau-S-Lösung inkubiert und mit H20 gewaschen, bis eindeutige Proteinbanden zu erkennen sind. Nach einer vollständigen Entfärbung der Membran wird mit der Antikörper-Detektion fortgefahren. 3.2.6 Immunologischer Nachweis Bevor es zum Einsatz von Antikörpern kommt wird die PVDF-Membran zur Absättigung freier Proteinbindungsstellen für 1,5 h bei RT oder O/N bei 4 °C in 10 % Milchpulver geblockt. Die nachfolgenden Waschschritte, die Verdünnung der BSA-Lösung und die der Antikörper, erfolgt in TBS-T. Es folgt der immunologische Nachweis durch Inkubation mit dem spezifisch bindenden Primärantikörper für 1,5 h bei RT. Nach dreimaligem Waschen für 5 Min folgt eine Inkubation mit dem peroxidasekonjugierten Sekundärantikörper. Nach erneutem, intensivem Waschen der Membran, erfolgt die Detektion mit Hilfe von Lumi Light Plus® von Roche. Das durch die Peroxidasereaktion entstehende Licht wird mit einem Röntgenfilm detektiert. |
3.2.5 Coomassie-Färbung von Proteingelen
Nach der Gelelektrophorese wird das Gel für 5 - 10 Min in Fixierlösung und für 30 Min (bis O/N) in der Coomassie-Gebrauchslösung inkubiert. Im Anschluss wird das Gel mit Destaining Solution entfärbt, bis Proteinbanden sichtbar werden. Mit Hilfe eines Durchlicht Scanners erfolgt eine Aufnahme des Gels. 3.2.6 Western Blot Zur Durchführung eines „semi-dry“ Western Blots wird ein 3 mm starkes Whatmanpapier in Größe des Gels in Transferpuffer getränkt. Darauf wird eine in Methanol equilibrierte PVDF-Membran gelegt. Als nächstes wird das SDS-PAA-Gel auf der Membran platziert, worauf sich wieder ein Whatmanpapier anschließt. Diese Mehrfachschichtung wird gut in Transferpuffer getränkt und frei von Luftblasen auf die Graphit-Anode der Blotkammer gelegt, welche mit der Kathode verschlossen wird. Da die negativ geladenen Proteine aus dem Gel auf die Membran transferiert werden sollen, ist darauf zu achten, dass die Membran zwischen Gel und Anode zu liegen kommt. Der Proteintransfer erfolgt bei 12 V für 2 h. Zur Überprüfung des erfolgten Transfers wird die Membran in Ponceau-S-Lösung inkubiert und mit TBS-T gewaschen, bis eindeutige Proteinbanden zu erkennen sind. Nach einer vollständigen Entfärbung der Membran wird mit der Antikörper-Detektion fortgefahren. 3.2.6.1 Immunologische Nachweise Bevor es zum Einsatz von Antikörpern kommt, wird die PVDF-Membran zur Absättigung freier Proteinbindungsstellen für 1 h bei 37°C oder O/N bei 4°C in 5 % BSA-Lösung in TBS-T geblockt. Die nachfolgenden Waschschritte und die Verdünnung der Antikörper erfolgt in TBS-T. Es folgt der immunologische Nachweis durch Inkubation mit dem spezifisch bindenden Primärantikörper für 1 h bei RT. Nach dreimaligem Waschen für 5 Min folgt eine Inkubation mit dem peroxidasekonjugierten Sekundärantikörper. Nach erneutem, intensivem Waschen der Membran, erfolgt die Detektion der Proteinbanden durch die ECL-Reaktion (Vgl. Material 2.3.1). Das durch die Peroxidasereaktion entstehende Licht wird mit einem Röntgenfilm detektiert. |
Ein Verweis auf die Quelle fehlt. |
|
| [41.] Slo/Fragment 058 01 - Diskussion Bearbeitet: 17. July 2014, 20:25 WiseWoman Erstellt: 18. May 2014, 07:24 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo |
|
|
| Untersuchte Arbeit: Seite: 58, Zeilen: 1-5 |
Quelle: Schäfer 2004 Seite(n): 93, Zeilen: 1-5 |
|---|---|
| 3.2.7 Entfernung membrangebundener Antikörper
Zur Entfernung von auf Membranen gebundenen Antikörpern („Stripping“) wird der Blot 30 Min mit Stripping-Puffer bei 70 °C unter leichtem Schütteln inkubiert. Nach intensivem Waschen mit PBS-T oder TBS-T (min. sechsmal 15 Min, auch üN bei 4 °C möglich) kann eine erneute immunologische Detektion durchgeführt werden. |
6.4.6 Entfernung membrangebundener Antikörper
Zur Entfernung von auf Membranen gebundenen Antikörpern („Stripping“) wird der Blot 30 Min mit Stripping-Puffer bei 70 °C unter leichtem Schütteln inkubiert. Nach intensivem Waschen mit PBS-T oder TBS-T (min. sechsmal 15 Min, auch üN bei 4 °C möglich) kann eine erneute immunologische Detektion durchgeführt werden. |
Ein Verweis auf die Quelle fehlt. |
|
| [42.] Slo/Fragment 058 06 - Diskussion Bearbeitet: 17. July 2014, 20:25 WiseWoman Erstellt: 19. May 2014, 09:28 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 58, Zeilen: 6-14 |
Quelle: Schurek 2007 Seite(n): 40, Zeilen: 20-29 |
|---|---|
| 3.2.8 Immunfluoreszenz
Im Gegensatz zu der Phalloidin-Färbung des Aktin-Zytoskeletts beruht die Methode der Immunfluoreszenz, analog zum Western Blot, auf der Anfärbung von Proteinen durch spezifische Antikörper. Der Primär-Antikörper wird in einer sinnvollen Verdünnung eingesetzt. Nach einer einstündigen Inkubation bei RT folgt dreimaliges Waschen mit 1x PBS, woran sich eine weitere einstündige Inkubation mit dem lichtsensitiven, Fluoreszenzfarbstoff-gekoppelten Sekundär-Antikörper, der gleichermaßen in der Blocklösung verdünnt wird, anschließt. Das weitere Procedere, einschließlich der Dokumentation und der Auswertung, erfolgt analog der Phalloidin-Färbung. |
3.2.8 Immunfluoreszenz
Im Gegensatz zu der Phalloidin-Färbung des Aktin-Zytoskeletts beruht die Methode der Immunfluoreszenz, analog zum Western Blot, auf der Anfärbung von Proteinen durch spezifische Antikörper. Die Arbeitsschritte werden wie unter 3.2.7 durchgeführt, wobei anstelle der Phalloidin-Lösung ein Primär-Antikörper in einer sinnvollen Verdünnung eingesetzt wird (Vgl. 2.7 Antikörper). Nach einer einstündigen Inkubation bei RT folgt dreimaliges Waschen mit 1 x PBS, woran sich eine weitere einstündige Inkubation mit dem lichtsensitiven, Fluoreszenzfarbstoff-gekoppelten Sekundär-Antikörper, der gleichermaßen in der Blocklösung verdünnt wird, anschließt. Das weitere Procedere, einschließlich der Dokumentation und der Auswertung, erfolgt analog der Phalloidin-Färbung. |
Ein Verweis auf die Quelle fehlt. |
|
| [43.] Slo/Fragment 059 01 - Diskussion Bearbeitet: 17. July 2014, 20:24 WiseWoman Erstellt: 19. May 2014, 09:31 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 59, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 41, Zeilen: 1ff |
|---|---|
| 3.3 Zellbiologische und Mikrobiologische Methoden
3.3.1 Anzucht, Kultivierung und Lagerung von Hefen, Bakterien und eukaryoten Zellen 3.3.1.1 Hefen (Saccharomyces cerevisiae) Die Kultivierung von Hefen erfolgt in YPAD-Medium bei 250 rpm oder auf YPAD-Agarplatten bei 30 °C. Um mit einer Kultivierung zu beginnen, wird eine geringe Menge einer Glyzerinkultur des gewünschten Hefestammes mit einer sterilen Impföse auf eine YPAD-Agarplatte überführt. Es folgen ein Vereinzelungsausstrich und eine Inkubation bei 30 °C. Nach 2-4 Tagen kann eine einzelne Hefekolonie in Flüssigmedium überführt und in Kultur genommen werden. Die Flüssigkulturen werden täglich mit frischem Medium versorgt, um die Wachstumsphase der Hefezellen zu erhalten. Analog zu der Kultivierung auf diesem so genannten Vollmedium, können die Hefezellen zur Selektion auf SD-Medium kultiviert werden. Auf Agarplatten kann eine Lagerung bei 4 °C erfolgen, wobei zur langfristigen Lagerung der Hefezellen bei -80 °C eine Glyzerinkultur hergestellt wird. Dazu wird zu einer über Nacht (O/N) gewachsenen Flüssigkultur 25 % (v/v) Glyzerin zugesetzt. 3.3.1.2 Bakterien (Escherichia coli) Bakterien werden gleichermaßen als Flüssigkultur in LB-Medium bei 250 rpm oder auf LB-Agarplatten bei 37 °C kultiviert (Material, 2.4.1). Die Zugabe eines entsprechenden Antibiotikums erfolgt zur Selektion transformierter Bakterien. Eine kurzfristige Lagerung kann ebenfalls bei 4 °C erfolgen, für eine dauerhafte Lagerung wird analog zu den Hefen eine Glyzerinkultur hergestellt. 3.3.1.3 Kultivierung eukaryoter Zellen Die verwendeten Zelllinien werden in 10 cm Gewebekulturschalen unter sterilen Bedingungen mit einem entsprechenden Nährmedium kultiviert. Sobald die Zellen einen konfluenten Zellrasen (Monolayer) gebildet haben, werden sie in einem sinnvollen Verhältnis geteilt und weiter kultiviert. Diese Passagierung (= Splitten) erfolgt alle 2-3 Tage, wobei durch Zugabe von Trypsin das Ablösen der Zellen [eingeleitet wird.] |
3.3 Zellbiologische und Mikrobiologische Methoden
3.3.1 Anzucht, Kultivierung und Lagerung von Hefen, Bakterien und eukaryoten Zellen 3.3.1.1 Hefen (Saccharomyces cerevisiae) Die Kultivierung von Hefen erfolgt in YPAD-Medium bei 250 rpm oder auf YPAD-Agarplatten bei 30°C. Um mit einer Kultivierung zu beginnen, wird eine geringe Menge einer Glycerinkultur des gewünschten Hefestammes mit einer sterilen Impföse auf eine YPAD-Agarplatte überführt. Es folgen ein Vereinzelungsausstrich und eine Inkubation bei 30°C. Nach 2 - 4 Tagen kann eine einzelne Hefekolonie in Flüssigmedium überführt und in Kultur genommen werden. Die Flüssigkulturen werden täglich mit frischem Medium versorgt, um die Wachstumsphase der Hefezellen zu erhalten. Analog zu der Kultivierung auf diesem so genannten Vollmedium können die Hefezellen zur Selektion auf SD-Medium (Material, 2.4.2) kultiviert werden. Auf Agarplatten kann eine Lagerung bei 4°C erfolgen, wobei zur langfristigen Lagerung der Hefezellen bei -80°C eine Glycerinkultur hergestellt wird. Dazu wird zu einer über Nacht (O/N) gewachsenen Flüssigkultur 25 % (v/v) Glycerin zugesetzt. 3.3.1.2 Bakterien (Escherichia coli) Bakterien werden gleichermaßen als Flüssigkultur in LB-Medium bei 250 rpm oder auf LB-Agarplatten bei 37°C kultiviert (Material, 2.4.1). Die Zugabe eines entsprechenden Antibiotikums erfolgt zur Selektion transformierter Bakterien. Eine kurzfristige Lagerung kann ebenfalls bei 4°C erfolgen, für eine dauerhafte Lagerung wird analog zu den Hefen eine Glycerinkultur hergestellt. 3.3.1.3 Kultivierung eukaryoter Zellen Die verwendeten Zellinien werden in 10 cm Gewebekulturschalen unter sterilen Bedingungen mit einem entsprechenden Nährmedium kultiviert (Material, 2.4.3) Sobald die Zellen einen konfluenten Zellrasen (Monolayer) gebildet haben, werden sie in einem sinnvollen Verhältnis geteilt und weiter kultiviert. Diese Passagierung (=Splitten) erfolgt alle 2 - 3 Tage, wobei durch Zugabe von Trypsin das Ablösen der Zellen eingeleitet wird. |
Ein Verweis auf die Quelle fehlt. |
|
| [44.] Slo/Fragment 060 01 - Diskussion Bearbeitet: 17. July 2014, 20:23 WiseWoman Erstellt: 19. May 2014, 09:38 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 60, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 41, 42, Zeilen: 41: letzte vier Zeilen - 42: 1ff |
|---|---|
| Dazu wird das Medium abgenommen und die Zellen werden einmal gewaschen, indem pro 10 cm Kulturschale ca. 10 ml vorgewärmtes 1x PBS vorsichtig in die Kulturschale gegeben wird. Es folgt eine Inkubation mit 1 ml Trypsin/EDTA pro 10 cm Kulturschale für 2-3 Min bei 37 °C. Nachdem sich die Zellen abgelöst haben, wird die Wirkung des Trypsins durch Zugabe von 9 ml vorgewärmten Mediums neutralisiert. Die Zellen werden resuspendiert und auf neue Kulturschalen verteilt, in denen ein entsprechendes Volumen vorgewärmten Mediums vorgelegt wurde. Die immortalisierten Podozytenzelllinien wurden mit einem temperatursensitiven Large T-Antigen transformiert, wodurch die Proliferation dieser Zellen ausschließlich auf die Kultivierung bei 33 °C beschränkt ist. Aus diesem Grund werden nur bei 33 °C kultivierte Podozyten geteilt. Zur Differenzierung werden die Podozyten für 10-14 Tage bei 37 °C (humane Podozyten) bzw. 38 °C (murine Podozyten) kultiviert. Die Kultivierung und Passagierung der HEK 293T Zellen erfolgt bei 37 °C.
3.3.1.4 Einfrieren eukaryoter Zellen Die dauerhafte Lagerung eukaryoter Zellen erfolgt in Kryoröhrchen in flüssigem Stickstoff. Für das Einfrieren werden ca. 107 Zellen nach einmaligem Waschen mit 1 x PBS wie beschrieben abgelöst und in dem entsprechenden Kulturmedium resuspendiert. Es folgt eine Zentrifugation für 5 Min bei 1 000 rpm bei 4 °C. Das Zellpellet wird in 1 ml kaltes Medium mit 10 % (v/v) DMSO resuspendiert und in Kryoröhrchen überführt. Die Lagerung erfolgt zunächst für 24 h bei -20 °C, um das langsame Einfrieren der Zellen zu gewährleisten. Anschließend werden die Zellen für weitere 24 h in -80 °C transferiert. Für die dauerhafte Konservierung werden die Zellen in flüssigen Stickstoff überführt. 3.3.1.5 Auftauen eukaryoter Zellen Die Zellen werden bei 37 °C schnell aufgetaut, in vorgewärmtes Medium überführt und für 5 Min bei 1000 rpm bei RT zentrifugiert. Der Überstand wird entfernt und das entstandene Zellpellet in entsprechendem Medium resuspendiert, in eine Zellkulturschale überführt und bei 33 °C (Podozyten) bzw. 37 °C (HEK 293T) in Kultur genommen. |
Dazu wird das Medium abgenommen und die Zellen werden gewaschen, indem pro 10 cm Kulturschale ca. 10 ml vorgewärmtes 1 x PBS vorsichtig in die Kulturschale gegeben wird. Es folgt eine Inkubation mit 1 ml Trypsin/EDTA pro 10 cm Kulturschale für 2 - 3 Min bei 37°C. Nachdem sich die
[Seite 42] Zellen abgelöst haben, wird die Wirkung des Trypsins durch Zugabe von 9 ml vorgewärmten Mediums neutralisiert. Die Zellen werden resuspendiert und auf neue Kulturschalen verteilt, in denen ein entsprechendes Volumen vorgewärmten Mediums vorgelegt wurde. Die immortalisierten Podozytenzellinien wurden mit einem temperatursensitiven Large T-Antigen transformiert, wodurch die Proliferation dieser Zellen ausschließlich auf die Kultivierung bei 33°C beschränkt ist. Aus diesem Grund werden nur bei 33°C kultivierte Podozyten geteilt. Zur Differenzierung werden die Podozyten für 10 - 14 Tage bei 37°C (Humane Podozyten) bzw. 38°C (Murine Podozyten) kultiviert. Die Kultivierung und Passagierung der HEK 293T Zellen erfolgt bei 37°C. 3.3.1.4 Einfrieren eukaryoter Zellen Die dauerhafte Lagerung eukaryoter Zellen erfolgt in Kryoröhrchen in flüssigem Stickstoff. Für das Einfrieren werden ca. 106 Zellen nach einmaligem Waschen mit 1 x PBS wie beschrieben trypsiniert und in dem entsprechenden Kulturmedium resuspendiert. Es folgt eine Zentrifugation für 5 Min bei 1.000 rpm bei RT. Das Zellpellet wird in 1 ml FCS mit 10 % (v/v) DMSO resuspendiert und in Kryoröhrchen überführt. Die Lagerung erfolgt zunächst für 24 h bei -20°C, um das langsame Einfrieren der Zellen zu gewährleisten. Anschließend werden die Zellen für weitere 24 h in -80°C transferiert. Für die dauerhafte Konservierung werden die Zellen in flüssigen Stickstoff überführt. 3.3.1.5 Auftauen eukaryoter Zellen Die Zellen werden bei RT aufgetaut, in vorgewärmtes Medium überführt und für 5 Min bei 1.000 rpm bei RT zentrifugiert. Der Überstand wird entfernt und das entstandene Zellpellet in entsprechendem Medium resuspendiert, in eine Zellkulturschale überführt und bei 33°C (Podozyten) bzw. 37°C (HEK 293T) in Kultur genommen. |
Ein Verweis auf die Quelle fehlt. |
|
| [45.] Slo/Fragment 061 01 - Diskussion Bearbeitet: 17. July 2014, 20:21 WiseWoman Erstellt: 19. May 2014, 09:42 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 61, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 42, 43, Zeilen: 42: 24ff; 43: 1ff |
|---|---|
| 3.3.2 Das Yeast Two-Hybrid System
Das von Fields und Song entwickelte Yeast Two-Hybrid (Y2H) System dient der Identifizierung von Protein-Protein-Interaktionen. Es handelt sich dabei um ein in vivo Modell, bei dem in der Hefe ein bekanntes Protein als Köder (bait) eingesetzt wird, um neue Interaktionspartner zu identifizieren. Als potentielle Beute (prey) kann eine Genbank (cDNA library) oder ein anderes bekanntes Protein angeboten werden, die in ihrer Proteinexpression auf spezifische Gewebe oder Zelltypen beschränkt sein kann. Die Methode beruht auf dem modularen Aufbau des endogenen Transkriptionsaktivators GAL 4 der Hefe. Dieser setzt sich aus einer DNA bindenden (DB) und einer DNA aktivierenden (DA) Domäne zusammen. Die räumliche Nähe dieser beiden Domänen führt zu einer Bindung und anschließenden Aktivierung der Reportergene lacZ und His3, die unter der Kontrolle von GAL4 stehen. Für den Yeast Two-Hybrid Screen werden diese beiden Domänen getrennt und durch verschiedene Vektoren exprimiert, wobei das bait zusammen mit der DB exprimiert wird. Die prey-Vektoren exprimieren zufällige Fusionsproteine aus der Genbank und der DNA aktivierenden Domäne. Die bait-Vektoren kodieren zusätzlich für ein Enzym des Leucin Anabolismus, die prey-Vektoren für eine Tryptophan-Auxotrophie. Die Transformation dieser Vektoren in Hefezellen ermöglicht ein Wachstum auf Selektionsmedium, das kein Leucin und/oder Tryptophan enthält (SD-L-T). Einige Hefestämme wachsen trotz Mutation im His3-Gen in geringem Maße auf histidindefizientem Medium. Aus diesem Grund wird Medium ohne Histidin (SD-L-TH) mit dem kompetitiven Inhibitor dieses Genprodukts, 3-Amino-1, 2, 4-triazol (3-AT), ergänzt, indem 25-50 mM 3-AT zugegeben werden. Wachsen die ko-transformierten GAL 4-defizienten kompetenten Hefezellen auch auf SD-L-T-H + 3-AT Agarplatten, kann ein so genannter β-Galaktosidase Filter Assay durchgeführt werden. Die Hefekolonien, die in diesem Assay eine Blaufärbung zeigen, exprimieren das Reportergen, was als Hinweis für eine Protein-Protein-Interaktion gedeutet werden kann. 3.3.2.1 Herstellung kompetenter Hefezellen Ein Volumen von 50 ml YPAD-Medium wird mit einer O/N Flüssigkultur des zu transformierenden Hefestammes angeimpft und auf eine OD600nm von 0.2 eingestellt. |
3.3.2 Das Yeast Two-Hybrid System
Das von Fields und Song entwickelte Yeast Two-Hybrid (Y2H) System dient der Identifizierung von Protein-Protein-Interaktionen [23]. Es handelt sich dabei um ein in vivo Modell, bei dem in einem Hefesystem ein bekanntes Protein als Köder (bait) eingesetzt wird, um neue Interaktionspartner zu identifizieren. Als potentielle Beute (prey) wird eine Genbank (cDNA library) angeboten, die in ihrer Proteinexpression auf spezifische Gewebe oder Zelltypen beschränkt sein kann. Die Methode beruht auf dem modularen Aufbau des endogenen Transkriptionsaktivators GAL 4 der Hefe. Dieser setzt sich aus einer DNA [Seite 43] bindenden (DB) und einer DNA aktivierenden (DA) Domäne zusammen. Die räumliche Nähe dieser beiden Domänen führt zu einer Bindung und anschließenden Aktivierung der Reportergene lacZ und His3, die unter der Kontrolle von GAL 4 stehen. Für den Yeast Two- Hybrid Screen werden diese beiden Domänen getrennt und auf verschiedenen Vektoren exprimiert, wobei das bait zusammen mit der DB exprimiert wird. Die prey-Vektoren exprimieren zufällige Fusionsproteine aus der Genbank und der DNA aktivierenden Domäne. Die bait-Vektoren kodieren zusätzlich für eine Leucin-Auxotrophie, die prey-Vektoren für eine Tryptophan-Auxotrophie. Die Transformation dieser Vektoren in Hefezellen ermöglicht ein Wachstum auf Selektionsmedium, das kein Leucin und Tryptophan enthält (SD-L-T). Einige Hefestämme wachsen trotz Mutation im His3-Gen in geringem Maße auf histidindefizientem Medium. Aus diesem Grund wird Medium ohne Histidin (SD-L-T-H) mit dem kompetetiven Inhibitor dieses Genprodukts, 3-Amino-1, 2, 4-triazol (3-AT), ergänzt, indem 25 - 50 mM 3-AT zugegeben werden. Wachsen die ko-transformierten GAL 4- defizienten kompetenten Hefezellen auch auf SD-L-T-H + 3-AT Agarplatten, kann ein so genannter β-Galaktosidase Filter Assay durchgeführt werden. Die Hefekolonien, die in diesem Assay eine Blaufärbung zeigen, exprimieren das Reportergen, was als Hinweis für eine Protein-Protein-Interaktion gedeutet werden kann. 3.3.2.1 Herstellung kompetenter Hefezellen Ein Volumen von 50 ml YPAD-Medium wird mit einer O/N Flüssigkultur des zu transformierenden Hefestammes angeimpft und auf eine OD600nm von 0.2 eingestellt. 23. Fields S, Song O: A novel genetic system to detect protein-protein interactions. Nature 1989;340:245-246. |
Ein Verweis auf die Quelle fehlt. |
|
| [46.] Slo/Fragment 062 01 - Diskussion Bearbeitet: 17. July 2014, 20:19 WiseWoman Erstellt: 19. May 2014, 10:44 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 62, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 43, 44, Zeilen: 43: 20ff |
|---|---|
| [Es] folgt eine Inkubation bei 250 rpm und 30 °C bis eine OD600nm von 0.6-0.8 erreicht ist. Die Hefezellen werden bei RT für 3 Min und 2000 rpm zentrifugiert und das entstandene Pellet in sterilem H2O resuspendiert. Nach einem weiteren Zentrifugationsschritt bei gleichen Bedingungen wird das Pellet in 3-5 ml 50 % (w/v) PEG 4000 resuspendiert. Die kompetenten Hefezellen sollten innerhalb der nächsten Stunde transformiert werden, um eine hohe Effizienz zu erzielen.
3.3.2.2 Transformation von Hefen Für einen 30 μl Transformationsansatz werden 100 ng pro Plasmid-DNA eingesetzt. Zu diesem Ansatz werden 720 μl der kompetenten Hefezellsuspension, 108 μl 1 M Lithiumacetat und 135 μl H2O gegeben. Nach guter Durchmischung folgt eine Inkubation von 30 Min bei 30 °C und 250 rpm. Im Anschluss daran werden die Hefezellen für 30 Min einem Hitzeschock bei 42 °C ausgesetzt, 5 Min auf Eis inkubiert und für 3 Min bei RT und 2000 rpm zentrifugiert. Das entstandene Pellet wird in 100 μl H2O resuspendiert und auf entsprechenden SD-Selektionsplatten ausgestrichen. Die Platten werden für 2-4 Tage im Brutschrank bei 30 °C inkubiert. 3.3.2.3 β-Galaktosidase Filter Assay Der β-Galaktosidase Assay beruht auf der Expression des Reportergens lacZ, das für β-Galaktosidase kodiert, welche die Hydrolyse von X-Gal (5-bromo-4-chloro-3-indoyl-β-D-galaktopyranosid) zu einem blauen Indigo-Farbstoff katalysieren kann. Für die Durchführung des β-Gal-Assays werden je Ansatz zwei Filterpapiere vorbereitet, die einen geringfügig kleineren Durchmesser aufweisen als die SD-Selektionsplatten, auf denen die zu testenden Hefen wachsen. Pro Ansatz wird je ein Filterpapier in einem geeigneten Gefäß mit X-Gal-Gebrauchslösung inkubiert. Für ein Ø 10 cm Gefäß sind 2.5 ml der X-Gal-Gebrauchslösung ausreichend. Das zweite Filterpapier wird direkt auf die Hefekolonien gelegt und gleichmäßig angedrückt. Sobald sich ein Abdruck der Hefekolonien auf dem Filterpapier zeigt, wird dieses für 10 Sek. in flüssigen Stickstoff eingetaucht, um die Hefezellen aufzubrechen. Das gefrorene Filterpapier wird bei RT aufgetaut und mit der Seite des Hefe-Abdrucks auf das in X-Gal-Lösung getränkte Filterpapier gelegt. Wenn nach 2-3 h eine Blaufärbung optisch einwandfrei zu erkennen ist, enthalten die Zellen zwei interagierende Proteine. |
Es folgt eine Inkubation bei 250 rpm und 30°C bis eine OD600nm von 0.6 - 0.8 erreicht ist. Die Hefezellen werden bei RT für 3 Min und 2000 rpm zentrifugiert und das entstandene Pellet in sterilem H2O resuspendiert. Nach einem weiteren Zentrifugationsschritt bei gleichen Bedingungen wird das Pellet in 3 - 5 ml 50 % (w/v) PEG 4000 resuspendiert. Die kompetenten Hefezellen sollten innerhalb der nächsten Stunde transformiert werden, um eine hohe Effizienz zu erzielen.
3.3.2.2 Transformation von Hefen Für einen 30 μl Transformationsansatz werden 100 ng pro Plasmid-DNA eingesetzt. Zu diesem Ansatz werden 720 μl der kompetenten Hefezellsuspension, 108 μl 1 M Lithiumacetat und 135 μl H2O gegeben. Nach guter Durchmischung folgt eine Inkubation von 30 Min bei 30°C und 250 rpm. Im Anschluss daran werden die Hefezellen für 30 Min einem Hitzeschock bei 42°C ausgesetzt, 5 Min auf Eis inkubiert und für 3 Min bei RT und 2.000 rpm [Seite 44] zentrifugiert. Das entstandene Pellet wird in 100 μl H2O resuspendiert und auf entsprechenden SD-Selektionsplatten (Vgl. Material 2.4.2.2) ausgestrichen. Die Platten werden für 2 - 4 Tage im Brutschrank bei 30°C inkubiert. 3.3.2.3 β-Galaktosidase Filter Assay (β-Gal-Assay) Der β-Galaktosidase Assay beruht auf der Expression des Reportergens lacZ, das für β-Galaktosidase kodiert, welche die Hydrolyse von X-Gal (5-bromo-4-chloro-3-indoyl-β-D-galaktopyranosid) zu einem blauen Indigo-Farbstoff katalysiert. Für die Durchführung des β-Gal-Assays werden je Ansatz zwei Filterpapiere vorbereitet, die einen geringfügig kleineren Durchmesser aufweisen als die SD-Selektionsplatten, auf denen die zu testenden Hefen wachsen. Unter einem Laborabzug wird pro Ansatz je ein Filterpapier in einem geeigneten Gefäß mit X-Gal-Gebrauchslösung inkubiert. Für ein Ø 10 cm Gefäß sind 2.5 ml der X-Gal-Gebrauchslösung ausreichend. Das zweite Filterpapier wird direkt auf die Hefekolonien gelegt und gleichmäßig angedrückt. Sobald sich ein Abdruck der Hefekolonien auf dem Filterpapier zeigt, wird dieses unter zu Hilfenahme einer Pinzette für 10 Sek. in flüssigen Stickstoff eingetaucht. Das gefrorene Filterpapier wird bei RT aufgetaut und mit der Seite des Hefe-Abdrucks auf das in X-Gal-Lösung getränkte Filterpapier gelegt. Nach 2 - 3 h sollte eine Blaufärbung optisch einwandfrei zu erkennen sein. |
Ein Verweis auf die Quelle fehlt. |
|
| [47.] Slo/Fragment 063 01 - Diskussion Bearbeitet: 17. July 2014, 20:18 WiseWoman Erstellt: 19. May 2014, 10:53 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 63, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 44, 45, Zeilen: 44: 18ff; 45: 1ff |
|---|---|
| 3.3.3 Transformation von Bakterien
3.3.3.1 Herstellung chemisch kompetenter Bakterien Der E. coli Stamm wird auf einer LB-Agarplatte ausgestrichen und O/N bei 37 °C inkubiert. 10 ml TYM-Medium werden mit einer Kolonie angeimpft und bei 37 °C und 250 rpm für ca. 4-5 h inkubiert, bis eine OD600nm von 0.5-0.6 erreicht ist. Die Vorkultur wird mit TYM-Medium auf 100 ml aufgefüllt und weiter für ca. 1.5 h inkubiert. Die Kultur wird anschließend mit 400 ml TYM-Medium aufgefüllt, für eine weitere Stunde inkubiert und anschließend für 10 Min in einem Eiswasserbad unter Schwenken abgekühlt. Die Bakterien werden für 10 Min bei 4 °C und 2500 x g in einer vorgekühlten Zentrifuge geerntet. Es folgt eine Resuspension der Bakterien in 100 ml vorgekühltem TfB1 und eine neuerliche Zentrifugation für 10 Min bei 4 °C und 2500 x g. Die Bakterien werden in 10 ml eiskaltem TfB2 resuspendiert und in 300 μl Aliquots in flüssigem Stickstoff schockgefroren. Die Aliquots werden bei -80 °C überführt, was eine dauerhafte Lagerung ermöglicht. Es wird je ein Aliquot auf einer LB-Platte mit Kanamycin und Ampicillin ausgestrichen und O/N bei 37 °C inkubiert, um eine unerwünschte Ausbildung spontaner Antibiotikaresistenzen auszuschließen. Durch die Transformation von 1 ng einer bekannten Plasmid-DNA wird die Kompetenz der hergestellten Bakterien ermittelt, wobei ein Wert von 107 Kolonien/μg DNA erreicht werden sollte. 3.3.3.2 Transformation Für die Transformation mit Plasmid-DNA wird ein Aliquot des kompetenten E. coli Stammes auf Eis aufgetaut, mit der Plasmid-DNA (Bakterien : Plasmid-DNA 10:1) versetzt und für 30 Min auf Eis inkubiert. Anschließend wird ein Hitzeschock für 45 Sek bei 42 °C durchgeführt. Nach einer weiteren Inkubationszeit von 1 Min auf Eis wird die Bakteriensuspension mit 300 μl LB/Glucose für 1 h bei 37 °C und 250 rpm regeneriert. Die Selektion erfolgt nach dem Ausstreichen der Bakterien auf LB-Agarplatten, die ein entsprechendes Antibiotikum beinhalten. |
3.3.3 Transformation von Bakterien
3.3.3.1 Herstellung chemisch kompetenter Bakterien Der E. coli Stamm wird auf einer LB-Agarplatte ausgestrichen und O/N bei 37°C inkubiert. 10 ml TYM-Medium werden mit einer Kolonie angeimpft und bei 37°C und 250 rpm für ca. 4 - 5 h inkubiert, bis eine OD600nm von 0.5 - 0.6 erreicht ist. Die Vorkultur wird mit TYM-Medium auf 100 ml aufgefüllt und weiter für ca. 1.5 h inkubiert. Die Kultur wird anschließend mit TYM-Medium auf 400 ml aufgefüllt, für eine weitere Stunde inkubiert und anschließend für 10 Min in einem Eiswasserbad unter Schwenken abgekühlt. Die Bakterien werden für 10 Min bei 4°C und 2.500 x g in einer vorgekühlten Zentrifuge pelletiert. Es folgt eine Resuspension der Bakterien in 100 ml vorgekühltem TfB1 und eine neuerliche Zentrifugation für 10 Min bei 4°C und 2.500 x g. Die Bakterien werden in 10 ml eiskaltem TfB2 resuspendiert und in 300 μl Aliquots in flüssigem Stickstoff schockgefroren. Die Aliquots werden in -80°C überführt, was eine dauerhafte Lagerung ermöglicht. Es wird je ein Aliquot auf einer LB-Platte mit Kanamycin und Ampicillin ausgestrichen und O/N bei 37°C [Seite 45] inkubiert, um eine unerwünschte Ausbildung spontaner Antibiotikaresistenzen auszuschließen. Durch die Transformation von 1 ng einer bekannten Plasmid-DNA wird die Kompetenz der hergestellten Bakterien ermittelt, wobei ein Wert von 107 Kolonien/μg erreicht werden sollte. 3.3.3.2 Transformation Für die Transformation mit Plasmid-DNA wird ein Aliquot des kompetenten E. coli Stammes auf Eis aufgetaut, mit der Plasmid-DNA (Bakterien: Plasmid-DNA 10:1) versetzt und für 30 Min auf Eis inkubiert. Anschließend wird ein Hitzeschock für 45 Sek bei 42°C durchgeführt. Nach einer weiteren Inkubationszeit von 5 Min auf Eis wird die Bakteriensuspension mit 300 μl SOC-Medium für 1 h bei 37°C und 250 rpm ankultiviert. Die Selektion erfolgt nach dem Ausstreichen der Bakterien auf LB-Agarplatten, die ein entsprechendes Antibiotikum beinhalten. |
Ein Verweis auf die Quelle fehlt. |
|
| [48.] Slo/Fragment 064 01 - Diskussion Bearbeitet: 17. July 2014, 20:15 WiseWoman Erstellt: 19. May 2014, 12:32 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 64, Zeilen: 1-13 |
Quelle: Schurek 2007 Seite(n): 45, Zeilen: 13-24 |
|---|---|
| 3.3.4 Transfektion eukaryoter Zellen
3.3.4.1 Transiente Transfektion von HEK 293T-Zellen Die transiente Transfektion von HEK 293T-Zellen erfolgt mittels Calcium-Phosphat- DNA-Präzipitaten. Die Zellen werden am Abend vor der Transfektion so geteilt, dass sie am nächsten Morgen zu ungefähr 60 % konfluent sind. Für die Transfektion einer 10 cm Zellkulturschale werden 500 μl 0.25 M Calciumchlorid (RT) und 10 μg Plamid-DNA vorgelegt. Unter Vortexen wird 500 μl 2 x HEBS (4 °C) tropfenweise dazugegeben. Anschließend wird die Transfektionslösung gleichmäßig tropfenweise, unter schwenken, auf den Zellen verteilt und die Zellkulturschale vorsichtig geschwenkt. Die Zellen werden im Zellkulturbrutschrank inkubiert. Nach 8 h erfolgt ein Mediumwechsel, der die Transfektionsreaktion beendet. 24-48 h nach der Transfektion können die Zellen für die Protein- oder RNA-Gewinnung lysiert oder für andere Versuche eingesetzt werden. |
3.3.4 Transfektion eukaryoter Zellen
Transiente Transfektion von HEK 293T-Zellen Die transiente Transfektion von HEK 293T-Zellen erfolgt mittels Calcium-Phosphat-DNA-Präzipitaten. Die Zellen werden am Abend vor der Transfektion so geteilt, dass sie am nächsten Morgen zu ungefähr 60 % konfluent sind. Für die Transfektion einer 10 cm Zellkulturschale werden in einem 1.5 ml Reaktionsgefäß 500 μl 0.25 M Calciumchlorid (RT) und 10 μg Plamid-DNA vorgelegt. Unter Vortexen wird 500 μl 2 x HEBS (4°C) tropfenweise dazugegeben. Anschließend wird die Transfektionslösung gleichmäßig tropfenweise auf den Zellen verteilt und die Zellkulturschale vorsichtig geschwenkt. Die Zellen werden im Zellkulturbrutschrank inkubiert. Nach 8 h erfolgt ein Mediumwechsel, der die Transfektionsreaktion beendet. 24 - 48 h nach der Transfektion können die Zellen für die Protein- oder RNA-Gewinnung lysiert oder für andere Versuche eingesetzt werden. |
Ein Verweis auf die Quelle fehlt. |
|
| [49.] Slo/Fragment 064 25 - Diskussion Bearbeitet: 17. July 2014, 20:17 WiseWoman Erstellt: 18. May 2014, 07:28 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 64, Zeilen: 25-29 |
Quelle: Schäfer 2004 Seite(n): 87, Zeilen: 3-7 |
|---|---|
| 3.3.4.3 Transiente Transfektion von COS-7 Zellen (Seed & Aruffo, 1987)
Die transiente Transfektion von COS-M7 erfolgt mittels DEAE-Dextran (modifiziert nach einer persönlichen Mitteilung von Brian Seed). Die Zellen werden einen Tag vor der Transfektion so geteilt, dass sie am Tag der Transfektion zu etwa 70 – 80 % konfluent sind. |
6.3.3 Transiente Transfektion von COS-M6-Zellen (Seed & Aruffo, 1987)
Die Transiente Transfektion von COS-M6 erfolgt mittels DEAE-Dextran (modifiziert nach einer persönlichen Mitteilung von Brian Seed). Die Zellen werden einen Tag vor der Transfektion so geteilt, dass sie am Tag der Transfektion zu etwa 70 – 80 % konfluent sind. |
Ein Verweis auf die Quelle fehlt. Die "persönliche Mitteilung" erging offenbar nicht an den Autor der Dissertation. Fortsetzung auf der nächsten Seite: Slo/Fragment 065 01. |
|
| [50.] Slo/Fragment 065 01 - Diskussion Bearbeitet: 17. July 2014, 20:14 WiseWoman Erstellt: 18. May 2014, 07:31 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 65, Zeilen: 1-7 |
Quelle: Schäfer 2004 Seite(n): 87, Zeilen: 8-13 |
|---|---|
| Die Zellen einer 140 mm Schale werden mit 10 ml Transfektionsmedium (DMEM, 10 % NU-Serum, 400 μg/ml DEAE-Dextran, 100 μM Chloroquin, 10 bis 20 μg Gesamt- DNA) versetzt und für 4 h bei 37 °C inkubiert. Anschließend erfolgt für 2 Min ein DMSO-Schock (10 ml PBS, 10 % (v/v) DMSO). Die Zellen werden im Kulturmedium (50 μg Gms/ml) weiterkultiviert. Nach einem Tag wird das Medium gewechselt und nach 48-72 h nach der Transfektion die Immunpräzipitation oder die Immunfluoreszenzmikroskopie durchgeführt. | Die Zellen einer 140 mm Schale werden mit 10 ml Transfektionsmedium (DMEM, 10 % NU-Serum, 400 μg/ml DEAE-Dextran, 100 μM Chloroquin, 10 bis 20 μg Gesamt-DNA) versetzt und für 3 h bei 37 °C inkubiert. Anschließend erfolgt für 2 Min ein DMSO-Schock (10 ml PBS, 10 % (v/v) DMSO). Die Zellen werden in [sic] Kulturmedium (50 μg Gms/ml) weiterkultiviert. Nach einem Tag wird das Medium gewechselt und nach zwei oder drei Tagen die Immunpräzipitation oder die Immunfluoreszenzmikroskopie durchgeführt. |
Ein Verweis auf die Quelle fehlt. Die Übernahme beginnt auf der Vorseite: Slo/Fragment 064 25. |
|
| [51.] Slo/Fragment 066 09 - Diskussion Bearbeitet: 17. July 2014, 20:05 WiseWoman Erstellt: 19. May 2014, 13:33 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 66, Zeilen: 9-13 |
Quelle: Schurek 2007 Seite(n): 54, Zeilen: 17-20 |
|---|---|
| Die Vordaten aus Ko-Immunpräzipitationsstudien, welche eine Wechselwirkung zwischen PATJ und TRPC3 sehr wahrscheinlich machten, sollten mit den nachfolgenden Experimenten überprüft und auf distinkte Bereiche eingegrenzt werden. Um die Interaktionsstudien innerhalb einer Spezies zeigen zu können, wurde mit dem humanen Homologon von CIPP, PATJ, und humanem TRPC3 sowie TRPC6 gearbeitet. | Die Vordaten zu der potentiellen Interaktion zwischen CIPP und KIBRA sollten mit den nachfolgenden Experimenten bestätigt und auf distinkte Bereiche eingegrenzt werden. Um die Interaktionsstudien innerhalb einer Spezies zeigen zu können, wurde mit dem humanem Homologon von CIPP, PATJ, und humanem KIBRA gearbeitet. |
Ein Verweis auf die Quelle fehlt. |
|
| [52.] Slo/Fragment 066 18 - Diskussion Bearbeitet: 17. July 2014, 20:06 WiseWoman Erstellt: 19. May 2014, 13:29 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 66, Zeilen: 18-21 |
Quelle: Schurek 2007 Seite(n): 57, Zeilen: 10-12 |
|---|---|
| Die transient transfizierten COS-7 Zellen wurden nach 24 h lysiert. Das Zelllysat wurde anschließend mit den GST-Fusionsproteinen inkubiert. Die Proben wurden auf einem SDS-PAA Gel aufgetrennt und einer Western Blot Analyse unterzogen. | Die transfizierten HEK 293T Zellen wurden nach 24 h lysiert. Das Zellysat wurde anschließend mit den GST-Fusionsproteinen inkubiert. Die Proben wurden auf einem SDS-PAA Gel aufgetrennt und einer Western Blot Analyse unterzogen. |
Ein Verweis auf die Quelle fehlt. |
|
| [53.] Slo/Fragment 067 01 - Diskussion Bearbeitet: 17. July 2014, 20:04 WiseWoman Erstellt: 19. May 2014, 13:39 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 67, Zeilen: 1-2 |
Quelle: Schurek 2007 Seite(n): 55, 58, Zeilen: 55: Abbildung; 58: 1ff |
|---|---|
| In Abbildung 4.1 ist eine schematische Darstellung des Proteins PATJ und der im GST-pulldown eingesetzten Verkürzungsmutanten dargestellt.
Abb. 4.1: Schematische Darstellung des humanen Gerüstproteins PATJ und den im GST pulldown Assays eingesetzten Verkürzungsmutanten. Die Abbildung zeigt schematisch die Domänenstruktur von PATJ mit einer N-terminalen L27-Domäne und zehn PDZ-Domänen (oben). Des Weiteren sind PATJ-Verkürzungsmutanten mit den PDZ-Domänen (von oben) 7-10, 8-10, 9-10, 10, 9, 8, 7 und 7-8 dargestellt. |

Abb. 4.1 A: Schematische Darstellung des humanen Gerüstproteins PATJ full length und den in Hefe Ko-Transformationen als prey eingesetzten Verkürzungsmutanten. Die Abbildung zeigt schematisch die Domänenstruktur von PATJ full length mit einer N-terminalen L27- Domäne und zehn PDZ-Domänen (oben). Des Weiteren sind PATJ-Verkürzungsmutanten mit den PDZDomänen (von oben) 7-10, 8-10, 9-10, 10, 9, 8, 7 und 7-8 dargestellt. Die schematisch abgebildeten Verkürzungsmutanten von PATJ wurden in Ko-Transformationsexperimenten im Hefesystem als baits eingesetzt. [Seite 58] In Abbildung 4.2 A ist eine schematische Darstellung des Proteins PATJ und der im GST-pulldown eingesetzten Verkürzungsmutanten dargestellt. Abb. 4.2 A: Schematische Darstellung von PATJ full length und den im GST-pulldown eingesetzten Verkürzungsmutanten. Humanes PATJ beinhaltet in seiner Struktur eine N-terminale L27-Domäne, sowie 10 PDZ-Domänen. Dargestellt sind die als GST-Fusionsproteine exprimierten Verkürzungsmutanten PATJ.PDZ 7- 10, 8-10 und 9-10. |
Ein Verweis auf die Quelle fehlt. Die Abbildung in der untersuchten Arbeit ist eine Kombination aus zwei Abbildungen der Quelle. |
|
| [54.] Slo/Fragment 068 01 - Diskussion Bearbeitet: 17. July 2014, 19:59 WiseWoman Erstellt: 19. May 2014, 13:56 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 68, Zeilen: 1ff (komplett) |
Quelle: Schurek 2007 Seite(n): 58, Zeilen: 3ff |
|---|---|
| Die folgende Abbildung 4.2 zeigt die Aufnahme eines Coomassie gefärbten SDS-PAA Gels. Dargestellt sind die, für den GST-pulldown exprimierten, GST-Fusionsproteine PATJ.PDZ7-10, 8-10 und 9-10, 10, 7, 8, 7-8.
Abb. 4.2: Aufnahme eines Coomassie gefärbten SDS-PAA-Gels mit rekombinant exprimierten, affinitätsgereinigten GST-Fusionsproteinen. Die Abbildung zeigt Verkürzungsmutanten von PATJ, die rekombinant als GST-Fusionsproteine exprimiert wurden. Zu sehen sind GST.PATJ.PDZ-Domäne 7-10 (Spur 2), 8-10 (Spur 3), 9-10 (Spur 4), 10 (Spur 5), 7 (Spur 6), 8 (Spur 7) und 7-8 (Spur 8). Ein Proteinmarker mit angegebenen Größen in kD wurde in Spur 1 aufgetragen. |
Abbildung 4.2 B zeigt die Aufnahme eines Coomassie gefärbten SDS-PAA Gels. Dargestellt sind die für den GST-pulldown exprimierten GST-Fusionsproteine PATJ.PDZ 7-10, 8-10 und 9-10.
Abb. 4.2 B: Aufnahme eines Coomassie gefärbten SDS-PAA-Gels mit rekombinant exprimierten, affinitätsgereinigten GST-Fusionsproteinen. Die Abbildung zeigt Verkürzungsmutanten von PATJ, die rekombinant als GST-Fusionsproteine exprimiert wurden. Zu sehen sind GST.PATJ.PDZ-Domäne 9-10 (Spur 2), 8-10 (Spur 3) und 7-10 (Spur 4). Ein Proteinmarker mit angegebenen Größen in kD wurde in Spur 1 aufgetragen. |
Ein Verweis auf die Quelle fehlt. Man beachte, dass die Quelle bei einem Teilexperiment zu identischen Ergebnissen kommt, dieser Umstand aber nicht erwähnt wird. |
|
| [55.] Slo/Fragment 072 22 - Diskussion Bearbeitet: 17. July 2014, 19:58 WiseWoman Erstellt: 19. May 2014, 15:00 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 72, Zeilen: 22-25 |
Quelle: Schurek 2007 Seite(n): 54, Zeilen: 18-22 |
|---|---|
| Um die Interaktionsstudien innerhalb einer Spezies zeigen zu können, wurde jeweils nur mit humanen Konstrukten gearbeitet. Zunächst wurden Ko-Transformationsexperimente im Hefesystem durchgeführt, in denen verschiedene Verkürzungsmutanten von PATJ (PDZ-Domänen 7-10 und L27-PDZ4) [...] | Um die Interaktionsstudien innerhalb einer Spezies zeigen zu können, wurde mit dem humanem Homologon von CIPP, PATJ, und humanem KIBRA gearbeitet. Zunächst wurden Ko- Transformationsexperimente im Hefesystem durchgeführt, in denen verschiedene Verkürzungsmutanten von PATJ (PDZ-Domänen 7-10, 8-10, 9-10, 10, 9, 8, 7 sowie 7-8) [...] |
Ein Verweis auf die Quelle fehlt. |
|
| [56.] Slo/Fragment 076 01 - Diskussion Bearbeitet: 17. July 2014, 19:57 WiseWoman Erstellt: 19. May 2014, 15:07 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 76, Zeilen: Legende |
Quelle: Schurek 2007 Seite(n): 56, Zeilen: Legende |
|---|---|
| Legende:
SD-L-T: Das Wachstum (++) von Hefekolonien auf SD-L-T stellt die erfolgreiche Transformation von bait- und prey-Plasmid sicher; SD-L-T-H + 50 mM 3-AT: Normales (+) bzw. schwaches (+/-) Wachstum von Hefekolonien auf SD-L-T-H; β-Gal-Assay: Blaufärbung (++) bzw. keine Farbreaktion (-) der Hefekolonien nach einem β-Galaktosidase Filter Assay. |
Legende:
Ko-Trafo=Ko-Transformation; SD-L-T: Das Wachstum (++) von Hefekolonien auf SD-L-T stellt die erfolgreiche Transformation von bait- und prey-Plasmid sicher; SD-L-T-H + 50 mM 3-AT: Normales (+) bzw. schwaches (+/-) Wachstum von Hefekolonien auf SD-L-T-H; β-Gal-Assay: Blaufärbung (++) bzw. keine Farbreaktion (-) der Hefekolonien nach einem β-Galaktosidase Filter Assay. |
Ein Quellenverweis fehlt. Selbst die Hervorhebung durch Fettdruck ist identisch zur Quelle. |
|
| [57.] Slo/Fragment 077 01 - Diskussion Bearbeitet: 17. July 2014, 19:55 WiseWoman Erstellt: 19. May 2014, 15:09 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 77, Zeilen: 1-4 |
Quelle: Schurek 2007 Seite(n): 57, Zeilen: 1-4 |
|---|---|
| Das β-Galaktosidase Filter Assay wurde mit ko-transformierten Hefekolonien durchgeführt, die auf SD-L-T-H + 50 mM 3-AT Medium gewachsen waren. Eine Blaufärbung der Hefekolonien konnte ausschließlich bei der Positivkontrolle, PATJ.L27-PDZ4/Klon 4.1 beobachtet werden. | Ein β-Galaktosidase Filter Assay wurde mit ko-transformierten Hefekolonien durchgeführt, die auf SD-L-T-H + 50 mM 3-AT Medium gewachsen waren. Eine Blaufärbung der Hefekolonien konnte ausschließlich bei der Positivkontrolle, PATJ.PDZ 8-10/KIBRA und PATJ.PDZ 8/KIBRA beobachtet werden, [...] |
Ein Verweis auf die Quelle fehlt. |
|
| [58.] Slo/Fragment 082 06 - Diskussion Bearbeitet: 17. July 2014, 19:54 WiseWoman Erstellt: 18. May 2014, 07:39 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 82, Zeilen: 6-11 |
Quelle: Schäfer 2004 Seite(n): 44, 45, Zeilen: 44: letzte 2 Zeilen - 45: 1-3 |
|---|---|
| Aus Vorarbeiten zu den Proteinen der TRPC Familie wurde antizipierbar, dass neben einer Ca2+-abhängigen kompetitiven Regulation durch IP3-Rezeptoren und Calmodulin auch eine Steuerung durch andere Proteine möglich ist, die das Signal vom Oberflächenrezeptor oder vom Ca2+-Speicher zum TRPC-Kanal leiten. Dazu können Adapterproteine ebenso wie das Aktin-Zytoskelett gehören, die eine korrekte Lokalisation der TRPC-Kanäle ermöglichen. | Neben einer Ca2+-abhängigen kompetetiven Regulation durch IP3-Rezeptoren und Calmodulin ist auch eine Steuerung durch andere Proteine denkbar, die das Signal vom
[Seite 45] Oberflächenrezeptor oder vom Ca2+-Speicher zum TRPC-Kanal leiten. Dazu können Adapterproteine ebenso wie das Actincytoskelett gehören, die eine korrekte Lokalisation der TRPC-Kanäle ermöglichen. |
Ein Verweis auf die Quelle fehlt, obwohl "Vorarbeiten" erwähnt werden. |
|
| [59.] Slo/Fragment 082 19 - Diskussion Bearbeitet: 17. July 2014, 19:54 WiseWoman Erstellt: 19. May 2014, 17:03 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 82, Zeilen: 19-26 |
Quelle: Schäfer 2004 Seite(n): 168, Zeilen: 9ff |
|---|---|
| Adapterproteine haben keine intrinsische katalytische oder signalgebende Aktivität, aber sie besitzen Motive und Domänen, die in der Lage sind, Protein-Protein- und Protein-Lipid-Wechselwirkungen zu vermitteln. Durch die zahlreichen Interaktionen, die durch Adaptoren stabilisiert werden, wird der Aufbau von großen Signalkomplexen möglich. Diese ermöglichen wiederum die Aktivierung von wichtigen Effektoren, einschließlich der Phospholipase γ (PLCγ) und der Phospholipase β (PLCβ), der Phosphatidylinosit-3-OH-Kinase (PI3-K) und Guanin-Nukleotid-Austauschfaktoren (GEF), die extrazelluläre Signale für die Signalleitung („signaling“) von kleinen [GTPasen (G-Proteinen), die Reorganisation des Zytoskeletts und die Genexpression, weiterleiten.] | Adapterproteine besitzen keine intrinsische katalytische Aktivität, aber sie besitzen Motive und Domänen, die in der Lage sind, Protein-Protein- und Protein-Lipid-Wechselwirkungen zu vermitteln. Durch die zahlreichen Interaktionen, die durch Adaptoren stabilisiert werden, wird der Aufbau von großen Signalkomplexen möglich. Diese ermöglichen wiederum die Aktivierung von wichtigen Effektoren einschließlich der Phospholipase γ (PLCγ), der Phosphatidylinosit-3-OH-Kinase (PI3-K) und Guanin-Nukleotid-Austauschfaktoren (GEF), die extrazelluläre Signale an die Signalleitung („signaling“) von kleinen GTPasen (G-Proteinen), die Reorganisation des Cytoskeletts, die Genexpression und letztlich an die Lymphocytenaktivierung und –funktionen koppeln. |
Ein Verweis auf die Quelle fehlt. |
|
| [60.] Slo/Fragment 083 01 - Diskussion Bearbeitet: 17. July 2014, 19:52 WiseWoman Erstellt: 19. May 2014, 17:07 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 83, Zeilen: 1-7 |
Quelle: Schäfer 2004 Seite(n): 168, Zeilen: 12ff |
|---|---|
| [Diese ermöglichen wiederum die Aktivierung von wichtigen Effektoren, einschließlich der Phospholipase γ (PLCγ) und der Phospholipase β (PLCβ), der Phosphatidylinosit-3-OH-Kinase (PI3-K) und Guanin-Nukleotid-Austauschfaktoren (GEF), die extrazelluläre Signale für die Signalleitung („signaling“) von kleinen] GTPasen (G-Proteinen), die Reorganisation des Zytoskeletts und die Genexpression, weiterleiten. Die Modulation der Funktion eines Proteins durch Adaptermoleküle kann auf zwei verschiedenen Wegen erfolgen. Einerseits kann die Wirkungsweise direkt manipuliert werden, indem durch den Adapter Bindestellen blockiert oder zwei Proteine in räumliche Nähe gebracht werden. Andererseits können Adaptermoleküle die Lokalisation eines Enzyms, Transkriptionsfaktors oder Kanalproteins beeinflussen und so das Zielprotein regulieren. | Diese ermöglichen wiederum die Aktivierung von wichtigen Effektoren einschließlich der Phospholipase γ (PLCγ), der Phosphatidylinosit-3-OH-Kinase (PI3-K) und Guanin-Nukleotid-Austauschfaktoren (GEF), die extrazelluläre Signale an die Signalleitung („signaling“) von kleinen GTPasen (G-Proteinen), die Reorganisation des Cytoskeletts, die Genexpression und letztlich an die Lymphocytenaktivierung und –funktionen koppeln. Die Modulation der Funktion eines Proteins durch Adaptermoleküle kann auf zwei verschiedenen Wegen erfolgen. Einerseits kann die Wirkungsweise direkt manipuliert werden, indem durch den Adapter Bindestellen blockiert oder zwei Proteine in räumliche Nähe gebracht werden. Andererseits können Adaptermoleküle die Lokalisation eines Enzyms, Transkriptionsfaktors oder Kanalproteins beeinflussen und so das Zielprotein regulieren. |
Ein Verweis auf die Quelle fehlt. |
|
| [61.] Slo/Fragment 083 16 - Diskussion Bearbeitet: 17. July 2014, 19:52 WiseWoman Erstellt: 19. May 2014, 15:19 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 83, Zeilen: 16-21, 23-30 |
Quelle: Schurek 2007 Seite(n): 88, 90, Zeilen: 88: 23ff; 90: 13ff |
|---|---|
| Indem Gerüstproteine wie PATJ über Protein-Protein-Interaktionsdomänen andere Proteine rekrutieren, können in definierten Arealen innerhalb der Zelle multiple Proteinkomplexe ausgebildet werden. Dabei werden Proteine, die PDZ-Domänen beinhalten, selbst durch Syntheseleistungen, Degradationsereignisse, subzelluläre Verteilung und posttranslationale Modifikationen reguliert (Kin & Sheng, 2004).
[...] Noch vor der Entdeckung des humanen PATJ beschrieben Kurschner et al., in ihrer 1998 veröffentlichten Arbeit, das murine Homologon CIPP (channel-interacting PDZ domain protein), ein bis dato unbekanntes Protein (Kurscher et al., 1998). Die Untersuchung verschiedener muriner Gewebe ergab die Expression von CIPP-mRNA in der Niere und dem Gehirn. Interaktionen zwischen CIPP.PDZ 2 (die PATJ.PDZ 8 entspricht) und verschiedenen K+-Kanälen (Kir 4.1/4.2, inward rectifying K+ channel), dem NMDA-Rezeptor 2A (N-methyl-D-aspartate-glutamate receptor 2A) und dem neuronalen Zelloberflächenmolekül Neurolignin [wurden identifiziert.] |
Indem Gerüstproteine wie PATJ über Protein-Protein-Interaktionsdomänen andere Proteine
rekrutieren, können in definierten Arealen innerhalb der Zelle multiple Proteinkomplexe ausgebildet werden. Dabei werden Proteine, die PDZ-Domänen beinhalten, selbst durch Syntheseleistungen, Degradationsereignisse, subzelluläre Verteilung und posttranslationale Modifikationen reguliert [40]. [Seite 90] Noch vor der Entdeckung von humanem PATJ beschrieben Kurschner et al. in ihrer 1998 veröffentlichten Arbeit das murine Homologon CIPP (Channel-interacting PDZ domain protein), ein bis dato unbekanntes Protein [46]. Die Untersuchung verschiedener muriner Gewebe ergab die Expression von CIPP mRNA in der Niere und dem Gehirn. Die im Gehirn exprimierte, kürzere Variante des Proteins beinhaltet vier PDZ-Domänen und wurde in Interaktionsstudien eingesetzt. Interaktionen zwischen CIPP.PDZ 2 (die PATJ.PDZ 8 entspricht) und verschiedenen K+-Kanälen (Kir 4.1/4.2, inward rectifying K+ channel), dem NMDA-Rezeptor 2A (N-methyl-D-aspartate-glutamate receptor 2A) und dem neuronalen Zelloberflächenmolekül Neurolignin wurden identifiziert. 40. Kim E, Sheng M: PDZ domain proteins of synapses. Nat Rev Neurosci 2004;5:771- 781. 46. Kurschner C, Mermelstein PG, Holden WT, Surmeier DJ: CIPP, a novel multivalent PDZ domain protein, selectively interacts with Kir4.0 family members, NMDA receptor subunits, neurexins, and neuroligins. Mol Cell Neurosci 1998;11:161-172. |
Ein Verweis auf die Quelle fehlt. |
|
| [62.] Slo/Fragment 084 01 - Diskussion Bearbeitet: 17. July 2014, 19:49 WiseWoman Erstellt: 19. May 2014, 15:33 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 84, Zeilen: 1-12 |
Quelle: Schurek 2007 Seite(n): 90, Zeilen: 21-31 |
|---|---|
| Abgesehen von Neurolignin, dessen Aminosäuresequenz mit TTRV abschließt, enden die C-Termini der genannten CIPP.PDZ 2 Interaktionspartner mit einem XSXV-Motiv. Demnach handelt es sich bei CIPP.PDZ 2 (PATJ.PDZ 8) um eine PDZ-Domäne der Klasse I (Vgl. Tab. 1.1).
Obwohl PATJ zehn PDZ-Domänen besitzt, konnten bisher nur zwei direkte Interaktionspartner identifiziert werden (Shin et al., 2006). Das tight junction-assoziierte Protein ZO-3 bindet über die C-terminale Sequenz TDL an PATJ.PDZ6, einer PDZ-Domäne der Klasse I (Vgl. Tab. 1.1) (Lemmers et al., 2002; Roh et al., 2002). Claudine stellen eine Familie transmembranärer Proteine dar, die an der Calcium-unabhängigen Zell-Zell-Adhäsion beteiligt sind. Claudin-1, ein Mitglied dieser Proteinfamilie, bindet über die letzten C-terminalen Aminosäuren (KD)YV an PATJ.PDZ 8, wodurch diese sich der Klasse III zuordnen lässt (Vgl. Tab. 1.1) (Roh et al., 2002; Shin et al., 2006). |
Abgesehen von Neurolignin, dessen Aminosäuresequenz mit TTRV abschließt, enden die C-Termini der genannten CIPP.PDZ 2 Interaktionspartner mit einem XSXV-Motiv. Demnach handelt es sich bei CIPP.PDZ 2 (PATJ.PDZ 8) um eine PDZ-Domäne der Klasse I (Vgl. Tab. 1.1).
Obwohl PATJ zehn PDZ-Domänen beinhaltet, konnten bisher nur zwei direkte Interaktionspartner dieser Module identifiziert werden [91]. Das tight junction-assoziierte Protein ZO-3 bindet über die C-terminale Sequenz TDL an PATJ.PDZ 6, einer PDZ-Domäne der Klasse I (Vgl. Tab. 1.1) [51;79]. Claudine stellen eine Familie transmembranärer Proteine dar, die an der Calcium-unabhängigen Zell-Zell-Adhäsion beteiligt sind. Claudin-1, ein Mitglied dieser Proteinfamilie, bindet über die letzten C-terminalen Aminosäuren (KD)YV an PATJ.PDZ 8, wodurch diese sich der Klasse III zuordnen lässt (Vgl. Tab. 1.1) [79;91]. 51. Lemmers C, Medina E, Delgrossi MH, Michel D, Arsanto JP, Le BA: hINADl/PATJ, a homolog of discs lost, interacts with crumbs and localizes to tight junctions in human epithelial cells. J Biol Chem 2002;277:25408-25415. 79. Roh MH, Liu CJ, Laurinec S, Margolis B: The carboxyl terminus of zona occludens-3 binds and recruits a mammalian homologue of discs lost to tight junctions. J Biol Chem 2002;277:27501-27509. 91. Shin K, Fogg VC, Margolis B: Tight junctions and cell polarity. Annu Rev Cell Dev Biol 2006;22:207-235. |
Ein Verweis auf die Quelle fehlt. Man beachte, dass die in der Quelle "Tabelle 1.1." genannte Tabelle in der untersuchten Arbeit die Tabelle 1.3. ist. |
|
| [63.] Slo/Fragment 084 18 - Diskussion Bearbeitet: 17. July 2014, 20:47 WiseWoman Erstellt: 19. May 2014, 15:42 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 84, Zeilen: 18-20.21-24 |
Quelle: Schurek 2007 Seite(n): 89, 90, Zeilen: 89: letzte Zeile - 90: 1-4 |
|---|---|
| Im Allgemeinen können mit pulldown Experimenten starke Protein-Protein-Interaktionen nachgewiesen werden, da schwache Bindungen durch die diversen Waschschritte zerstört würden. Deshalb wäre zu erwarten gewesen, dass die Daten im Hefesystem bestätigt würden. Im Hefesystem rekombinant exprimierte Proteine werden nur unvollständig posttranslational modifiziert, wobei es sich um eine in vivo Methode zur Untersuchung von Protein-Protein-Interaktionen handelt. | Im Allgemeinen können mit pulldown Experimenten ausschließlich sehr starke
[Seite 90] Protein-Protein-Interaktionen nachgewiesen werden, da schwache Bindungen durch die diversen Waschschritte zerstört würden. Obgleich im Hefesystem rekombinant exprimierte Proteine nur unvollständig posttranslational modifiziert werden, handelt es sich um eine in vivo Methode zur Untersuchung von Protein-Protein-Interaktionen. |
Ein Verweis auf die Quelle fehlt. |
|
| [64.] Slo/Fragment 085 02 - Diskussion Bearbeitet: 17. July 2014, 19:47 WiseWoman Erstellt: 19. May 2014, 15:38 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schurek 2007, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 85, Zeilen: 2-10 |
Quelle: Schurek 2007 Seite(n): 89, Zeilen: 9-16 |
|---|---|
| Das unterschiedliche Bindungsverhalten erscheint zunächst kontrovers; die dreidimensionale Struktur eines Proteins kann durch Verkürzungsmutanten jedoch erheblich verändert sein. Bei Bindungsstudien, in denen beide Interaktionspartner bis auf die Bindungsmotive minimal verkürzt exprimiert werden, kann es zu Verschiebungen der Ladung und so der räumlichen Struktur der Proteinfragmente kommen, was in einem veränderten Interaktionsverhalten resultieren kann. In diesem Zusammenhang zeigten Stiffler et al. 2006, dass Bindungsstudien verschiedene Resultate ergaben, wenn einzelne PDZ-Domänen eines Proteins im Vergleich zu Verkürzungsmutanten, die mehrere PDZ-Domänen beinhalteten, eingesetzt wurden (Stiffler et a., 2006). | Das unterschiedliche Bindungsverhalten erscheint zunächst kontrovers, die dreidimensionale Struktur eines Proteins kann durch Verkürzungsmutanten jedoch erheblich verändert sein. Bei Bindungsstudien, in denen beide Interaktionspartner bis auf die Bindungsmotive minimal verkürzt exprimiert werden, kann es zu Verschiebungen der Ladung und so der räumlichen Struktur der Proteinfragmente kommen, was in einem veränderten Interaktionsverhalten resultieren kann. In diesem Zusammenhang zeigten Stiffler et al. 2006, dass Bindungsstudien verschiedene Resultate ergaben, wenn einzelne PDZ-Domänen eines Proteins im Vergleich zu Verkürzungsmutanten, die mehrere PDZ-Domänen beinhalteten, eingesetzt wurden [98].
98. Stiffler MA, Grantcharova VP, Sevecka M, MacBeath G: Uncovering quantitative protein interaction networks for mouse PDZ domains using protein microarrays. J Am Chem Soc 2006;128:5913-5922. |
Ein Verweis auf die Quelle fehlt. |
|
| [65.] Slo/Fragment 085 12 - Diskussion Bearbeitet: 17. July 2014, 19:48 WiseWoman Erstellt: 18. May 2014, 00:57 (Hindemith) | Bormann 2001, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Slo |
|
|
| Untersuchte Arbeit: Seite: 85, Zeilen: 12-24 |
Quelle: Bormann 2001 Seite(n): 17, Zeilen: 15ff |
|---|---|
| Obgleich das Yeast two-hybrid System erfolgreich zur Identifizierung neuer Bindungspartner diverser Proteine eingesetzt wurde, besitzt es dennoch Nachteile und Grenzen. Da der Interaktionsnachweis im Nukleus der Hefe erfolgt, können die untersuchten Fusionsproteine toxisch für die Zelle sein. Des Weiteren können viele in die Transkriptionsmaschinerie eingreifende Proteine im klassischen Yeast two-hybrid System nicht verwendet werden, da sie autoaktivierend wirken und somit das System kurzschließen. Zum anderen besteht die Möglichkeit, dass Interaktionen, die normalerweise im Zytosol oder an der Zellmembran stattfinden, im Kern der Hefe nicht erfolgen (Colas and Brent, 1998). So zeigte sich bei dem Versuch, alle möglichen Protein-Protein-Interaktionen des Hefe-Genoms mit Hilfe des Yeast two-hybrid Systems zu identifizieren, dass Proteine membranständigen Ursprungs mit einem Anteil von nur 8 % aller entdeckten Wechselwirkungen deutlich unterrepräsentiert sind (Uetz et al., 2000). | Obgleich das Yeast two-hybrid System erfolgreich zur Identifizierung neuer Bindungspartner diverser Proteine eingesetzt wurde, besitzt es dennoch Nachteile und Grenzen. Da der Interaktionsnachweis im Kern der Hefe erfolgt, können die untersuchten Fusionsproteine toxisch für die Zelle sein. Desweiteren können viele in die Transkriptionsmaschinerie eingreifende Proteine im klassischen Yeast two-hybrid System nicht verwendet werden, da sie autoaktivierend wirken und somit das System kurzschließen. Zum anderen besteht die Möglichkeit, daß Interaktionen, die normalerweise im Zytosol oder an der Zellmembran stattfinden, im Kern der Hefe nicht erfolgen (Colas and Brent, 1998). So zeigte sich bei dem Versuch, alle möglichen Protein-Protein-Interaktionen des Hefe-Genoms mit Hilfe des Yeast two-hybrid Systems zu identifizieren, daß Proteine membranständigen Ursprungs mit einem Anteil von nur 8% aller entdeckten Wechselwirkungen deutlich unterrepräsentiert sind (Uetz et al., 2000). |
Ein Verweis auf die Quelle fehlt. |
|
| [66.] Slo/Fragment 086 02 - Diskussion Bearbeitet: 17. July 2014, 19:42 WiseWoman Erstellt: 19. May 2014, 17:11 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 86, Zeilen: 2-8 |
Quelle: Schäfer_2004 Seite(n): 46, Zeilen: 13-19 |
|---|---|
| Als ein weiterer Erklärungsansatz dienen die verschiedenen Modelle zur Aktivierung rezeptorgesteuerter Ca2+-Kanäle, welche demnach nicht strikt getrennt, sondern Grenzfälle darstellen, für die es zahlreiche Mischfälle gibt. Je nachdem wie der TRPC-Kanal zusammengesetzt ist und wie stark die Bindung der beteiligten TRPC-Proteine an den IP3R, an CaM, das Aktin-Zytoskelett und an Adapterproteine ist, können die resultierenden Kanäle auf unterschiedliche Weise reguliert werden, wobei sich verschiedene Wege überschneiden, ergänzen oder parallel verlaufen können. | Die verschiedenen Modelle zur Aktivierung rezeptorgesteuerter Ca2+-Kanäle sind demnach nicht strikt getrennt, sondern stellen Grenzfälle dar, für die es zahlreiche Mischfälle gibt. Je nachdem wie der TRPC-Kanal zusammengesetzt ist und wie stark die Bindung der beteiligten TRPC-Proteine an den IP3R, an CaM, das Actincytoskelett und an Adapterproteine ist, können die resultierenden Kanäle auf unterschiedliche Weise reguliert werden, wobei verschiedene Wege sich überschneiden, ergänzen oder parallel verlaufen können. |
Ein Verweis auf die Quelle fehlt. |
|
| [67.] Slo/Fragment 086 19 - Diskussion Bearbeitet: 17. July 2014, 19:43 WiseWoman Erstellt: 18. May 2014, 09:50 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Slo, Verschleierung, Wikipedia, Wikipedia TRP-Kanäle 2008 |
|
|
| Untersuchte Arbeit: Seite: 86, Zeilen: 19-24 |
Quelle: Wikipedia TRP-Kanäle 2008 Seite(n): 1 (internet Quelle), Zeilen: - |
|---|---|
| Die Frage der Zusammensetzung, der in der Natur vorkommenden TRPC-Kanäle, ist nicht leicht zu beantworten, da sich die Untereinheiten in heterologen Expressionssystemen signifikant anders verhalten könnten als in nativen Zellen. Des Weiteren gibt es kaum wirklich spezifische Antikörper. Deshalb sind die Daten dazu in der gesamten Literatur teilweise widersprüchlich (Goel & Sinkins, 2002; Hofmann et al., 2002; Schilling & Goel, 2004; Strubing et al., 2001; Strubing et al., 2003). | Die Frage der Zusammensetzung der in der Natur vorkommenden TRPC-Kanäle ist nicht leicht zu beantworten, da sich die Untereinheiten in heterologen Expressionssystemen anders verhalten könnten als in nativen Zellen. Des Weiteren gibt es kaum wirklich spezifische Antikörper. Deshalb sind die Daten dazu zur Zeit noch teilweise widersprüchlich. |
Ein Verweis auf die Quelle fehlt. |
|
| [68.] Slo/Fragment 086 25 - Diskussion Bearbeitet: 17. July 2014, 19:44 WiseWoman Erstellt: 19. May 2014, 17:14 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Schäfer 2004, Slo |
|
|
| Untersuchte Arbeit: Seite: 86, Zeilen: 25-28 |
Quelle: Schäfer 2004 Seite(n): 46, Zeilen: 3-6 |
|---|---|
| Verschiedene TRPC-Proteine scheinen also über verschiedene Mechanismen reguliert zu werden, wobei sich das Kopplungsmodell und das sekretionsähnliche Modell gegenseitig ergänzen anstatt auszuschließen. Der Mechanismus kann darüber hinaus auch vom Zelltyp und spezifisch exprimierten Adaptermolekülen beeinflusst werden. | Verschiedene TRPC-Proteine scheinen also über verschiedene Mechanismen reguliert zu werden, wobei sich das Kopplungsmodell und des [sic] sekretionsähnliche Modell gegenseitig ergänzen anstatt auszuschließen. Der Mechanismus kann darüber hinaus auch vom Zelltyp und spezifisch exprimierten Adaptermolekülen beeinflusst werden. |
Ein Verweis auf die Quelle fehlt. Dies ist der letzte Abschnitt der untersuchten Arbeit vor der Zusammenfassung. |
|